甘蓝型油菜湿害相关基因BnLDH-1的克隆和表达分析
吴金海,周玉堂,谢伶俐,张学昆,许本波*
(1.长江大学 生命科学学院,湖北 荆州 434025; 2.孝感市农业科学院,湖北 孝感 432000;3.中国农业科学院 油料作物研究所,湖北 武汉432600)
甘蓝型油菜湿害相关基因BnLDH-1的克隆和表达分析
吴金海1,周玉堂2,谢伶俐1,张学昆3,许本波1*
(1.长江大学 生命科学学院,湖北 荆州 434025; 2.孝感市农业科学院,湖北 孝感 432000;3.中国农业科学院 油料作物研究所,湖北 武汉432600)
采用RACE技术从中双9号中克隆了甘蓝型油菜BnLDH-1基因全长cDNA序列和基因组序列。BnLDH-1基因的DNA序列为1 432 bp,包含1个内含子;cDNA序列全长1 319 bp,含有1个1 053 bp的ORF,其编码蛋白含350个氨基酸。经预测发现,BnLDH-1蛋白存在LDH-1保守结构域。qRT-PCR结果表明,湿害诱导BnLDH-1表达,但在不同耐湿性甘蓝型油菜品种中,BnLDH-1的诱导表达水平不同。相关分析表明,湿害胁迫后48 h的BnLDH-1表达量与12份测试的甘蓝型油菜材料的耐湿指数呈显著负相关,其相关系数为0.73。
甘蓝型油菜; 克隆; 表达; 乳酸脱氢酶; 耐湿
甘蓝型油菜(BrassicanapusL.)是我国乃至世界上最重要的油料作物,其生产常受到湿害的胁迫。湿害造成土壤和大气中CO2和O2交换困难,土壤缺氧,从而给植物生长带来危害,造成植物落叶、生长受抑制,甚至造成植株死亡[1],可导致油菜减产17.0%~42.4%[2]。
湿害过程中,由于O2在土壤中的溶解度和扩散系数降低而造成植物O2胁迫[3]。蛋白质2维电泳分析结果表明,湿害造成玉米根部20多种蛋白质的差异表达,这些蛋白质参与糖的无氧和有氧代谢[4-5]。在O2胁迫条件下,植物启动无氧代谢途径有利于提高植物对环境的适应能力,维持植物生长发育[6-7]。湿害过程中,一系列酶,包括乙醛脱氢酶(FDH,EC1.2.1.2)、乙醇脱氢酶(ADH,EC1.1.1.1)、乳酸脱氢酶(LDH,EC1.1.1.27) 和丙酮酸脱酸酶(PDC,EC4.1.1.1)被诱导表达[7-8]。研究表明,植物的耐湿性与植物湿害过程中腺嘌呤核苷三磷酸(ATP)含量、ADH和PDC的诱导表达水平密切相关[9-10]。相同量的糖分子在无氧条件下分解产生的ATP量低于有氧条件,因此,植物必须加速进行糖酵解和糖代谢[11]。根据Davis-Roberts pH假说,植物对O2胁迫的第一反应是产生大量的乳酸,降低细胞中pH值,激活PDC和ADH的转录,并抑制LDH的转录,启动乙醇代谢途径[12]。为研究LDH在甘蓝型油菜耐湿中的作用,从甘蓝型油菜中双9号中克隆出BnLDH-1,利用qRT-PCR研究了BnLDH-1在不同耐湿性甘蓝型油菜中的表达特征及与甘蓝型油菜耐湿性指数的关系。
1 材料和方法
1.1 试验材料
根据田间淹水试验结果,从4 000个材料中选取12个具有不同耐湿能力的甘蓝型油菜品系作为试验材料,包括中双9号、H305、秦油8号、955、H04、H1020、PH36、沪油17、GH01、中双6号、2021和中双11号。
1.2 甘蓝型油菜耐湿指数的计算
对于12份甘蓝型油菜材料,分别取100粒发芽种子,在20 ℃条件下浸泡24 h,然后取出种子,用双蒸水冲洗2次[13],对照发芽种子不作20 ℃条件下浸泡24 h处理。将种子平铺于9 cm 培养皿中,第7天,记录平均萌发率、成苗率、幼苗根长,并计算耐湿指数。耐湿指数=(处理成苗率×处理幼苗根长)/ (对照成苗率×对照幼苗根长)[14]。在甘蓝型油菜成熟期,计算单株的籽粒产量。
1.3 甘蓝型油菜BnLDH-1基因的全长cDNA扩增及序列分析
利用CTAB法提取甘蓝型油菜的DNA[15]和RNA[16],利用RNase-free DNase I (TaKaRa)除去RNA中混有的微量DNA。按照SuperScript Ⅲ First-Strand Synthesis Super Mix(Invitrogen)说明书完成cDNA的合成。对来自拟南芥(Arabidopsisthaliana)(NM_117832)、玉米(Zeamays)(AY109690)等物种的LDH基因的核苷酸序列进行多重比对,设计甘蓝型油菜BnLDH-1基因的3′和5′RACE一扩和巢式PCR扩增引物(表1)。其中,引物FBnLDH-31和FBnLDH-32与试剂盒3′RACE引物配对用于3′ cDNA 末端扩增,引物RBnLDH-51和RBnLDH-52与试剂盒5′RACE引物配对用于5′cDNA末端扩增,按照GeneRacer 试剂盒 (Invitrogen, USA)说明书分别进行甘蓝型油菜BnLDH-1的3′及5′RACE扩增。扩增体系为50 μL:10×PCR Buffer 5 μL、25 mmol/L MgCl23 μL、10 mmol/L dNTP 1 μL、试剂盒引物1 μL、 RACE引物1 μL、cDNA 1 μL、Taq酶 (5 U/μL)0.5 μL、ddH2O 37.5 μL。PCR反应程序为:94 ℃ 2 min;94 ℃ 1 min,52 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。
根据5′和3′末端测序结果,设计1对引物FBnLDH/RBnLDH(表1)用于扩增甘蓝型油菜BnLDH-1全长cDNA及对应的基因组序列。PCR产物经过电泳、凝胶回收后连接到pMD18-T载体,交由北京三博生物有限工程测序。利用软件Vector NTI Advance 9.0对测定序列进行分析,查找开放阅读框(ORF),翻译成蛋白质,并进行蛋白质参数计算。利用BLAST (http://www.ncbi.nlm.nih.gov/)分析核酸、蛋白质的同缘性。在EXPASY网站 (http://www.expasy.org and http://www.softberry.com/berry.phtml)进行蛋白质结构和性质分析。

表1 PCR引物名称及序列
1.4 甘蓝型油菜中BnLDH-1表达谱分析
将12份材料种植于中国农业科学院油料作物研究所试验地,在花期进行淹水处理至地面积水10 cm,取淹水处理0、24、48 h的根系材料保存于-80 ℃,提取RNA,并反转录成cDNA。根据拟南芥actin基因序列设计甘蓝型油菜actin基因扩增引物FACT/RACT(表2),以actin基因为内参基因,根据SYBR®PrimeScript®RT-PCR 试剂盒(TaKaRa)说明书,采用BnLDH-1基因qRT-PCR引物QFLDH/QRLDH检测12份甘蓝型油菜材料BnLDH-1基因转录水平。qRT-PCR在荧光定量PCR仪(iQ5,Bio-Rad,USA)中进行,反应体系按照TaKaRa公司SYBR Premix ExTaq试剂盒的操作说明配制,总共25 μL:2×One Step SYBR®RT-PCR Buffer Ⅲ 12.5 μL、TaKaRa ExTaqHS(5 U/μL)0.5 μL、PrimeScript RT Enzyme Mix Ⅱ 0.5 μL、QFLDH(10 μmmol/L)0.5 μL、QRLDH(10 μmmol/L)0.5 μL、RNA 2.0 μL、无RNA酶的H2O 8.5 μL,反应程序为:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 45 s,40个循环。每个反应重复3次,并且以标准差小于0.25为选择标准,数据分析采用iQ5 PCR 仪器附带的数据分析系统(iQ5 Optical System Software,Version 2.1) 进行。
2 结果与分析
2.1BnLDH-1全长cDNA序列的克隆及序列分析
分别以cDNA和基因组DNA为模板,利用引物FBnLDH/RBnLDH分别成功地扩增出1条约1.3 kb的亮带和1条约1.4 kb的亮带,将该基因命名为BnLDH-1。经测序发现,其基因组DNA全长为1 432 bp,其遵循标准的内含子剪接方式:GT…AG,只包含1个内含子。其cDNA全长为1 319 bp,5′UTR长度为92 bp,ORF长度为1 053 bp,3′UTR长度为174 bp;另外,在polyA上游20 bp的序列ATAAA与已知的大多数的植物的加尾信号序列AATAAA在序列特征和位置上相似,因此它可能充当BnLDH-1基因的加尾信号(图1)。

ATG和TAA用下划线和粗体表示,内含子用灰字体表示,N35—Q347的保守域用灰背景表示,加尾信号AATTAA用下划线表示图1 BnLDH-1的核酸序列及其编码氨基酸序列
经NCBI Blastn分析表明,BnLDH-1和来自十字花科的白菜(Brassicarapa)、甘蓝(Brassicaoleracea)、山萮菜(Eutremasalsugineum)和琴叶拟南芥(Arabidopsislyrata)的LDH基因的同源性最高,分别为94.0%、78.2%、78.4%和74.3%,和其他一些植物的LDH基因的同源性也比较高。
对BnLDH-1的开放读码框进行翻译,得到1个由350个氨基酸组成的37.52 ku的多肽链,其等电点为5.82。Blastp结果表明,BnLDH-1蛋白序列与许多已知的植物LDH蛋白具有很高的相似性,与甘蓝的LDH蛋白相似性最高,其与甘蓝、拟南芥和山萮菜LDH蛋白的一致性/相似性分别为99.7%/98.6%、94.3%/90.7%和96.3%/91.5%,说明在十子花科LDH蛋白进化过程中,该蛋白序列非常保守。
多重比对和聚类分析结果表明,BnLDH-1蛋白和来自十字花科植物甘蓝和白菜的LDH蛋白聚成1个亚类(图2)。其中,BnLDH-1与甘蓝LDH的遗传距离最近,它们与同属十字花科的拟南芥(Arabidopsisthaliana)、琴叶拟南芥、山萮蔡、荠菜(Capsellarubella)以及荠蓝(Camelinasativa)的LDH遗传距离也比较近,形成1个大类(图2)。

各LDH蛋白的GenBank序列号分别为ALLDH:XP_002870113.1,AtLDH:AAM64829.1,CrLDH:XP_006284020.1,CsLDH:XP_010434693.1,BoLDH:XP_013595446.1,BrLDH:XP_009144619.1,EsLDH:XP_006414250.1,CasiLDH:ADM88555.1,VvLDH:XP_002274162.3,GaLDH:EPS59698.1,JcLDH:XP_012069951.1,CsiLDH:XP_006477218.1,GmLDH:XP_003549909.1,NtaLDH:AIL30517.1,NtLDH:XP_009602609.1,StLDH:XP_006355475.1,SiLDH:XP_004951206.1
图2 BnLDH-1蛋白系统发育树
NCBI保守域搜索结果表明,BnLDH-1蛋白的N11到Q347区域存在LDH-1保守结构域。SignalP 3.0预测表明,BnLDH-1蛋白没有信号肽;TargetP预测表明,BnLDH-1蛋白位于叶绿体、线粒体的可能性很小;PSORT预测表明,BnLDH-1蛋白可能定位于细胞质中,结合BnLDH-1蛋白功能分析,BnLDH-1蛋白应该位于细胞质中;而TMpred预测表明,BnLDH-1蛋白具有5个强的跨膜结构。
利用SOPMA软件预测BnLDH-1二级结构(图3)发现,该蛋白的二级结构含有36.57%的α螺旋、25.14%的延伸链、6.57%的β转角和31.71%的随机卷曲。BnLDH-1蛋白的中部有4个大型的α螺旋,同时在其尾部(C-末端)也有类似的2个大型α螺旋。在其头部(N-末端)均有大量随机卷曲,且不存在α螺旋;同时在其中部α螺旋与尾部α螺旋之间存在转角与延伸链交错的结构。

h:α螺旋; e: 延伸链; t:β转角; c: 随机卷曲。线条从长变短分别表示h、e、t、c
2.2 12个甘蓝型油菜材料的耐湿指数
由表2可知,12份甘蓝型油菜材料的耐湿指数存在极显著差异,中双9号最大,为82.3,其次为H1020,GH01最小,为13.2,PH36次之;籽粒产量损失与之相反,即耐湿指数越大的材料,湿害处理后其产量损失越小,表明这些材料适合用于甘蓝型油菜耐湿性分析。
2.3BnLDH-1在甘蓝型油菜中的表达特征
由图4可知,在湿害处理过程中,12份甘蓝型油菜材料的BnLDH-1表达量存在明显差异,但变化趋势基本相同。在0~24 h的胁迫过程中,各材料的BnLDH-1表达量缓慢升高,但在24~48 h,BnLDH-1表达量迅速升高。在PH36和GH01这些耐湿指数比较低的材料中,BnLDH-1表达量的增加幅度明显高于高耐湿指数材料(如中双11号和中双9号)(图4)。相关分析表明,耐湿指数与湿害胁迫处理48 h的BnLDH-1表达量呈显著负相关,其相关系数为0.73(图5)。

表2 12个不同耐湿材料的耐湿指数和产量损失
注:同列数据后不同大写字母表示差异极显著(P<0.01)。
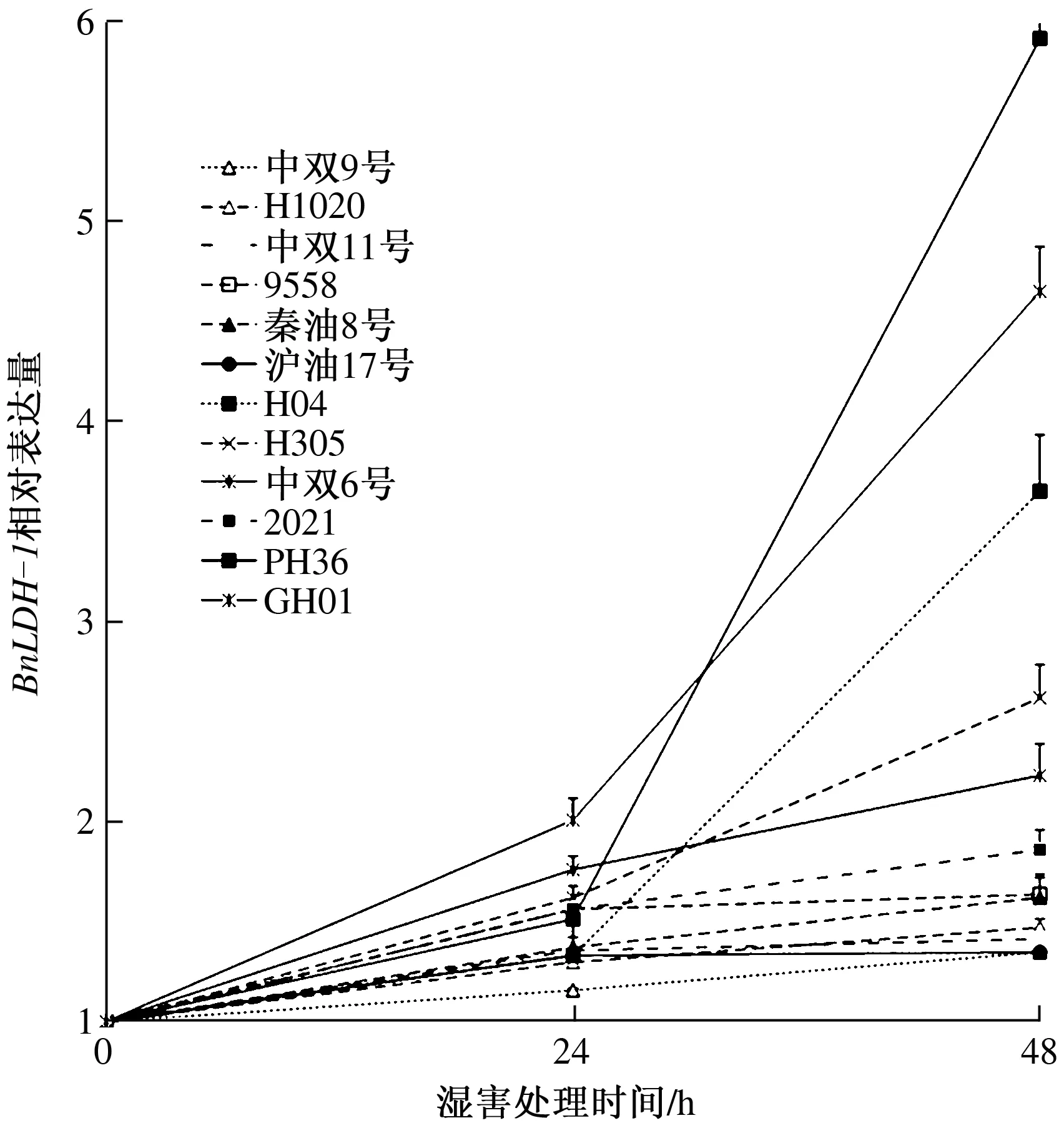
图4 不同湿害胁迫时间下BnLDH-1相对表达量变化
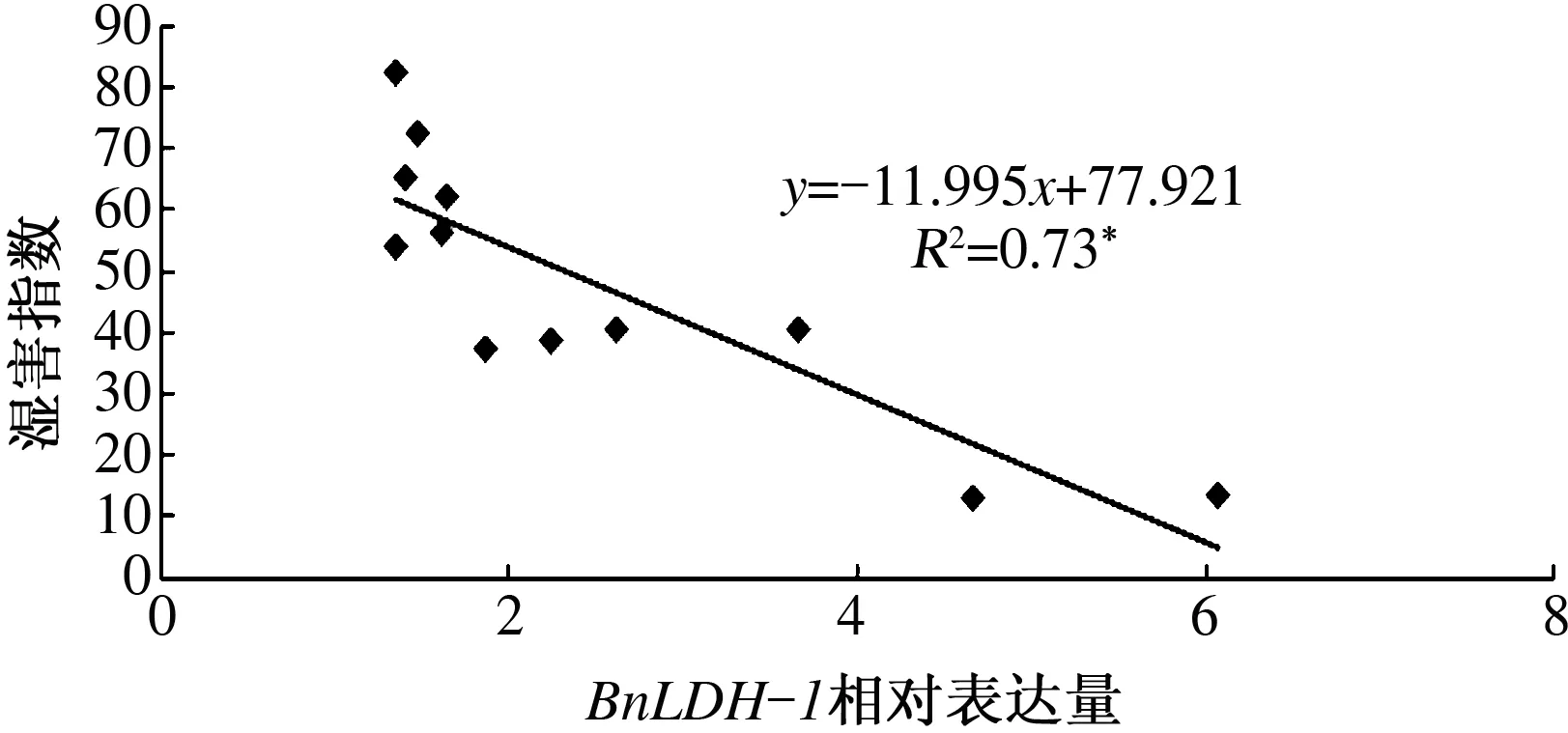
*表示相关性显著(P<0.05)
3 结论与讨论
水对植物生长具有重要作用,但缺水(干旱)或水分过多(湿害)都严重危害植物的生长发育。湿害通常造成氧胁迫,氧胁迫是植物遭受的一种最重要的非生物胁迫[17-18]。目前,已经分离和鉴定了一些植物抗氧胁迫相关基因,并初步阐明了其抗逆机制[19]。在玉米的抗氧胁迫研究中发现,胁迫导致20多种蛋白质的合成[20],这些蛋白质包括蔗糖合成酶、1,6-二磷酸果糖醛缩酶、PDC、LDH和ADH等[21-22]。ADH突变体不能合成ADH或者产生乙醇,但能产生LDH并造成pH值下降,因此该突变体对湿害胁迫非常敏感[3,23-24]。本研究发现,耐湿指数与湿害胁迫48 h时BnLDH-1表达量呈显著负相关。这可能是由于BnLDH-1表达量迅速升高可以降低pH值,从而迅速启动无氧代谢途径,在一定程度上满足植物生长发育的能量需求[12],但过多的乳酸对植物细胞有害,因而造成耐湿性降低。根据相关报道,湿害过程中,通气组织的形成,侧根的发育,对提高植物的耐湿性具有重要作用[25-26],其根本是提高植物的O2吸收和转运能力。虽然不能利用抑制BnLDH-1基因表达提高植物耐湿性,但由于耐湿指数和湿害胁迫48 h时BnLDH-1的表达量呈显著负相关,因此可以利用湿害胁迫48 h时BnLDH-1表达量的高低进行耐湿材料的快速筛选。
[1] Cornelious B,Chen P,Chen Y,etal.Identification of QTLs underlying water-logging tolerance in soybean[J].Molecular Breeding,2005,16(2):103-112.
[2] 程伦国, 刘德福, 郭显平, 等.油菜排渍指标试验研究[J]. 湖北农业科学, 2003,42(1):37-39.
[3] Sairam R K,Kumutha D,Ezhilmathi K,etal.Physiology and biochemistry of waterlogging tolerance in plants[J].Biologia Plantarum,2008,52(3):401-412.
[4] Sachs M M,Freeling M,Okimoto R.The anaerobic proteins of maize[J].Cell,1980,20(3):761-767.
[5] Dennis E S,Dolferus R, Ellis M,etal.Molecular strategies for improving waterlogging tolerance in plants[J].Journal of Experimental Botany,2000,51(342):89-97.
[6] Good A G,Muench D G.Long-term anaerobic metabolism in root-tissue-metabolic products of pyruvate metabolism[J].Plant Physiology,1993,101(4):1163-1168.
[7] Kennedy R A,Rumpho M E,Fox T C.Anaerobic metabolism in plants[J].Plant Physiology,1992,100(1):1-6.
[8] Ricard B,Couee I,Raymond P,etal.Plant-metabolism under hypoxia and anoxia[J].Plant Physiology and Biochemistry,1994,32(1):1-10.
[9] Drew M C.Oxygen deficiency and root metabolism:Injury and acclimation under hypoxia and anoxia[J].Annual Review of Plant Physiology and Plant Molecular Biology,1997,48(1):223-250.
[10] Waters I,Morrell S,Greenway H,etal.Effects of anoxia on wheat seedlings [J].Journal of Experimental Botany,1991,42(244):1437-1447.
[11] Dolferus R,Klok E J,Ismond K,etal.Molecular basis of the anaerobic response in plants[J].Iubmb Life,2001,51(2):79-82.
[12] Agarwal S,Grover A.Molecular biology, biotechnology and genomics of flooding-associated low O2stress response in plants[J].Critical Reviews in Plant Sciences,2006,25(1):1-21.
[13] Ueno K,Takahashi H.Varietal variation and physiological basis for inhibition of wheat seed germination after excessive water treatment[J].Euphytica,1997,94(2):169-173.
[14] Zhang X,Cheng J,Wang H,etal.Genetic difference of waterlogging tolerance in rapeseed (BrassicanapusL.)[J].Chinese Journal of Oil Crop Sciences, 2007, 29(2):204-208.
[15] Saghai-Maroof M A,Soliman K M,Jorgensen R A,etal.Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics[J].Proceedings of the National Academy of Sciences of the United States of America,1984,81(24):8014-8018.
[16] Jaakola L,Pirttila A M,Halonen M,etal.Isolation of high quality RNA from bilberry (VacciniummyrtillusL.) fruit[J].Molecular Biotechnology,2001,19(2):201-203.
[17] Chugh V,Gupta A K,Grewal M S,etal.Response of antioxidative and ethanolic fermentation enzymes in maize seedlings of tolerant and sensitive genotypes under short term waterlogging[J].Indian Journal of Experimental Biology,2012,50(8):577-582.
[18] Araki H,Hossain M A,Takahashi T.Waterlogging and hypoxia have permanent effects on wheat root growth and respiration[J].Journal of Agronomy and Crop Science,2012,198(4):264-275.
[19] Singh A P.A review of microbial decay types found in wooden objects of cultural heritage recovered from buried and waterlogged environments[J].Journal of Cultural Heritage,2012,13(3):S16-S20.
[20] Sachs M M,Freeling M,Okimoto R.The anaerobic proteins of maize[J].Cell,1980,20(3):761-767.
[21] Chung H J,Ferl R J.Arabidopsis alcohol dehydrogenase expression in both shoots and roots is conditioned by root growth environment[J].Plant Physiology,1999,121(2):429-436.
[22] Zeng Y,Wu Y,Avigne W T,etal.Rapid repression of maize invertases by low oxygen.Invertase/sucrose synthase balance,sugar signaling potential, and seedling survival[J].Plant Physiology,1999,121(2):599-608.
[23] Roberts J K M,Callis J,Jardetzky O,etal.Cytoplasmic acidosis as a determinant of flooding intolerance in plants[J].Proceedings of the National Academy of Sciences of the United States of America-Biological Sciences,1984,81(19):6029-6033.
[24] Roberts J K M,Callis J,Wemmer D,etal.Mechanism of cytoplasmic pH regulation in hypoxic maize root-tips and its role in survival under hypoxia[J].Proceedings of the National Academy of Sciences of the United States of America-Biological Sciences,1984,81(11):3379-3383.
[25] Shabala S.Physiological and cellular aspects of phytoto-xicity tolerance in plants:The role of membrane transporters and implications for crop breeding for waterlogging tolerance[J].New Phytologist, 2011, 190(2):289-298.
[26] Colmer T D,Voesenek L A C J.Flooding tolerance:Suites of plant traits in variable environments[J].Functional Plant Biology,2009,36(8):665-681.
Cloning and Expressional Characterization of Wet Damage Related GeneBnLDH-1 fromBrassicanapusL.
WU Jinhai1, ZHOU Yutang2, XIE Lingli1, ZHANG Xuekun3, XU Benbo1*
(1.College of Life Science,Yangtze University,Jingzhou 434025,China; 2.Xiaogan Academy of Agricultural Sciences,Xiaogan 432000,China; 3.Oil Crops Research Institute,Chinese Academy of Agricultural Sciences,Wuhan 432600,China)
TheBnLDH-1 gene cDNA and genomic sequences were cloned by the RACE from Zhongshuang No.9. The genomic sequence ofBnLDH-1 was 1 432 bp and contained one intron. The 1 319 bpBnLDH-1 cDNA had a 1 053 bp ORF which encoded a polypeptide of 350 amino acids. The predicted results in-dicated that the BnLDH-1 protein contained conserved LDH-1 domain. qRT-PCR results indicated thatBnLDH-1 transcription levels were induced by waterlogging, and theBnLDH-1 transcription level had significant difference among theBrassicanapusL. with different waterlogging tolerance after waterlogging treatment. Correlation analysis indicated thatBnLDH-1 transcription levels were significantly negatively correlated with waterlogging tolerance indices of 12BrassicanapusL. at 48 h after waterlogging treatment, and the correlation coefficient was 0.73.
BrassicanapusL.; cloning; expression; lactate dehydrogenase; waterlogging tolerance
2015-10-28
国家高技术研究发展计划(863计划)项目(2011AA10A104)
吴金海(1978-),男,湖北襄阳人,在读硕士研究生,研究方向:植物生物技术。E-mail:1312813987@qq.com
*通讯作者:许本波(1977-),男,湖北安陆人,副教授,博士,主要从事植物生物技术研究。 E-mail:benboxu@yangtzeu.edu.cn
S565.4;Q78
A
1004-3268(2016)03-0053-06

