四硫代钼酸铵作为新型硫化氢供体的鉴定及其对皮肤细胞的保护作用*
孟富慧, 陈 利, 徐 适, 鲜 明, 张 辉, 李建华, 董 颀, 杨春涛△
(1广州医科大学生理教研室,广东 广州 511436; 2华盛顿州立大学化学教研室,美国 华盛顿州 普尔曼市 99164)
四硫代钼酸铵作为新型硫化氢供体的鉴定及其对皮肤细胞的保护作用*
孟富慧1,陈利1,徐适2,鲜明2,张辉1,李建华1,董颀1,杨春涛1△
(1广州医科大学生理教研室,广东 广州 511436;2华盛顿州立大学化学教研室,美国 华盛顿州 普尔曼市 99164)
[摘要]目的: 本研究旨在检测金属络合物四硫代钼酸铵(ATTM)的硫化氢(H2S)释放能力并进一步观察其减轻氧化应激诱导的皮肤细胞损伤的作用。方法:反应瓶法检测ATTM在细胞培养基中释放的H2S,二氯二氢荧光素二乙酸酯或罗丹明123染色结合荧光显微镜照相术分别检测细胞内活性氧簇(ROS)的含量和线粒体膜电位(ΔΨm),用试剂盒检测细胞存活率和乳酸脱氢酶(LDH)的释放。结果:与H2S供体GYY4137类似,ATTM在细胞培养基中可剂量依赖性地释放H2S。在25~400 μmol/L 的浓度范围内,ATTM处理对人皮肤细胞(HaCaT细胞)的存活率无明显影响(P>0.05)。紫外线照射或外源性给予ROS供体(过氧化氢,H2O2)处理均可增加HaCaT细胞内ROS的含量。400 μmol/L H2O2处理可明显降低HaCaT细胞的存活率(P<0.01),而在H2O2处理前给予ATTM预处理,细胞存活率明显提高,其中在100和200 μmol/L浓度时ATTM具有最好的细胞保护作用(P<0.01)。400 μmol/L H2O2处理还可损害细胞的ΔΨm和细胞膜并使LDH释放增加(P<0.01)。而在细胞遭受损伤前给予200 μmol/L ATTM预处理可明显改善ΔΨm的水平(P<0.05)并抑制LDH从细胞内释放(P<0.01)。结论:ATTM具有释放H2S的能力并可保护人皮肤细胞对抗氧化应激诱导的损伤效应。
[关键词]HaCaT细胞; 硫化氢; 四硫代钼酸铵; 氧化应激
硫化氢(hydrogen sulfide, H2S)是继一氧化氮(nitric oxide,NO) 和一氧化碳(carbon monoxide,CO)之后被发现的第3种气体信号分子,在体内起着广泛的生理及病理作用,具有重要的研究价值和临床应用前景。其效应主要涵盖了舒张血管降低血压、抑制氧/硝化应激损伤、调节炎症反应、对抗缺血-再灌注引起的器官损伤、调节胰岛素的分泌和受体敏感性等[1]。亚硝基铁氰化钠,也称硝普钠(sodium nitroprusside,SNP),是NO的重要供体,降压起效快、体内代谢迅速,虽然其还存在很多问题,如靶向性差,毒性较大,释放过快,易耐受,但是其作为一种相对较好的NO供体已被临床用来治疗高血压急症和急性左心衰等[2]。然而,目前为止还没有相对较好的H2S供体可以被临床应用。
目前市面上可以获得的H2S供体存在着种种缺陷限制了其在临床上的应用。因而寻找较为合理可行的H2S供体具有重要的意义[3]。本研究用一种传统的结构简单的金属络合物四硫代钼酸铵(ammonium tetrathiomolybdate,ATTM),检测了其H2S的释放能力并在氧化应激诱导的皮肤细胞损伤模型上观察了其细胞保护作用。
材料和方法
1实验材料
ATTM、H2S供体GYY4137和二氯二氢荧光素二乙酸酯(dichlorodihydrofluorescein diacetate, DCFH-DA)购自Sigma;细胞计数试剂盒(cell counting kit, CCK)-8、罗丹明(rhodamine, Rh)123线粒体染料和乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒购自Dojindo;DMEM 培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco;过氧化氢(hydrogen peroxide, H2O2)及其它化合物购自广州化学试剂厂。
2实验方法
2.1细胞培养HaCaT皮肤细胞来源于自发转化的人腹部表皮,购自中国科学院昆明动物研究所。此细胞培养于含10% FBS 的DMEM培养基并置于5% CO2、37 ℃培养箱中。传代时用0.25%胰蛋白酶消化5 min,每隔2 d传代1次。
2.2硫化氢释放的检测如图1所示,将2 mL无血清培养基配制的不同浓度的ATTM或GYY4137加到反应瓶的周围池(A),并向中央池(B)加入500 μL 4% NaOH溶液以吸收释放的H2S气体,于37 ℃轻摇2 h。反应结束后,从中央池吸取400 μL NaOH溶液,随机加入等物质的量的浓盐酸使之中和,而后迅速依次加入40 μL 20 mmol/L N,N-二甲基-对苯二胺盐酸盐(用7.2 mol/L 的浓盐酸配制)和40 μL 30 mmol/L 三氯化铁(用1.2 mol/L 的浓盐酸配制),室温反应10 min。每个样品取100 μL的反应液加至96孔培养板的孔中,用酶标仪读取670 nm波长处的吸光度。
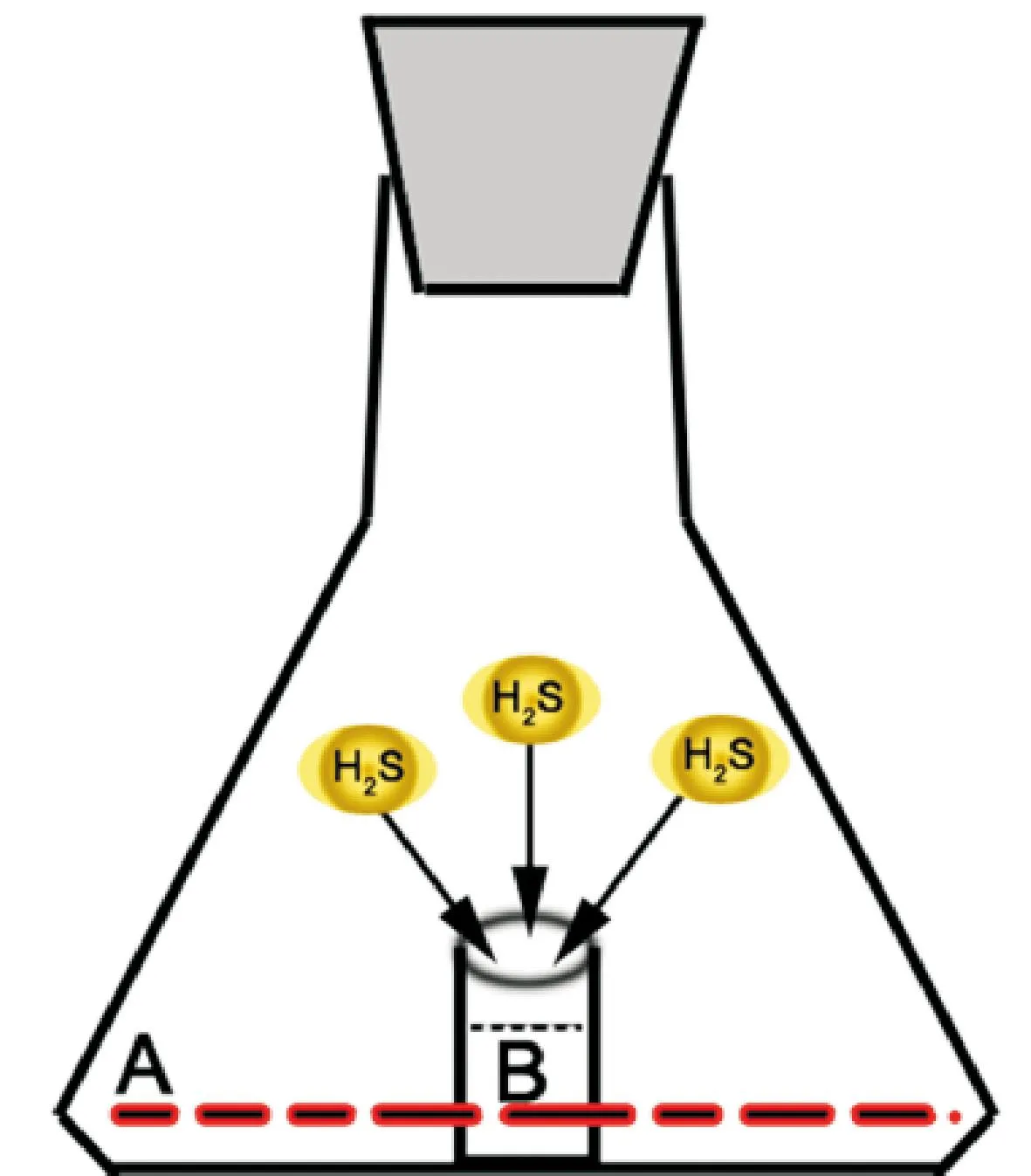
Figure 1.The absorption of released H2S gas in reaction bottles. A: the lateral pool; B: the central pool.
图1在反应瓶中检测释放出的硫化氢气体
2.3细胞活力的检测将HaCaT 皮肤细胞接种于96孔培养板中,每孔约1×105个,每组4个复孔。当细胞生长至80%融合时,给予不同浓度的ATTM或在ATTM预处理1 h后给予400 μmol/L H2O2处理5 h,参考本实验室以前的研究[4]。在处理结束后,弃去培养板内的培养基,用磷酸盐缓冲溶液(phosphate-buffered solution, PBS)洗1次,每孔加入1∶10稀释的CCK-8溶液100 μL,37 ℃ 孵育3 h,用酶标仪读取各孔在450 nm波长处的吸光度,取其平均值,按如下公式计算细胞存活率,细胞存活率(%)=(A处理组-A空白组)/(A对照组-A空白组)×100%,重复6次。
2.4线粒体膜电位和细胞内活性氧簇(reactive oxygen species,ROS)的检测细胞线粒体可依靠其膜的电负性摄取阳离子荧光染料Rh123,摄取量依赖于线粒体膜电位(mitochondria membrane potential,ΔΨm)。细胞ΔΨm受损可致Rh123摄取能力减弱,因而根据Rh123的摄取量可以间接反映线粒体的功能状况。将HaCaT 皮肤细胞接种于24孔培养板内,当细胞生长至80%融合时给予400 μmol/L H2O2处理5 h和/或200 μmol/L ATTM预处理1 h。处理完成后,用PBS漂洗1次,加入无FBS培养基配制的10 mg/L Rh123,在37 ℃避光孵育30 min。用荧光显微镜随机选取6个视野进行摄片,并用ImageJ软件对荧光强度进行半定量分析。细胞内ROS检测方法类似于ΔΨm的检测,ROS可将无荧光的DCFH氧化生成绿色荧光的DCF,通过在显微镜下观察绿色荧光的强度可以间接反映ROS的相对含量。HaCaT皮肤细胞经紫外线照射或H2O2处理1 h后,用PBS漂洗1次,加入无FBS培养基配制的10 μmol/L DCFH-DA,在37 ℃避光孵育20 min,用荧光显微镜进行摄片。
2.5乳酸脱氢酶释放的检测将HaCaT 皮肤细胞接种于96孔培养板中,当细胞生长至80%融合时,给予400 μmol/L H2O2处理5 h和/或200 μmol/L ATTM预处理1 h。在细胞受损时,细胞膜通透性增加可致LDH从细胞内释放至细胞外,因而通过检测LDH的释放率可以反映细胞的受损程度。收集各培养孔内的培养基,并向每孔加入100 μL的细胞裂解液裂解细胞,按照试剂盒说明书分别检测培养基中和细胞内LDH的含量。LDH的释放率可按照如下公式计算,LDH释放率(%)= LDH培养基/(LDH培养基+ LDH细胞内)×100%,重复6次。
3统计学处理
采用SPSS 13.0统计软件进行分析,计量资料以均数±标准误(mean±SEM)表示,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1四硫代钼酸铵的硫化氢释放效应
在500~1 500 μmol/L 浓度范围内,随着ATTM浓度的增加,生成的H2S也呈浓度依赖性地增加。另外,GYY4137是目前常用的H2S供体,用此方法,也观察到其可以浓度依赖性地释放H2S。此结果提示,ATTM具有释放H2S的能力,且效果略微好于GYY4137,见图2。
2四硫代钼酸铵对细胞活力的影响
虽然ATTM具有H2S释放的能力,但是为了明确其能否被用于生物系统前,需先评价其细胞毒性作用。不同浓度的ATTM处理HaCaT皮肤细胞1 h,而后继续培养5 h;或连续处理24 h。用CCK-8实验检测细胞活力显示,在25~400 μmol/L 浓度范围内,ATTM处理对HaCaT细胞活性均无明显影响。
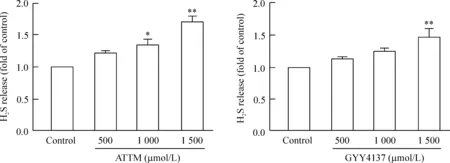
Figure 2.H2S release from the indicated donors in reaction bottles. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol.
图2不同类型硫化氢供体在反应瓶中释放硫化氢
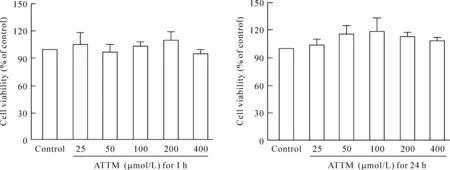
Figure 3.The effects of ATTM on the viability of HaCaT cells. The cells were treated with 25~400 μmol/L ATTM for 1 h followed a 5-h culture or for 24 h. The cell viability was measured by CCK-8 assay. Mean±SEM.n=6.
图3不同浓度的四硫代钼酸铵对HaCaT皮肤细胞活性的影响3紫外线照射和H2O2处理可提高皮肤细胞内活性氧的含量
紫外线照射是引起皮肤细胞受损的重要原因,而氧化应激是其损伤的重要的机制。用DCFH染色结合荧光显微镜照相,检测细胞内ROS显示,HaCaT细胞经紫外线照射1 h,细胞内ROS的水平较正常培养的细胞明显提高。另外,给予ROS的常用供体H2O2(400 μmol/L)处理1 h也可使细胞内的ROS水平提高,见图4。

Figure 4.The effects of the indicated treatments on intercellular ROS levels in the HaCaT cells. DCFH staining followed by photofluorography for the observation of ROS levels in the cells.
图4不同处理因素对HaCaT皮肤细胞内活性氧水平的影响
4四硫代钼酸铵抑制过氧化氢诱导的细胞受损
如图5,在用400 μmol/L H2O2处理HaCaT皮肤细胞5 h前,用50~400 μmol/L ATTM预处理细胞1 h,检测细胞活性显示,在100~200 μmol/L ATTM预处理可明显抑制H2O2诱导的细胞损伤(P<0.01)。

Figure 5.The effects of pretreatment with ATTM on H2O2-induced cell injury. HaCaT cells were exposed to 400 μmol/L H2O2for 5 h in the absence or presence of preconditioning with ATTM at different concentrations for 1 h. The cell viability was measured by CCK-8 assay. Mean±SEM.n=6.**P<0.01vscontrol;##P<0.01vsH2O2alone group.
图5四硫代钼酸铵预处理对过氧化氢诱导的HaCaT皮肤细胞受损的的影响
5四硫代钼酸铵改善过氧化氢引起的线粒体功能障碍
线粒体是对伤害性刺激较为敏感的细胞器之一,通过检测其对荧光染料Rh123的摄取情况可以反映其功能状态。正常HaCaT皮肤细胞具有较强的Rh123摄取能力,而经400 μmol/L H2O2处理5 h后其对Rh123的摄取明显减弱(P<0.01),提示ΔΨm受损。在用H2O2损伤细胞前给予200 μmol/L ATTM预处理1 h,可部分拮抗H2O2引起的ΔΨm减弱,差异有统计学意义(P<0.05),见图6。

Figure 6.The effects of pretreatment with ATTM on H2O2-induced mitochondrial dysfunction. HaCaT cells were exposed to 400 μmol/L H2O2for 5 h in the absence or presence of preconditioning with 200 μmol/L ATTM for 1 h. Rh123 staining followed by photofluorography was conducted for the observation of MMP levels in the cells. Mean±SEM.n=6.**P<0.01vscontrol;#P<0.05vsH2O2.
图6四硫代钼酸铵预处理对过氧化氢诱导的HaCaT皮肤细胞线粒体功能障碍的影响
6四硫代钼酸铵抑制过氧化氢诱导的乳酸脱氢酶过度释放
在正常情况下LDH主要分布在细胞内,当细胞受损细胞膜通透性增加时,LDH可被释放到细胞外,因而通过检测LDH的释放情况可以反映细胞膜的受损程度。图7显示,HaCaT皮肤细胞经400 μmol/L H2O2处理5 h,可使LDH的释放明显增加(P<0.01);而在H2O2处理前给予200 μmol/L ATTM预处理1 h,LDH的释放被显著减少,提示细胞膜受损得到改善(P<0.01)。

Figure 7.The effects of pretreatment with ATTM on H2O2-induced LDH release. HaCaT cells were exposed to 400 μmol/L H2O2for 5 h in the absence or presence of preconditioning with 200 μmol/L ATTM for 1 h. LDH release was measured by a commercial kit. Mean±SEM.n=6.**P<0.01vscontrol;##P<0.01vsH2O2.
图7四硫代钼酸铵预处理对过氧化氢诱导的乳酸脱氢酶释放的影响
讨论
本研究首次发现,在细胞培养基中ATTM具有释放H2S的能力。更重要的是,在氧化应激引起的皮肤细胞损伤中,其不仅能改善细胞活力,还能提高线粒体功能并维持细胞膜的通透性。本文的发现可为ATTM的未来临床应用和基础研究提供有价值的依据。
氧化应激介导的皮肤细胞损伤是常见的皮肤受损机制,如在紫外线照射、缺氧以及糖尿病皮肤溃疡等病理生理过程中均存在皮肤细胞的氧化应激损伤[5-6]。本研究发现,在人皮肤HaCaT细胞受到紫外线照射时,细胞内的ROS水平明显升高。用活性氧的常用供体H2O2处理HaCaT细胞也可使细胞内的ROS水平升高。因而,用H2O2处理HaCaT细胞模拟其它各种类型的皮肤细胞受损,结果发现H2O2处理可使细胞的存活率明显降低,这与以前在其它类型的细胞报道相一致[7]。线粒体是细胞的能量工厂,也是细胞内对伤害性刺激最为敏感的细胞器之一,本研究证实HaCaT细胞经H2O2处理后,线粒体的功能明显减低,表现为其对嗜线粒体染料的摄取明显减少,Adlam等[8]的报道支持本文的研究。细胞受损还表现为细胞膜的损害,通透性的增加,细胞内成分的外漏[7],本研究的另一个发现是,H2O2处理可促进LDH从细胞内释放至细胞外的培养基中,提示细胞膜明显受损。总之,H2O2处理可导致HaCaT细胞的存活率降低、线粒体功能障碍以及细胞膜的通透性增高,因而,H2O2处理的人皮肤HaCaT细胞或许可以成为氧化应激诱导皮肤损害的简易模型。
众所周知,SNP作为NO的供体,在高血压急症以及急性左心衰中已被广泛应用。H2S作为继NO和CO之后的又一重要信号分子也逐渐被重视,其供体有早期的S2-及其酸式盐(Na2S和NaHS)、化学合成自发水解的供体(GYY4137)和巯基激活的可控性供体(8A和8L),然而,这些供体始终无法让人满意。如S2-类供体,在空气中极易被氧化,其释放H2S基本上是在瞬间完成的;GYY4137是第一个合成的H2S供体,然而其释放H2S的速度和效率也不高,释放靠自发水解实现[9],无法人为干预并且其分解产物是除草剂的重要成分,可能会影响其广泛应用;8A和8L的合成已经部分克服了上述供体的缺点,如此类化合物在空气中较为稳定,释放效率较高。另外,可以根据加入巯基化合物的量控制其释放H2S的速度。然而,由于其释放需要额外加入L-半胱氨酸或还原型谷胱甘肽(reduced glutathione, GSH)[10],这在某些病理情况下(如缺氧、糖尿病时GSH本来就被严重消耗)可能是不利的。ATTM在化学结构特点上与SNP有极大的相似性(图8),如两者都是过渡金属形成的络合物,而且此二种过度金属都为人体的必须元素并具有重要的生理功能。
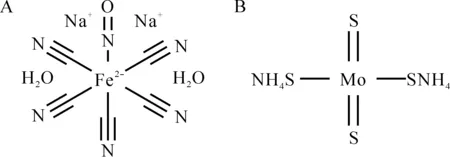
Figure 8.Structure of SNP (A) and ATTM (B).
图8硝普钠和四硫代钼酸铵的结构
本研究接着在上述皮肤氧化应激损伤模型,观察ATTM的细胞保护作用。为此,首先检测ATTM可否产生H2S。与理论预测相符,ATTM在细胞培养基中可以释放出H2S,而且其释放效率略强于GYY4137。若在皮肤细胞遭受氧化应激前给予ATTM预处理,可以明显减轻细胞的损伤效应,这和本小组以前在其它类型H2S供体诱导的皮肤细胞损伤的报道类似[11]。另外,周萍萍等[12]在糖尿病大鼠伤口愈合障碍模型的研究也支持本文的发现。本文推测,这种效应在日常生活中也许具有重要意义,如将此类化合物加入防晒霜中将可以减轻紫外线等诱导的皮肤细胞氧化损伤。另外,通过观察细胞的线粒体功能,还发现ATTM和其它类型的H2S供体一样,具有改善线粒体功能的作用[13]。在细胞受到ROS攻击时,细胞膜可作为第一道屏障系统发挥防御功能,但是过多的ROS常对细胞膜造成脂质过氧化损伤,引起通透性增加,细胞内成分外漏。本研究通过检测LDH的释放也发现,H2O2处理引起的LDH过度释放可被ATTM预处理明显减轻。这至少说明ATTM可以保护细胞对抗氧化应激诱导的细胞膜损害[14]。据文献报道[15-16],钼(Mo)本身也具有调节体内氧化-还原状态以及提高胰岛素敏感性的作用,当然,它的这些作用是否也参与了本研究中的抗皮肤氧化应激损伤效应,以及ATTM长期应用是否会对组织细胞造成损害,尚需要进一步的实验支持。
总之,本研究率先报道了一传统化合物ATTM具有释放H2S的作用,这种化合物可以明显减轻氧化应激诱导的皮肤受损。作为未来H2S的另一个供体,从化学结构分析其稳定性要优于S2-,且其释放H2S的效率也不逊于GYY4137。当然,关于此化合物是如何释放H2S的,以及其是否还具有其它的细胞保护效应和保护机制尚有待今后继续研究。
[参考文献]
[1]Wang R. Physiological implications of hydrogen sulfide: a whiff exploration that blossomed[J]. Physiol Rev, 2012, 92(2):791-896.
[2]Katsumi H, Nishikawa M, Hashida M. Development of nitric oxide donors for the treatment of cardiovascular diseases[J]. Cardiovasc Hematol Agents Med Chem, 2007, 5(3):204-208.
[3]Wallace JL, Wang R. Hydrogen sulfide-based therapeutics: exploiting a unique but ubiquitous gasotransmitter[J]. Nat Rev Drug Discov, 2015, 14(5):329-345.
[4]张鹏, 张辉, 杨春涛, 等. 新型硫化氢供体8L通过上调NF-E2 相关因子2 的表达拮抗H2O2损伤H9c2 心肌细胞[J]. 中国动脉硬化杂志, 2015, 23(6):561-566.
[5]Mamalis A, Fiadorchanka N, Adams L, et al. An immunohistochemical panel to assess ultraviolet radiation-associated oxidative skin injury[J]. J Drugs Dermatol, 2014, 13(5):574-578.
[6]岳晓莉, 李萍, 刘欣, 等. 黄芪多糖对过氧化氢刺激皮肤成纤维细胞中线粒体和溶酶体的保护作用[J]. 中国病理生理杂志, 2008, 24(4):777-782.
[7]Szabo G, Veres G, Radovits T, et al. Cardioprotective effects of hydrogen sulfide[J]. Nitric Oxide, 2011, 25(2):201-210.
[8]Adlam VJ, Harrison JC, Porteous CM, et al. Targeting an antioxidant to mitochondria decreases cardiac ischemia-reperfusion injury[J]. FASEB J, 2005, 19(9):1088-1095.
[9]Li L, Whiteman M, Guan YY, et al. Characterization of a novel, water-soluble hydrogen sulfide-releasing molecule (GYY4137): new insights into the biology of hydrogen sulfide[J]. Circulation, 2008, 117(18):2351-2360.
[10]Zhao Y, Bhushan S, Yang C, et al. Controllable hydrogen sulfide donors and the activity against myocardial ischemia-reperfusion injury[J]. ACS Chem Biol, 2013, 8(6):1283-1290.
[11]Yang CT, Zhao Y, Xian M, et al. A novel controllable hydrogen sulfide-releasing molecule protects human skin keratinocytes against methylglyoxal-induced injury and dysfunction[J]. Cell Physiol Biochem, 2014, 34(4):1304-1317.
[12]周萍萍, 李伟, 陆晓华, 等. 硫化氢对糖尿病大鼠皮肤溃疡创面愈合的影响[J]. 中国病理生理杂志, 2015, 31(9):1657-1661.
[13]Wang Y, Shi S, Dong S, et al. Sodium hydrosulfide atte-nuates hyperhomocysteinemia rat myocardial injury through cardiac mitochondrial protection[J]. Mol Cell Biochem, 2015, 399(1-2):189-200.
[14]Zhou Y, Wang D, Gao X, et al. mTORC2 phosphorylation of Akt1: a possible mechanism for hydrogen sulfide-induced cardioprotection[J]. PLoS One, 2014, 9(6):e99665.
[15]Akhtar MJ, Ahamed M, Alhadlaq HA, et al. Antioxidative and cytoprotective response elicited by molybdenum nanoparticles in human cells[J]. J Colloid Interface Sci, 2015, 457: 370-377.
[16]Rovenko BM, Perkhulyn NV, Lushchak OV, et al. Molybdate partly mimics insulin-promoted metabolic effects inDrosophilamelanogaster[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2014, 165: 76-82.
(责任编辑: 卢萍, 罗森)

*[基金项目]山西省优势学科心血管生理和药理学资助项目;山西医科大学博士启动基金资助项目(No. 03201310)
Identification of ATTM as a novel H2S donor and investigation of its protective effect on HaCaT skin cellsMENG Fu-hui1, CHEN Li1, XU Shi2, XIAN Ming2, ZHANG Hui1, LI Jian-hua1, DONG Qi1, YANG Chun-tao1
(1DepartmentofPhysiology,GuangzhouMedicalUniversity,Guangzhou511436,China;2DepartmentofChemistry,Wa-shingtonStateUniversity,WAPullman99164,USA.E-mail:yang-chuntao@163.com)
[ABSTRACT]AIM: To investigate the ability of a metal complex ammonium tetrathiomolybdate (ATTM) to release H2S and its cytoprotective effect on an oxidative injury model. METHODS: Released H2S was absorbed in a reaction flask from ATTM dissolved in the cell medium. Staining with dichlorodihydrofluorescein diacetate or rhodamine 123 followed by photofluorography was conducted for the observation of reactive oxygen species (ROS) and mitochondrial membrane potential (ΔΨm) levels, respectively. Cell viability and release of lactate dehydrogenase (LDH) from the cells were measured with commercial kits. RESULTS: Similar to another H2S donor GYY4137, ATTM had an ability to release H2S in the cell medium in a dose-dependent manner. Treatment of human skin HaCaT cells with ATTM at concentrations of 25~400 μmol/L didn’t significantly alter cell viability. Exposure of the cells to ultraviolet rays or a ROS donor H2O2increased the intracellular ROS levels. Treatment with 400 μmol/L H2O2significantly reduced the viability of HaCaT cells (P<0.01). However, before the treatment with H2O2, pretreatment with ATTM at 100 and 200 μmol/L markedly prevented the H2O2-induced cell injury (P<0.01). In addition, the treatment with H2O2triggered ΔΨmloss (P<0.01) and LDH release from the cells (P<0.01). Prior to suffering from H2O2injury, the preconditioning with 200 μmol/L ATTM significantly improved ΔΨmlevels (P<0.05) and attenuated LDH release from the cells (P<0.01).CONCLUSION: ATTM is capable of releasing H2S and protecting human skin cells against oxidative injury.
[KEY WORDS]HaCaT cells; Hydrogen sulfide; Ammonium tetrathiomolybdate; Oxidative stress
通讯作者△Tel: 0351-4135172; E-mail: 4156589@sina.com
[收稿日期]2015- 06- 16[修回日期] 2015- 09- 06
[文章编号]1000- 4718(2015)12- 2277- 05
doi:10.3969/j.issn.1000- 4718.2015.12.027
[中图分类号]R962; R75; R363
[文献标志码]A

