当归多糖对结肠炎小鼠peyer's patches结T淋巴细胞亚群水平的调控作用*
★ 潘琦虹 李燕珍 刘端勇 赵海梅 (.江西中医药大学科技学院 南昌 33005;.江西中医药大学基础医学院 南昌 330004)
*基金项目:江西省卫生厅中医科研计划项目(2008A068)。
当归多糖对结肠炎小鼠peyer's patches结T淋巴细胞亚群水平的调控作用*
★潘琦虹1李燕珍1刘端勇1赵海梅2**(1.江西中医药大学科技学院南昌 330025;2.江西中医药大学基础医学院南昌 330004)
*基金项目:江西省卫生厅中医科研计划项目(2008A068)。
摘要:目的:探讨当归多糖对溃疡性结肠炎小鼠小肠peyer's patches结(PP结)T淋巴细胞亚群水平的调控作用。方法:50只雄性小鼠分成5组,正常对照组(normal)、模型对照组(model)、当归多糖低剂量观察组(low)、当归多糖高剂量观察组(high)、柳氮磺吡啶阳性对照组(SASP),采用传统的TNBS乙醇复合法建立小鼠溃疡性结肠炎模型,给药7d后,观察小鼠病理组织学变化,并分离其小肠上皮淋巴细胞,检测各种淋巴细胞亚群水平。结果:各观察组结肠指数、结肠损伤评分、病理组织学评分较模型组明显下降(P<0.01或P<0.05)。同时当归多糖在一定的剂量下,可明显下调PP结中CD4+、CD8+T细胞水平(P<0.01或P<0.05),且高剂量组可降低CD4/CD8水平(P<0.05)。结论:当归多糖可缓解溃疡性结肠炎结肠粘膜损伤,且缓解作用可能与调节结肠炎小鼠小肠PP结淋巴细胞亚群平衡、纠正肠粘膜免疫状态的紊乱有关。
关键词:当归多糖;溃疡性结肠炎;淋巴细胞亚群;粘膜免疫
溃疡性结肠炎是一种以结肠(直肠)粘膜慢性炎症和溃疡形成为特点的疾病,其发病与粘膜免疫状态密切相关。据报道,当归多糖可调节免疫及治疗实验性溃疡性结炎,但其能否调节粘膜免疫治疗溃疡性结肠炎的作用并没有实验证实。
1实验材料
1.1动物昆明小鼠50只,清洁级,18~22g,雄性,购于湖南景达斯莱克实验动物公司(SCXK 2009-0004)。
1.2药物当归多糖购于江西中医学院附属医院中药房,经中药鉴定室鉴定,由教育部重点实验室提取分离,纯度为95%,干燥粉末,-4℃下保存备用。柳氮磺吡啶(SASP)(沪卫药准字(1995)第002083号)由上海三维制药有限公司生产。
1.3主要试剂及仪器2,4,6-trinitrobenzene sulfonic acid(TNBS)购于sigma公司(2508-19-2),单克隆荧光标记抗体CD3-PE、CD4-APC、CD8-FITC均购于eBioscience公司。光学显微镜(OLYMPUS公司)、Leica图像分析仪(LEICA DC100,德国LEICA公司)、流式细胞仪(FACSCalibur型,美国BD公司)
2实验方法
2.1造模方法[1]模型对照组、当归多糖观察组、柳氮磺吡啶阳性对照组动物,复合麻醉剂麻醉后,用塑料软管(直径1mm)插入肛门4cm,按体重注入100mg/kg含30%乙醇的TNBS药液,小鼠倒立1min使药液达全结肠,然后动物放回原笼中自然苏醒;正常对照组小鼠注入等量的生理盐水。
2.2分组与给药昆明小鼠50只,经适应性饲养3d后,按体重随机分为5组,即正常对照组、模型对照组、当归多糖高剂量观察组、当归多糖低剂量观察组、柳氮磺吡啶阳性对照组,每组10只。造模成功后第1d,按体表面积换算,当归多糖低、高剂量观察组分别给予0.5g/kg、1g/kg灌胃给药;而柳氮磺吡啶对照组给予60mg/kg;正常组和模型组均给予等容积的蒸馏水同等方法灌胃,连续给药7d,每天一次。第8d脱椎处死动物,分离小肠、结肠等,待用。
2.3取材各组动物在末次给药后禁食12 h,脱椎处死动物,迅速自肛门上2cm处向上分离结肠6~8cm,称重,计算结肠重量指数(结肠指数=结肠重(g)/体重(kg)×100%)。剪取部分结肠组织,10%福尔马林溶液固定,病理切片,HE染色,光镜下观察溃疡生成情况,部分结肠组织迅速于液氮中保存待用。分离小肠,收集小肠PP结。
2.4结肠组织损伤评分及评分标准动物处死后,迅速分离结肠,沿肠系膜纵轴剪开,用生理盐水冲洗干净,并将肠粘膜向上平铺于蜡板上固定,观察炎症及溃疡发生情况,根据炎症损伤程度进行结肠组织损伤评分,其评分标准[2]为:0分:无损伤;1分:粘膜充血、水肿、未出现溃疡;2分:粘膜充血、水肿、轻度糜烂,无溃疡;3分:粘膜充血、水肿、中度糜烂,有单个溃疡;4分:粘膜充血、水肿、高度糜烂,有多处溃疡;5分:粘膜充血、水肿、重度糜烂,有>1cm溃疡。镜下病理损伤评分参考Dielman等[3]提出的评分标准,评分指标包括溃疡、炎症、肉芽肿、及病变深度,按有无及轻重分别记0、1、2分,病变深度达黏膜下层、肌层、浆膜层分别计1、2、3分。各项相加得总分。
2.5机械分离法分离小肠PP结淋巴细胞禁食12h后,脱椎处死动物,取出全部小肠,置于冰生理盐水中,剥离肠系膜和脂肪组织,用生理盐水冲洗肠腔5~7遍,洗去小肠内容物,从小肠肠壁上剪下的PP结,置冰生理盐水中反复清洗3~5遍,将PP结置于300目细胞筛中,加适量1640培养液研碎,制成PP结组织匀浆,滤液1500rpm,离心5min,去上清,两次,加入1mL的1640培养液摇匀,即得。
2.6流式细胞术检测PP结淋巴细胞亚群检测分别取细胞悬液100μL与CD3(0.5μg)/CD4单克隆抗体(0.25μg)和CD3(0.5μg)/CD8单克隆抗体(0.125μg)的离心管中震匀,4℃下孵育30min;加入适量生理盐水,以1500 r/min离心1.5min,反复几次,弃其上清,加生理盐水恢复体积至500μL,过滤后上流式细胞仪检测。
3实验结果
3.1结肠损伤评分见表1。肉眼下可见模型组结肠粘膜明显充血、水肿,中到重度糜烂和多个溃疡,溃疡呈圆形或椭圆形,底部干净,或可见少量淡黄色覆盖物,边缘充血水肿;镜下可见粘膜糜烂脱落、充血水肿,炎症细胞浸润,形成多个溃疡缺损,结肠指数、结肠损伤评分及病理组织学评分明显高于正常组(P<0.01);各观察组亦可见少量充血水肿和部分结肠可见轻度糜烂和溃疡,镜下可见溃疡数目明显减少,底部可见纤维结缔组织增生,充血水肿明显减轻,伴少量炎症细胞浸润,与模型组比较结肠指数、结肠损伤评分及病理组织学评分明显下降并具有统计学意义(P<0.01或P<0.05)。提示当归多糖各剂量组可明显缓解结肠损伤局部充血水肿,减轻炎症细胞浸润程度,减少溃疡数目,促进结肠上皮损伤修复、溃疡愈合。
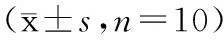
表1 结肠粘膜损伤修复情况
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01,#P<0.05。
3.2小肠粘膜PP结淋巴细胞亚群表达水平见表2。与正常组比较,模型组小鼠肠道PP结淋巴细胞中CD3+T淋巴细胞数量明显下降,并具有统计学意义(P<0.05),而CD4+T细胞有上升趋势,CD8+T细胞有下降趋势,不过其二者比值(CD4/CD8)显著下降(P<0.01)。与模型组比较,各观察组对CD3+T淋巴细胞作用不明显,均可明显下调CD4+、CD8+T细胞水平,高剂量组及柳氮磺吡啶对照组可使CD4/CD8升高,并具有显著性统计学意义(P<0.05或P<0.01)。

表2 小肠PP结淋巴细胞亚群水平
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。
4讨论
性肠病(inflammatory bowel disease,IBD)是一组病因不明的慢性肠道炎症性疾病,主要包括溃疡性结肠炎和克隆病,目前普遍认为IBD的产生主要来自于黏膜免疫、相关基因和环境因素,效应T细胞的活化是肠黏膜免疫及其后续炎症的起点,外周T细胞亚群中,已明确CD4+T细胞是导致肠黏膜炎症的主要效应细胞。肠道共生的微生物抗原刺激肠黏膜T细胞,CD4+T细胞或非典型NKT细胞活化后,分泌IL-13,IL-4,IL-5等。肠黏膜免疫调节紊乱导致炎症性肠病的发生,表现与溃疡性结肠炎相似[5-6]。在本实验中模型组大鼠外周血CD4+T细胞水平显著升高正好印证了这一点。当归多糖是当归中的主要成分之一。现代药理学表明,当归多糖具有调节免疫系统、对血液循环系统、抗肿瘤、抗放射损伤等其他方面的作用[6]。当归多糖作为免疫调节剂和抗放射损伤剂已应用于临床,但治疗溃疡性结肠炎的临床应用鲜见报道。实验表明,当归多糖可以通过降低大鼠溃疡性结肠炎结肠损伤分数,显著降低MDA、NO含量,MPO活性及IL-2、TNF-α水平SOD活性,升高TGF-β、IL-10水平,表明当归多糖可通过拮抗氧化、免疫调节、损伤修复作用,缓解免疫性结肠炎大鼠炎症反应,减轻结肠损伤[7]。正如本实验的研究结果表明,当归多糖给药后小鼠结肠少量充血水肿和部分结肠可见轻度糜烂和溃疡,镜下可见溃疡数目明显减少,底部可见纤维结缔组织增生,充血水肿明显减轻,伴少量炎症细胞浸润,病理损伤评分明显下降,提示当归多糖可有效治疗小鼠溃疡性结肠炎,同时当归多糖在一定的剂量下,可明显下调PP结中CD4+、CD8+T细胞水平,下调CD4/CD8水平,表明当归多糖可能是通过明显调节肠道粘膜免疫系统T淋巴细胞亚群平衡,恢复免疫耐受状态,进而防止或降低致炎因子的分泌或高表达,减轻炎性损伤,从而治疗溃疡性结肠炎。当然,当归多糖调节肠道粘膜免疫细胞平衡的分子基础未得到很好的诠释,是否和T淋巴细胞的活化,活化的途径,与抗原递呈细胞活化相关性等等并不清楚,还有待于进一步的深入研究。
参考文献
[1]石忠峰,陈蔚文,李茹柳,等.白术黄芪汤及其有效部位组方对小鼠溃疡性结肠炎的疗效观察[J].中药新药与临床药理,2007,18(2):87-90.
[2]朱峰,钱家鸣,潘国宗.细胞免疫反应性炎症性肠病动物模型的建立[J].中国医学科学院学报,1998,20(4):271-277.
[3]Dielman LA, Palmen AJ, Akol H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol,1998,114(3):385-391.
[4]范骏.肠道黏膜免疫[J].国隧鱼疫学杂志,2006,29(2):111-115.
[5]王旭丹,袁学勤.肠黏膜免疫调节紊乱介导炎症性肠病的发生[J].世界华人消化杂志,2005,13(18):2 257-2 262.
[6]Heller F, Fuss IJ, Nieuwenhuis E, et al. Oxazolone colitis, a Th2 colitis model resembling ulcerative colitis, is mediated by IL-13 producing NK-T cells[J].Immunity,2002,17:629-638.
[7]胡小平,李玉云,李先何,等.当归多糖的成分及药理学研究新进[J].中药材,2004,27(1):70-72.
[8]刘少平,董卫国,吴东方,等.当归多糖对免疫性结肠炎大鼠结肠损伤的保护作用研究[J].中国药理学通报,2003,19(6):693-696.
收稿日期:(2015-06-22)编辑:翟兴英
中图分类号:R285.5
文献标识码:B
通信作者:**赵海梅(1979—),女,博士,副教授。研究方向:中医临床基础。Tel:0791-86588407,E-mail:haimei79@163.com。

