多花勾儿茶中儿茶素的提取分离与HPLC测定
姚姝凤,唐克华,刘小攀,成 江,董爱文
(吉首大学林产化工工程湖南省重点实验室,湖南 张家界 427000)
多花勾儿茶中儿茶素的提取分离与HPLC测定

姚姝凤,唐克华,刘小攀,成江,董爱文
(吉首大学林产化工工程湖南省重点实验室,湖南 张家界 427000)
摘要:以多花勾儿茶果实、叶及自制绿茶为原料,采用水浴法提取儿茶素,研究其最佳提取工艺.提取液经石油醚脱脂溶性色素后,采用大孔吸附树脂D941进行吸附分离,静态吸附和解析条件研究得出纯净水洗脱效果较好.多花勾儿茶果实、叶及自制绿茶吸附分离的纯化液,用色谱柱:Boston Green ODS PC18(4.6×250 mm,5 μm),检测波长279 nm,流动相乙腈-0.4%磷酸(w(乙腈)∶w(0.4%磷酸)=13∶87),柱温35 ℃,流速1 mL/min,一次进样10 μL来进行高效液相色谱(HPLC)检测,其结果显示,多花勾儿茶果实中儿茶素含量最低,自制绿茶中的儿茶素含量最高.
关键词:多花勾儿茶;儿茶素;大孔吸附树脂;高效液相色谱法
多花勾儿茶(BerchemiafloribundaBrongn)为鼠李科勾儿茶属植物,本属一些种类的根茎叶可供药用.迄今为止,从该属植物中获得的天然活性成分有黄酮类、苷类、木脂素类、醌类、萜类等[1].在武陵山区民间用其叶及果实制茶,是良好的保健品,有“观音茶”的美誉.茶多酚(Tea ̄Polyphenols,TP)是茶叶中3大功效成分之一[2],主要由儿茶素类、黄酮醇及黄酮类等组成[3],具有抗癌、抗衰老、抗辐射、清除人体自由基,降低血糖、血脂、血压,以及抑制突变等药理功能[4],儿茶素是其特征性成分[5],具有清除人体自由基,抗辐射[6]、预防癌症等多种功能[7],其提取及分离纯化参考文献[9-14].多花勾儿茶作为武陵山区民间保健茶,未见儿茶素等功效成分的报道,因此本文以儿茶素这一茶叶功效成分为目标,探究多花勾儿茶果实、叶中儿茶素提取分离纯化工艺,用高效液相色谱法检测其儿茶素的含量与自制绿茶的相比较,为多花勾儿茶合理开发提供科学依据.
1实验材料与方法
1.1 材料、试剂及仪器
1.1.1 实验材料多花勾儿茶材料采自张家界市永定区崇山,50 ℃烘干,粉碎过30目筛,密封备用.
1.1.2 试剂与药品(1)标准品.儿茶素(质量分数97.2%)中国食品药品鉴定研究院(ID:7AMA-RUQS).(2)试剂.纤维素果胶复合酶、浓盐酸、甲醇、无水乙醇、氢氧化钠、磷酸(以上试剂为国产分析纯);甲醇、乙腈(为色谱纯).(3)大孔树脂.D941,LX-28,LSA-7,LX-17,XDA-8(西安蓝晓树脂科技有限公司);D101,AB-8(安徽三星树脂科技有限公司)
1.1.3 仪器AEG-220电子分析天平SHIMADZU(日本),KQ-250E超声波清洗器(超声仪器有限公司),PE-52AA旋转蒸发器(上海亚荣生化仪器厂),U-3900紫外分光光度计(日本日立),DF42恒温干燥箱(日本雅马拓),LC-20A高效液相色谱仪(日本岛津公司).
1.2 标准溶液与标准曲线
1.2.1 儿茶素标准溶液配制精密称取儿茶素标准品2.00 mg,用乙醇-水(v(乙醇)∶v(水)=1∶1,下同)溶解定容于100 mL容量瓶中,制成质量浓度为20 mg/L标准溶液.
1.2.2 儿茶素紫外吸收波长测定取儿茶素标准溶液5 mL,在800~200 nm范围内扫描,得儿茶素的吸收图谱,由于儿茶素在279 nm处有最大紫外吸收,因此确定儿茶素的紫外检测波长为279 nm.
1.2.3 儿茶素紫外检测标准曲线的绘制取2,4,6,8,10 mL质量浓度为20 mg/L的儿茶素标准溶液加乙醇-水(1∶1)定容至20 mL,测定279 nm的下吸光值.以紫外吸光值为纵坐标,溶液质量分数为横坐标,绘制回归曲线.
1.2.4 儿茶素HPLC标准曲线及检测图谱色谱柱:Boston Green ODS PC18(4.6×250 mm,5 μm),检测波长279 nm,流动相乙腈-0.4%磷酸(w(乙腈)∶w(0.4%磷酸)=13∶87),柱温35 ℃,流速1 mL/min,一次进样10 μL.按1.2.3节方法梯度稀释标准品液,依次进样,每个样测定3次,取峰面积的平均值,以质量分数为横坐标,峰面积为纵坐标绘制标准曲线.
1.3 提取条件优化
1.3.1 儿茶素提取溶剂体积分数的选择绿茶中儿茶素用一定体积分数的乙醇水浴加热提取.称取多花勾儿茶果实、叶0.500 g(各6份)于三角瓶中,分别加入体育分数30%,40%,50%,60%,70%,80%,95%的乙醇-水溶液,液料比20∶1(mL/g,下同),于40 ℃下恒温水浴提取60 min,抽滤,得果实和叶子儿茶素提取液.
1.3.2 单因素试验准确称取多花勾儿茶果实与叶1.00 g,置50 mL锥形瓶中(平行3份),以乙醇体积分数、温度、液料比和水浴时间作为考察因素.乙醇体积分数30%,40%,50%,60%,70%,80%,95%,温度30,40,50,60,70,80,90 ℃,液料比10∶1,15∶1,20∶1,25∶1,30∶1,35∶1,水浴提取时间20,40,60,80,100,120 min.
1.3.3 正交试验结合单因素试验,以溶剂体积分数、温度、料液比、提取时间为影响因素,以儿茶素紫外吸光值为指标,采用 L16(44)正交试验确定各因素对儿茶素提取率的影响,优化提取工艺条件.
1.3.4 供试液制备称取多花勾儿茶果实、叶及自制绿茶各15.00 g,置250 mL具塞锥形瓶中,用正交优化的条件(绿茶按叶优化条件提取)制备,过滤,减压浓缩,乙醇定容至500 mL,制成儿茶素供试液,避光、冷藏.
1.4 儿茶素的大孔吸附树脂分离纯化
1.4.1 大孔吸附树脂预处理使用前将7种大孔吸附树脂以体积分数95%乙醇浸泡24 h,充分溶胀后再用蒸馏水洗涤至无白色浑浊现象,再用蒸馏水洗至无醇.然后依次用质量分数4%NaOH,4%HCl 浸泡4 h,用蒸馏水洗至中性备用.
1.4.2 静态吸附及解吸称取预处理的7种大孔树脂各0.500 g(湿树脂)于三角瓶中,加入儿茶素标液40 mL(儿茶素含量对树脂过量),密封并置空气浴摇床上振荡,温度30 ℃,转速100 r/min,振荡24 h充分吸附后过滤,取5 mL滤液测其紫外吸光值,按下式计算各树脂的吸附量及吸附率.饱和吸附的树脂滤干吸附液后,加体积分数70%乙醇50 mL洗脱,选出最优吸附树脂,解吸率计算方法如下:

在充分吸附儿茶素标准溶液的D941等大孔树脂,分别加入50mL纯净水,体积分数10%,20%,30%,40%,50%,60%,70%,80%,95% 的乙醇溶液,在30 ℃的振荡水浴锅中振荡24h,过滤,各取5mL滤液测儿茶素的紫外吸光值,计算各树脂的解吸率.
1.4.3 儿茶素的大孔吸附树脂分离与纯化用1.3.4节制备的供试液,以1BV/h的流速过D941大孔吸附树脂柱,吸附床体积为50mL.相同的1BV/h流速解吸,收集洗脱液用于HPLC检测.
2结果与讨论
2.1 紫外可见光吸收波长的确定及标准曲线绘制
儿茶素紫外可见光吸收光谱如图1所示.由图1可知,儿茶素在279nm处具有最大紫外吸收峰,故选择279nm作为儿茶素提取液的紫外检测波长.计算得到回归方程y = 97.009x+0.005 8,该方程线性良好(r=0.999 9),表明儿茶素在2~20mg/L范围内呈良好线性关系.
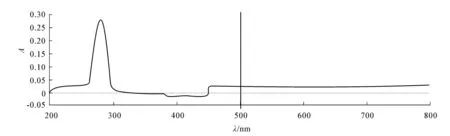
图1 儿茶素紫外吸收光谱
2.2 单因素试验结果
将不同体积分数提取的果实液稀释10倍,叶子提取液稀释50倍,取5 mL溶液测定其提取液中儿茶素的吸光值,测定结果如图2,3所示.

图2 乙醇体积分数对果实中儿茶素提取率的影响
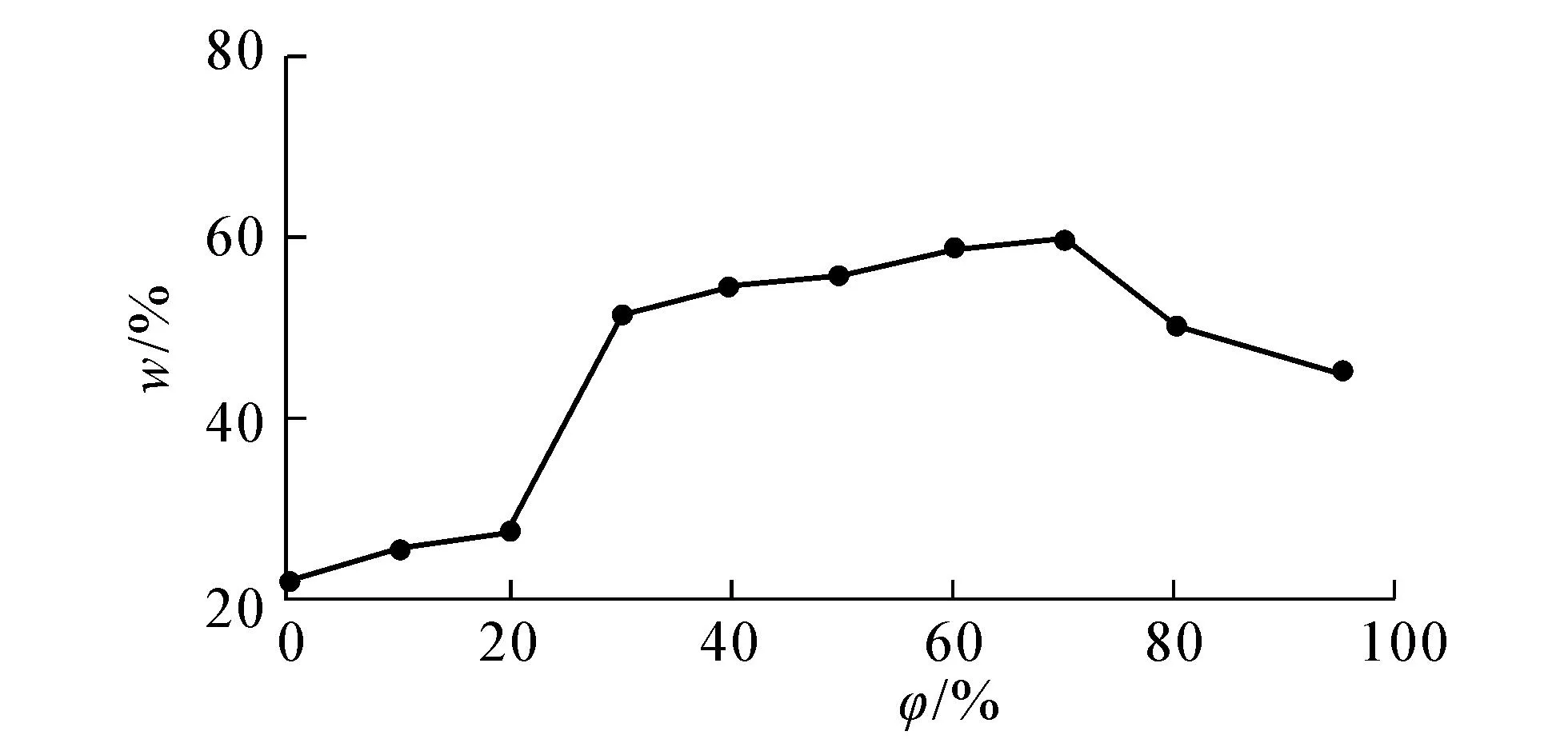
图3 乙醇体积分数对叶子中儿茶素提取率的影响
由图2,3可知,6个乙醇体积分数50%~60%提取果实中儿茶素较好,乙醇体积分数50%~70%提取叶子中儿茶素效果较好,故选择体积分数60%乙醇提取材料中儿茶素.
2.2.1 液料比对儿茶素提取的影响取不同料液比的提取液,抽滤,将果实提取液稀释10倍、叶子提取液稀释50倍后各取5 mL,在279 nm处测其紫外吸光值,测定结果见图4,5.
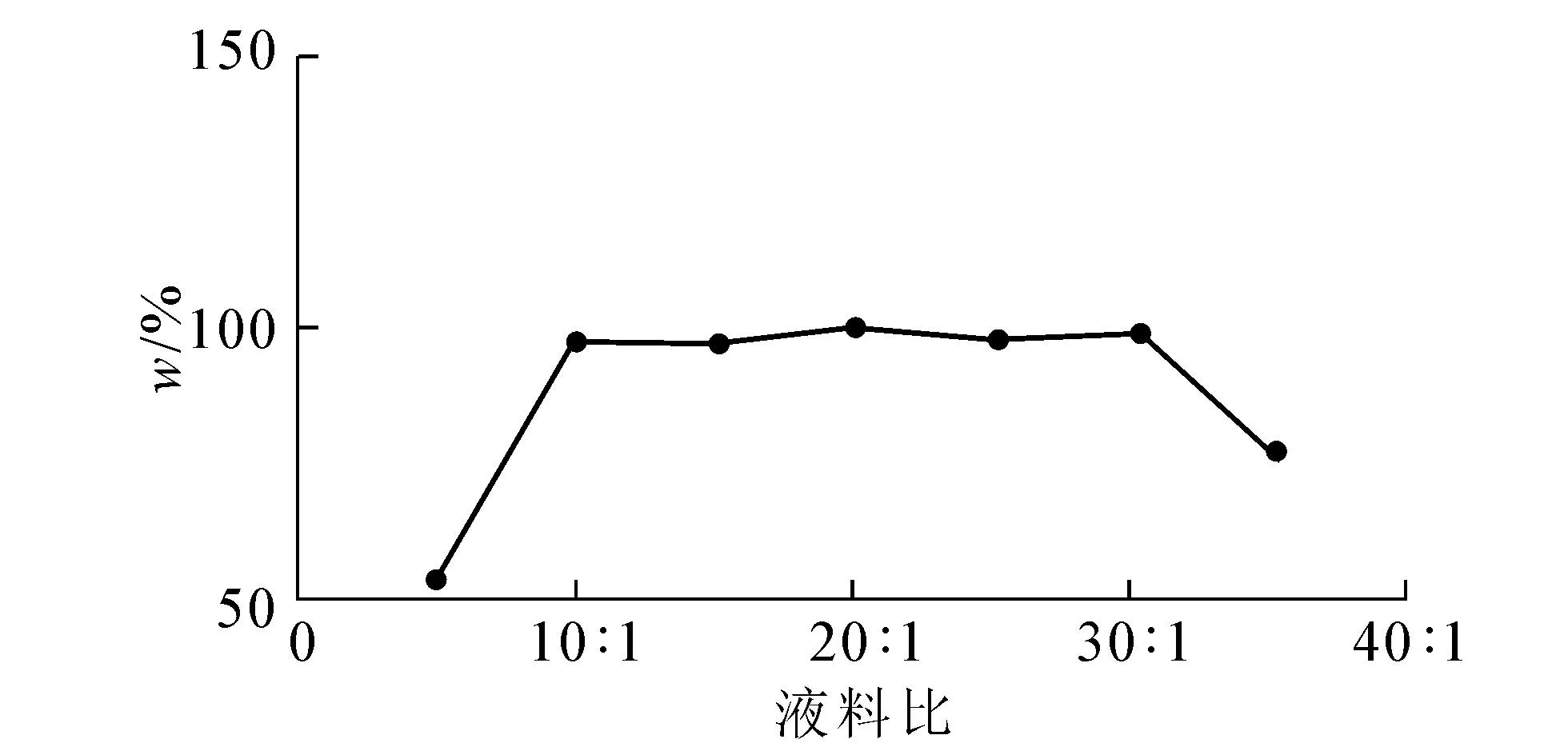
图4 液料比对果实中儿茶素提取率的影响
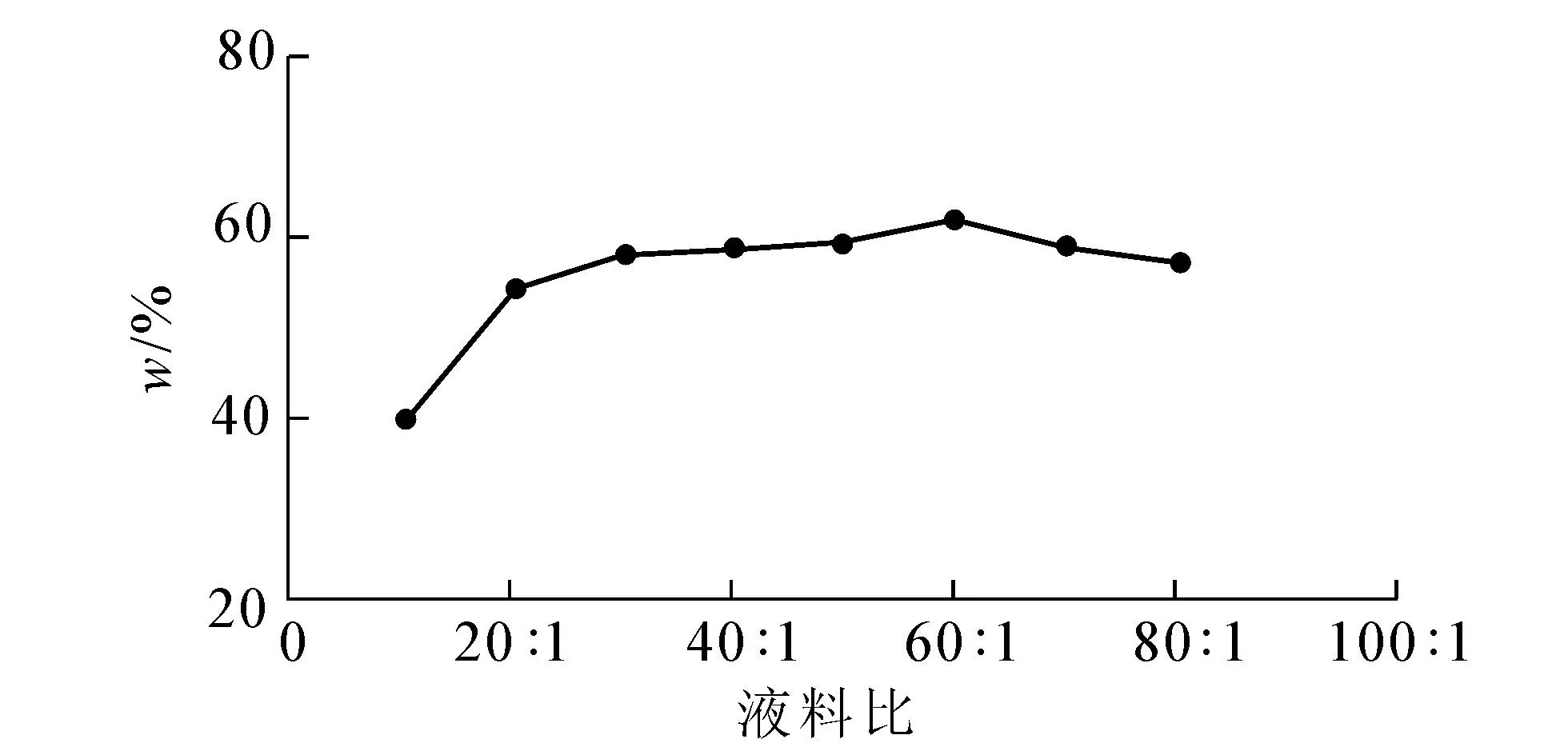
图5 液料比对叶子中儿茶素提取率的影响
从图4,5看出,果实在液料比达到10∶1时提取率趋于稳定,叶子在20∶1时提取率趋于稳定,故正交试验选用液料比10∶1,15∶1,20∶1,25∶1作为4个因素水平.
2.2.2 提取时间对儿茶素提取的影响取不同提取时间下的提取液,抽滤,在279 nm处测其紫外吸光值,结果见图6,7.
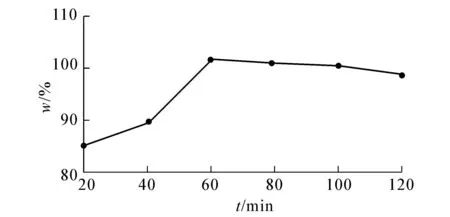
图6 提取时间对果实中儿茶素提取率的影响
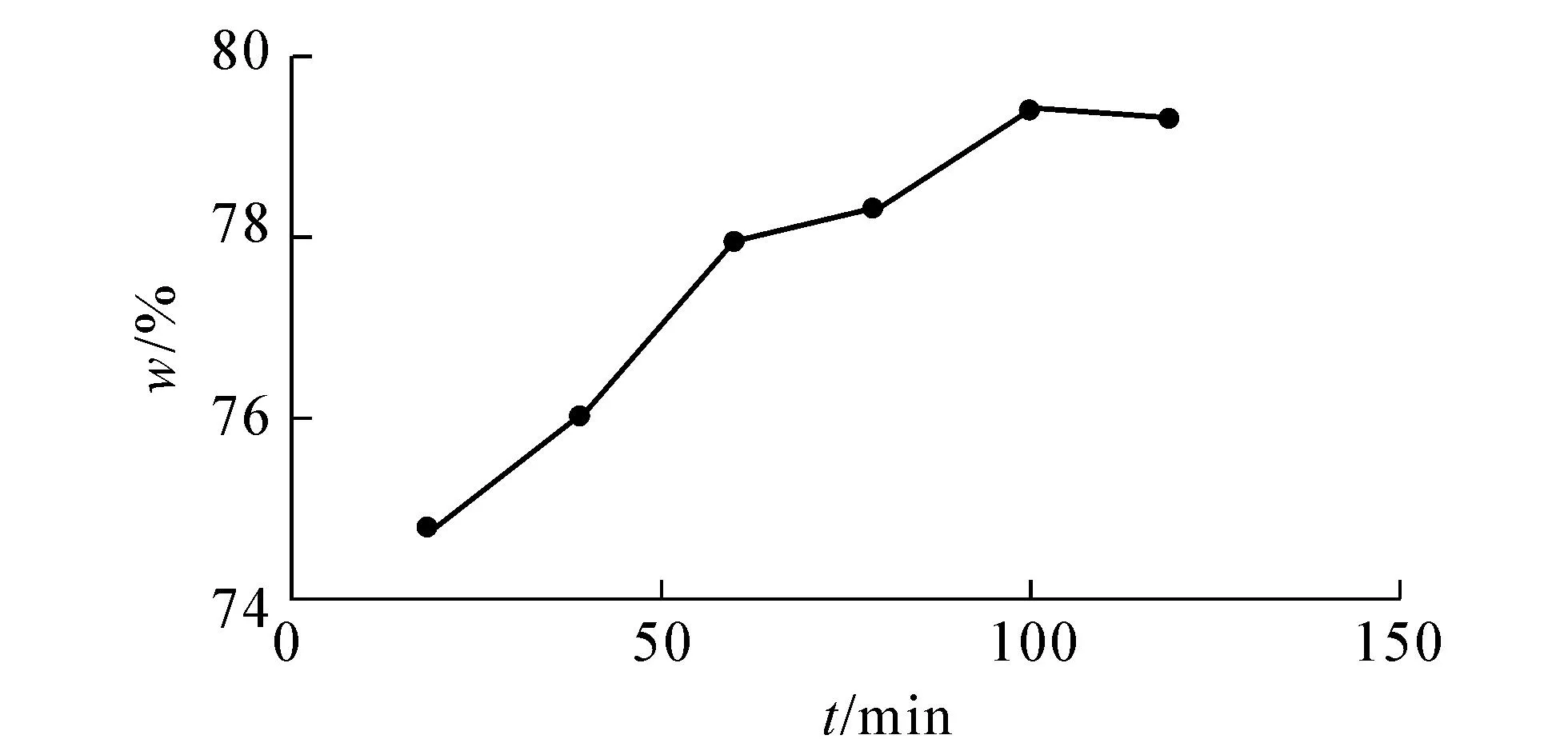
图7 提取时间对叶子中儿茶素提取率的影响
由图6,7可知,果实和叶中儿茶素提取率在60 min后趋于稳定,因此选用50,60,70,80 min作为正交试验提取时间的4个因素水平.
2.2.3 提取温度对儿茶素提取的影响取不同温度下的提取液,抽滤,在279 nm处测其提取液的吸光值,结果见图8,9.
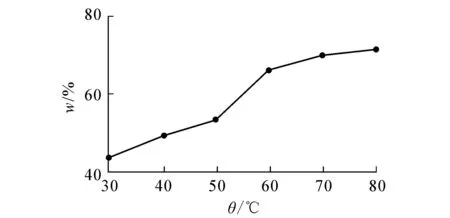
图8 提取温度对果实中儿茶素提取率的影响
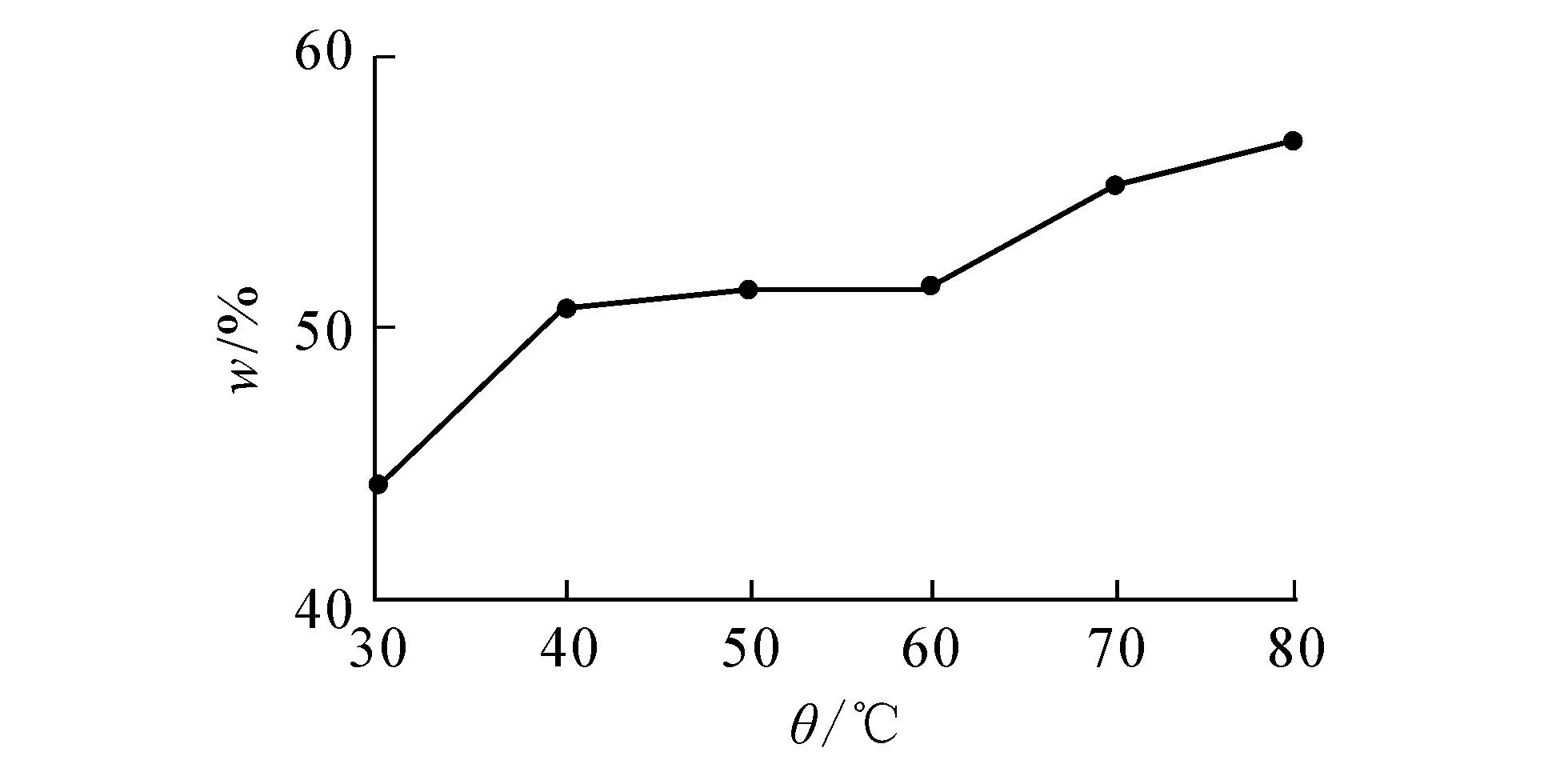
图9 提取温度对叶中儿茶素提取率的影响
由图8,9可知,果实和叶中儿茶素在50 ℃后提取率上升趋势有所变缓.文献[8]表明,儿茶素由于自身的酚性羟基结构,受高温影响极易发生氧化与聚合,90 ℃的高温可能改变儿茶素的结构.未见文献报道儿茶素提取中温度用90 ℃的.实验结果显示90 ℃时在279 nm处紫外吸光值骤然上升,是否改变了儿茶素的结构有待进一步研究.因此,选用50,60,70,80 ℃作为正交试验的4个因素水平.
2.3 正交试验
根据单因素试验所选乙醇体积分数、液料比、水浴提取时间、提取温度等4个因素水平,进行L16(44)的正交实验,实验结果见表1—3.
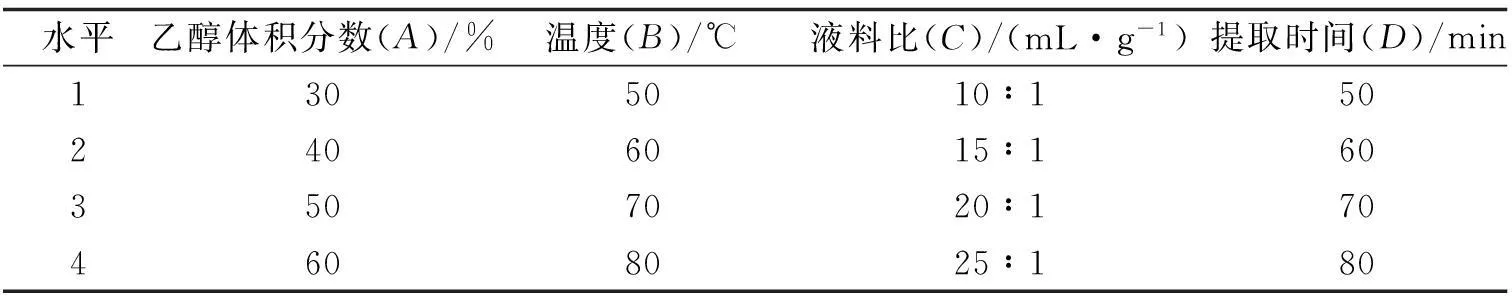
表1 正交实验因素水平
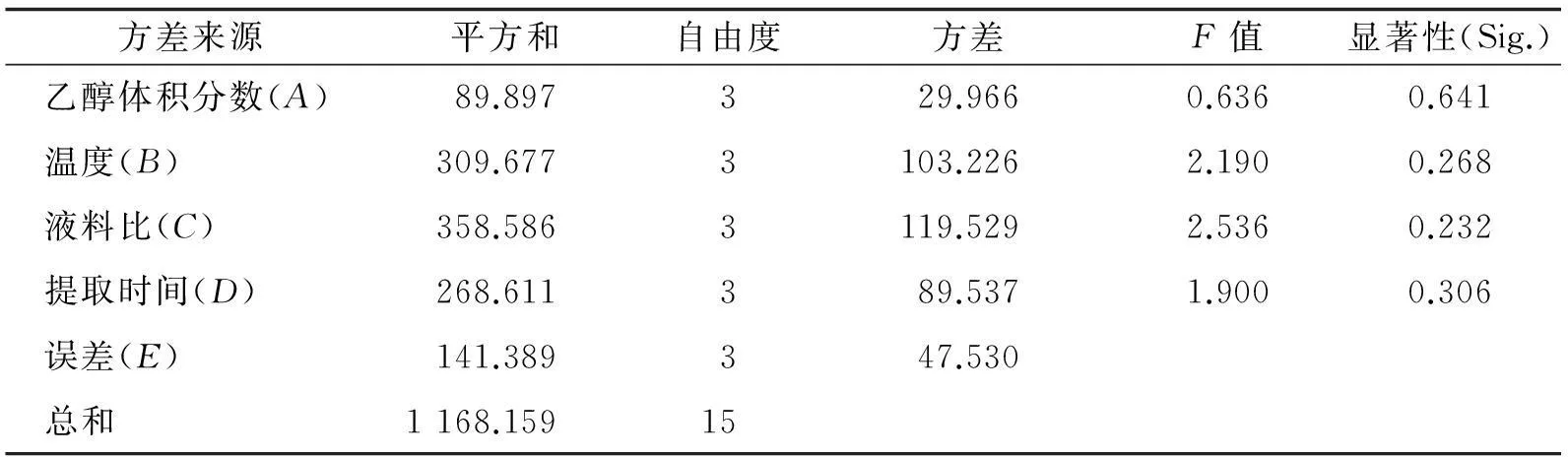
表2 正交试验方差分析(果实)
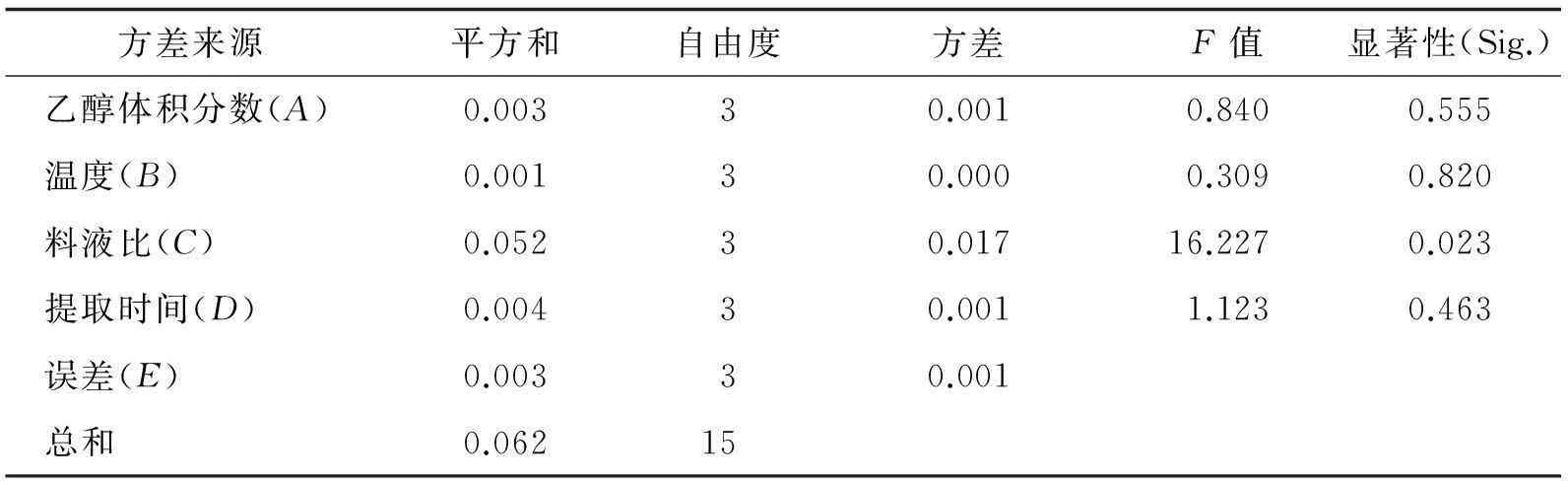
表3 正交试验方差分析(叶)
通过正交实验因素表和方差分析发现:各因素对果实中儿茶素提取的影响由大到小依次为料液比、温度、提取时间、乙醇体积分数;对叶中儿茶素提取率的影响由大到小依次为料液比、提取时间、乙醇体积分数、温度,即果实中儿茶素最优条件为A3B4C3D2(溶剂体积分数50%、温度 80 ℃、提取时间60 min和料液比1∶20),叶中儿茶素最优条件为A3B1C4D3(溶剂体积分数50%、温度50 ℃、提取时间70 min和料液比1∶25).根据方差分析表明,只有料液比对叶中儿茶素提取影响显著.
2.4 精密度检测
精密量取儿茶素标准溶液5 mL,分置50 mL容量瓶中用乙醇-水定容.取5 mL在279 nm处测儿茶素标液的吸光值,重复6次,计算得到相对标准偏差(RSD)为0.08%,结果表明精密度良好.
2.5 稳定性试验
取标准溶液2 mL,用体积分数50%乙醇在40 mL容量瓶中定容,分别在0,1,2,4,6,8 h,取5 mL在279 nm处测紫外吸光值,计算得到相对标准偏差(RSD)为0.21%,说明儿茶素在溶液中8 h内是稳定的.
2.6 加样回收试验
称取同一批果实和叶样品0.500 g 各9份,其中6份分别加入10 mL儿茶素质量浓为50 mg/L的标准溶液,另3份加入10 mL质量分数50%乙醇溶液在80 ℃下水浴提取50 min,抽滤得到提取液,取5 mL在279 nm处测紫外吸光值,计算回收率,果实的平均回收率92.4%(n=6),相对标准偏差为0.78%,叶的平均回收率91.9%(n=6),相对标准偏差为0.56%.
2.7 大孔吸附树脂分离纯化
2.7.1大孔吸附树脂筛选试验结果从树脂筛选结果(表4)可看出,7种大孔吸附树脂只有D941吸附较好.综合考虑吸附率和解吸率,选择D941为本实验分离纯化的大孔吸附树脂,它对儿茶素的吸附率和解吸率分别为84.46%和40.09%.故选择D941进行多花勾儿茶果实中儿茶素的分离纯化工作,而使用体积分数70%乙醇为洗脱剂时洗脱率太低,还须进一步选择.
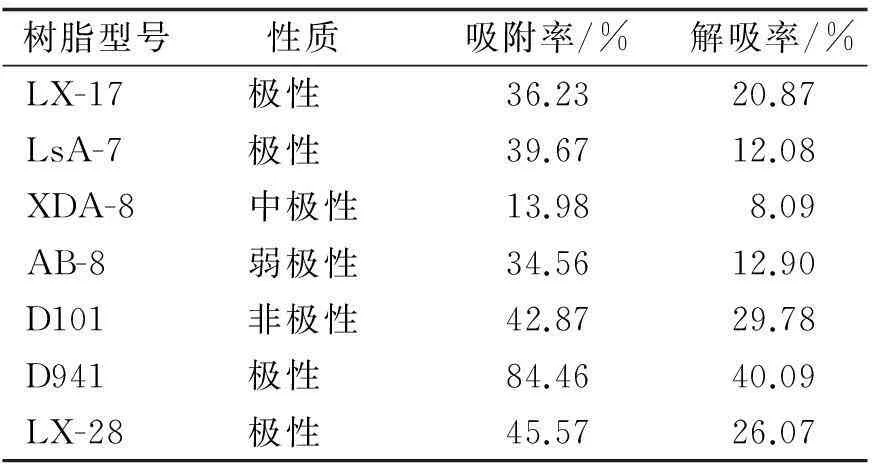
表4 不同大孔吸附树脂对儿茶素的纯化效果对比
2.7.2 洗脱液体积分数的试验结果选取不同体积分数的乙醇及纯净水对已饱和吸附儿茶素的D941大孔树脂进行解吸,解吸率与乙醇体积分数的关系见图10.由图10可知,随着乙醇体积分数升高,解吸效果明显减小,但当乙醇体积分数超过60%时,解吸率有上升趋势.因此,从解吸效果及经济角度考虑,选用纯净水进行解吸.
2.8 HPLC标准曲线及3种供试液儿茶素的检测
儿茶素标准溶液的HPLC标准曲线见图11,儿茶素标准溶液的HPLC色谱图见图12,叶子和果实纯化液的HPLC色谱图见图13,14,自制绿茶纯化液HPLC色谱图见图15.
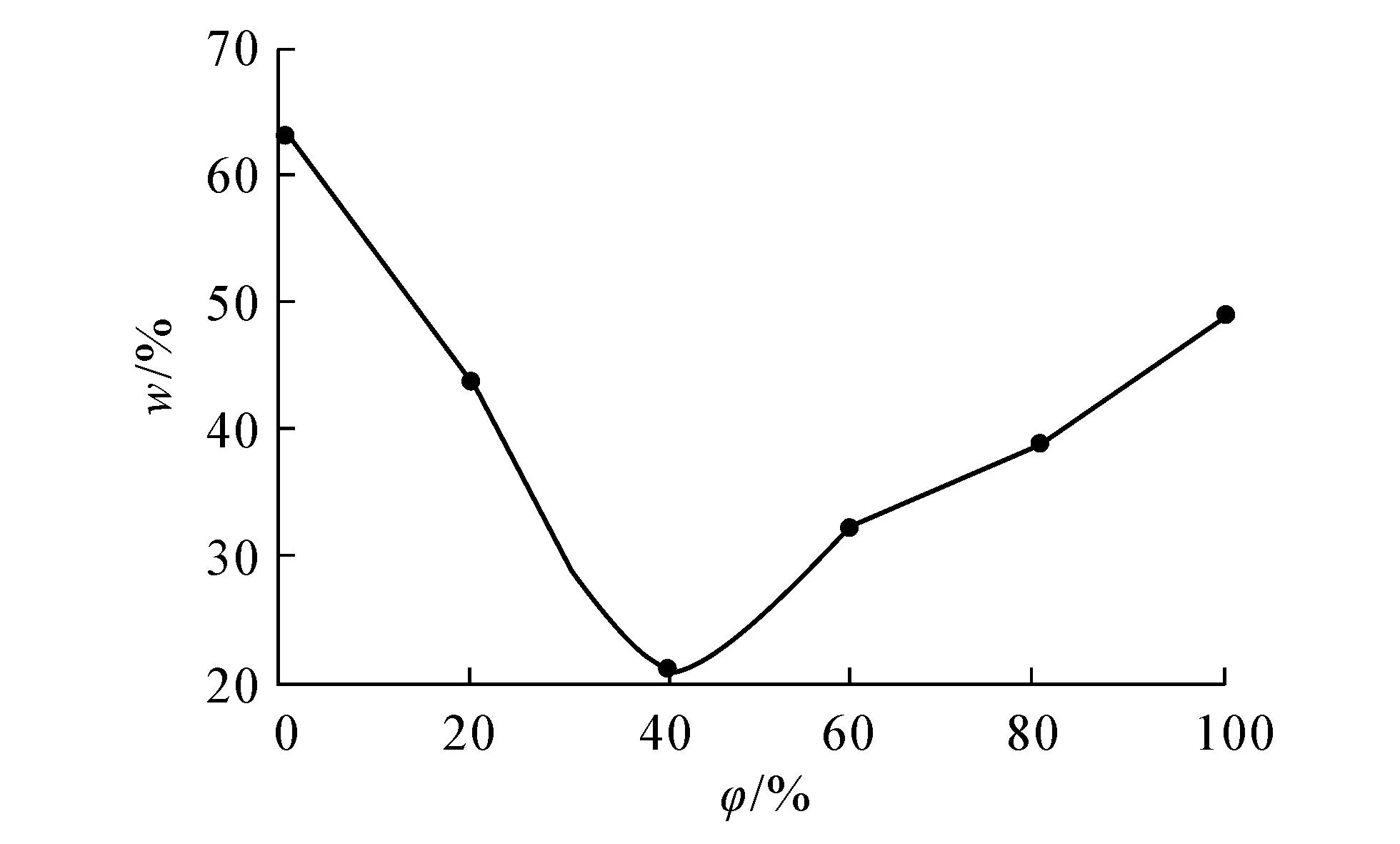
图10 洗脱剂体积分数对提取率的影响
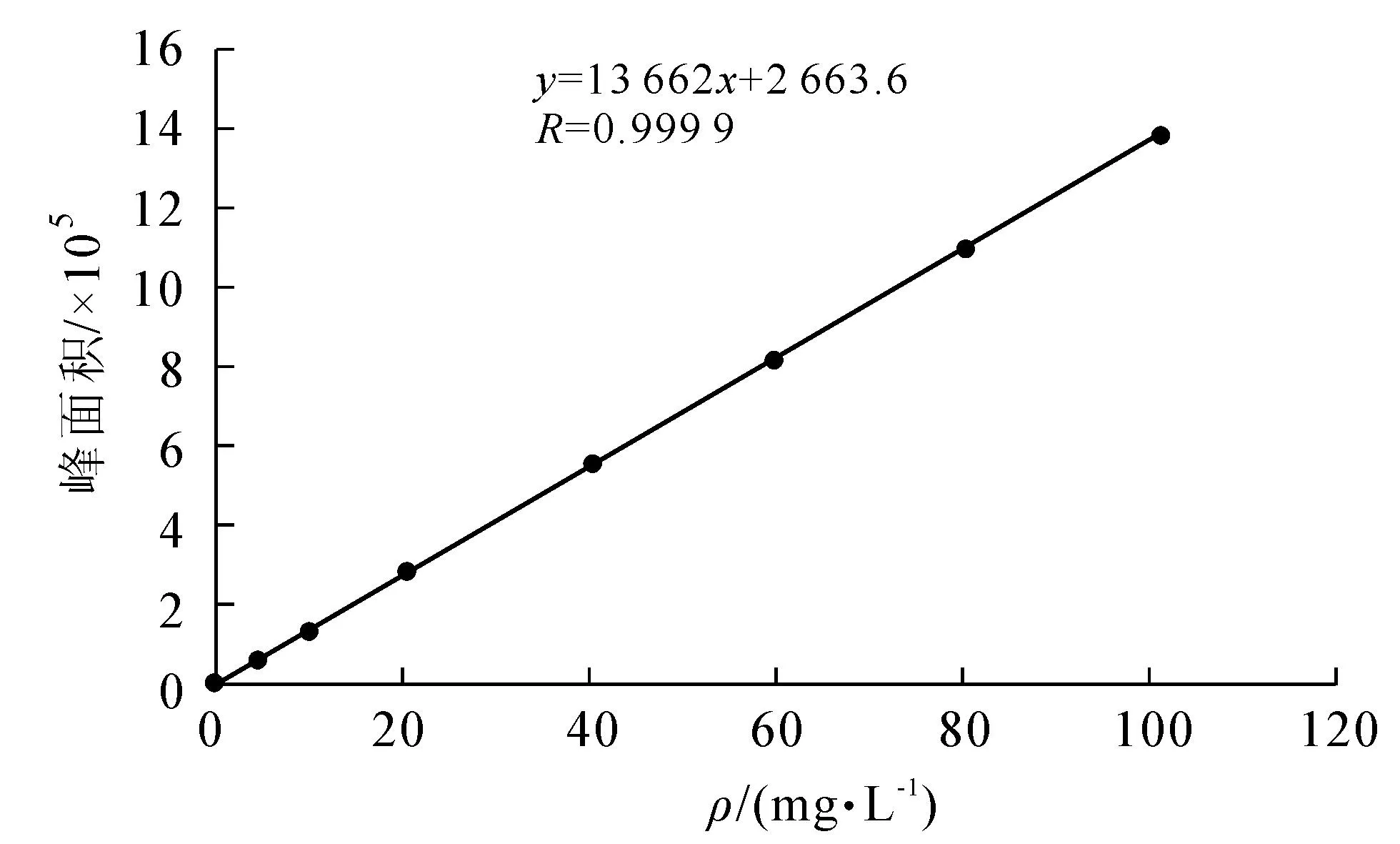
图11 儿茶素HPLC标准曲线
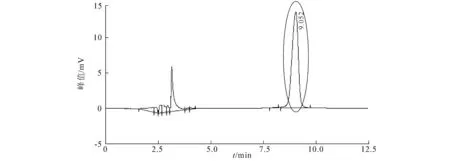
图12 儿茶素标准溶液的HPLC色谱图
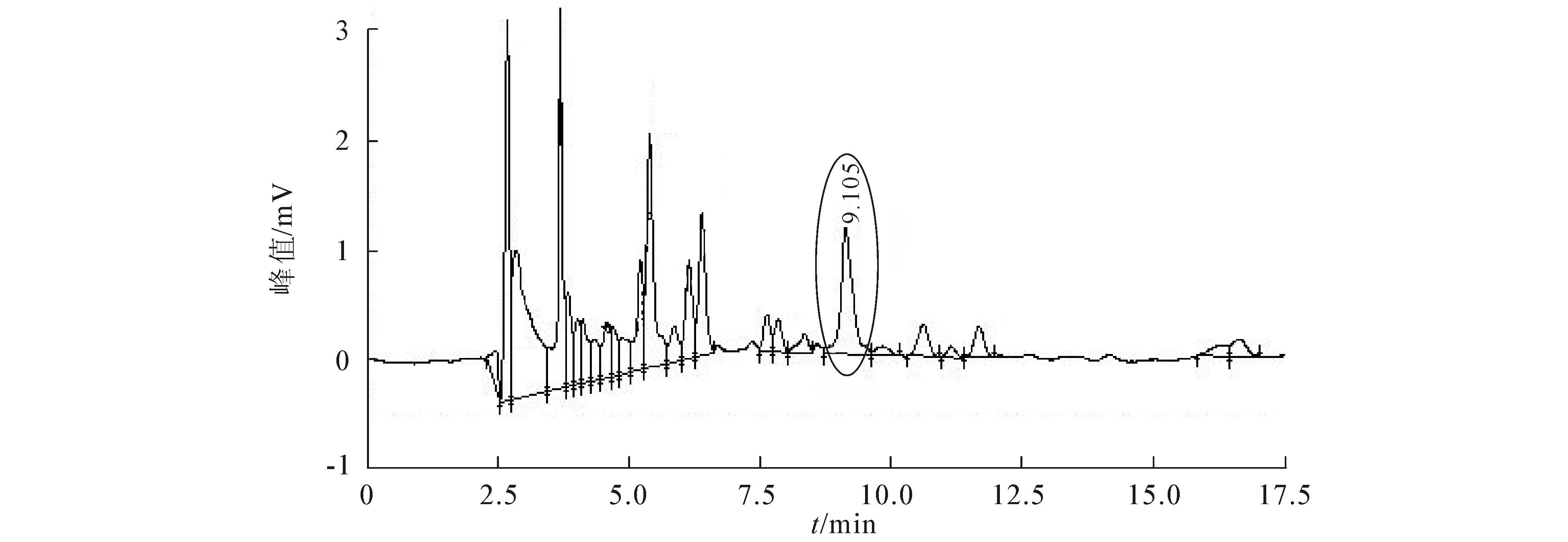
图13 叶子纯化液的HPLC色谱图
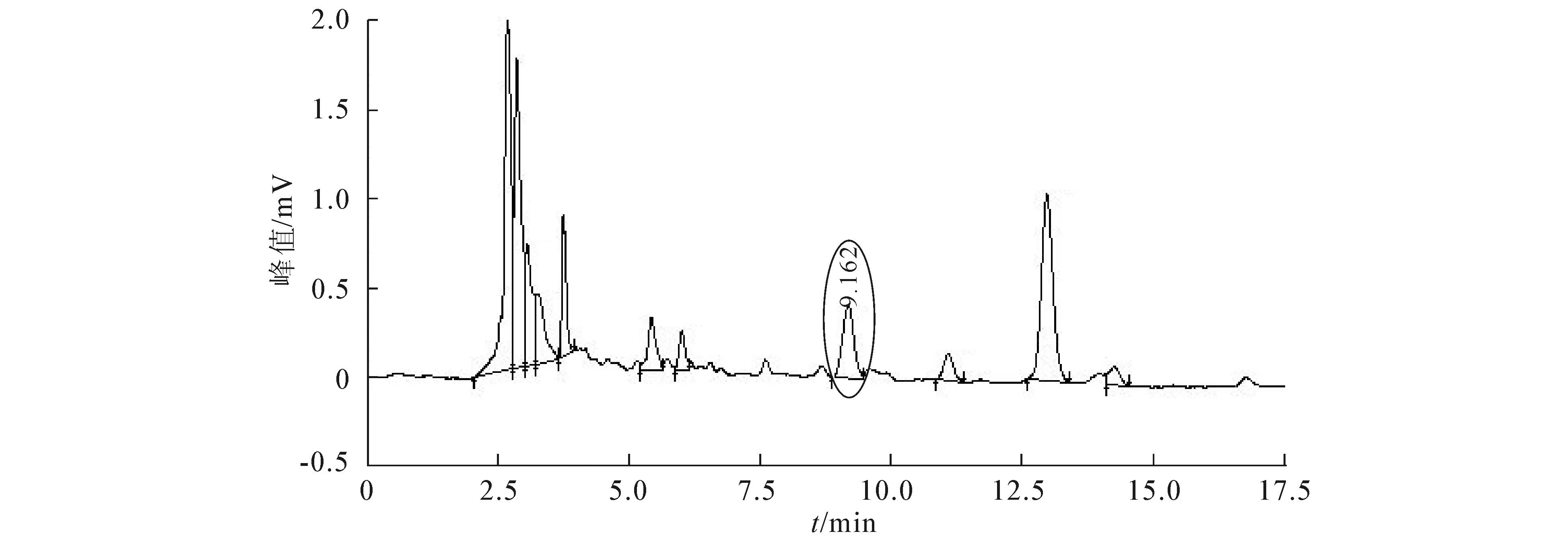
图14 果实纯化液的HPLC色谱图
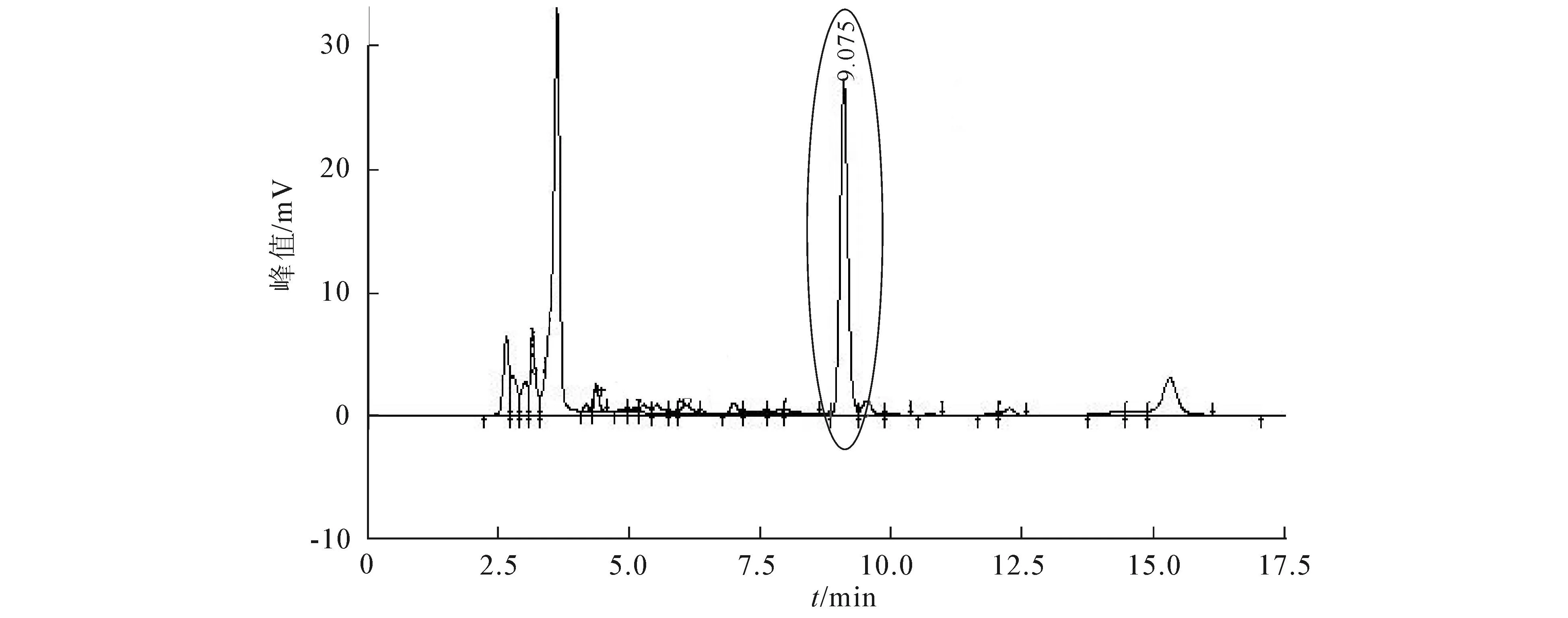
图15 自制绿茶纯化液的HPLC色谱图
3结语
以多花勾儿茶果、叶及同山自采自制的绿茶为材料,通过单因素及正交试验探索提取多花勾儿茶果实与叶中儿茶素的最佳工艺.结果发现,果实儿茶素提取最佳工艺参数是提取溶剂体积分数50%、温度80 ℃、提取时间60 min和料液比1∶20;叶的儿茶素提取最佳工艺参数是提取溶剂体积分数为50%,温度50 ℃、提取时间70 min和料液比1∶25.从7种大孔吸附树脂中筛选出D941树脂对儿茶素提取液进行分离纯化,通过静态吸附和解析研究得出纯净水为最适洗脱液.用HPLC分别对儿茶素的标准液、果实、叶及自制绿茶经纯化的儿茶素制备液进行检测,发现多花勾儿茶的叶片儿茶素含量明显高于果实的,但低于自制绿茶的.儿茶素作为茶多酚的主体成分,是茶的3大功效成分之一,多花勾儿茶果实和叶中均已检测出来且含量适中,为武陵山区民间将其制作成“观音茶”提供科学依据,有必要对其果实、叶中其有效成分做进一步分析与检测.
参考文献:
[1] 陈立,董俊兴.勾儿茶属植物化学成分及其生物活性研究进展[J].中草药,2006,37(4):627-630.
[2] 原征彦.茶多酚类的功能和食品中应用[J].新食品工业,1990,32(2):33-38.
[3] 杨贤强,曹明富,沈生荣,等.茶多酚生物活性的研究[J].茶叶科学,1993,13(1):51-59.
[4] 王杰.普洱茶提取茶多酚及其脱咖啡碱的研究[D].广州:华南理工大学,2012.
[5] 朱斌,陈晓光,宋航,等.茶多酚制备高纯度EGCG的工艺研究[J].食品研究与开发,2009,30(4):7-9.
[6] 王慧,蒋莲芬,唐超,等.高山绿茶茶多酚提取工艺研究[J].安徽农业科学,2012,40(7):4 007-4 009.
[7] 陈宗懋.茶多酚类化合物抗癌的生物化学和分子生物学基础[J].茶叶科学,2003,23(2):83-93.
[8] 刘丽霞.茶叶中6种主要儿茶素的高效液相色谱方法建立及应用[D].南京:南京理工大学,2013.
[9] DONG Aiwen,ZHOU Qi,BU Xiaoying,et al.Adsorption Properties for Separation of Apigenin from Viola Yedoensis on LSA ̄10 Resin[J].Chinese Herbal Medicines,2014,6(1):60-66.
[10] 干宁,李榕生,陈亚东,等.分子印迹固相萃取和电喷雾质谱法联用测定茶叶中四种儿茶素[J].茶叶科学,2009,29(3):231-235.
[11] 沈晓玲,龚正礼.大孔树脂在茶叶功能成分分离中的应用进展[J].食品工业科技,2013,34(16):396-399.
[12] 张盛,刘仲华,黄建安,等.吸附树脂法制备高纯儿茶素的研究[J].茶叶科学,2002,22(2):125- 130.
[13] 徐仲溪,刘仲华,王坤波,等.绿茶多酚和儿茶素提取与原料品质关系的研究[J].湖南农业大学学报:自然科学版,2004,30(3):257-260.
[14] 贾智若,李兵,李耀华,等.反相高效液相色谱法测定杜仲中儿茶素的含量[J].中国实验方剂学杂志,2013,19(5):117-119.
(责任编辑陈炳权)
Separation and Characterization of Catechin in man ̄Made Green Tea,
the Fruits and Leaves of Berchemia Floribunda with
Macroporous Resin and HPLC
YAO Shufeng,TANG Kehua,LIU Xiaopan,CHENG Jiang,DONG Aiwen
(Key Laboratory of Forest Products and Chemical Engineering of Hunan Province,Jishou University,Zhangjiajie 427000,Hunan China)
Abstract:In this study,the extraction process of catechins was investigated with a certain concentration of ethanol as solvent from man ̄made green tea,fruits and leaves of Berchemia floribunda,using the method of waterbath.After the fat soluble pigment was removed by petroleum ether from extracting solution,the catechins was purified by porous resin adsorption method.The static adsorption and desorption tests of catechin with macroporous resin showed that D941 was the optimal resin for purification and the pure water was the optimum eluant.Purified liquid of fruit,leaves and home ̄made green tea extracts were detected by HPLC.The catechins was separated on PC18 chromatographic column (4.6×250 mm,5 μm) at 35 ℃,with nitrile ̄0.4% phosphoric acid (13∶87) as mobile phase at a flow rate of 1 mL/min,and detected at the wavelength of 279 nm (UV scan).The results showed that the catechin content of fruit was the lowest,while the content of man ̄made green tea was significantly higher than that of both the fruit and leaves through the optimized extraction processes.
Key words:Berchemia floribunda;catechin;macroporous resin;HPLC
作者简介:姚姝凤(1991—),女,山西大同人,吉首大学林产化工工程湖南省重点实验室硕士研究生,主要从事林产化学与加工研究通信作者:董爱文(1967—),男,湖南桃源人,吉首大学林产化工工程湖南省重点实验室研究员,主要从事植物活性成分研究.
基金项目:湖南省科技计划资助项目(2013JT2012);张家界市科技计划资助项目(2014ZK01);生态旅游湖南省重点实验室开放基金资助项目(JDSTLY1403);林产化工工程湖南省重点实验室开放基金资助项目(JDZ201404)
收稿日期:2015-03-23
中图分类号:R286.02
文献标志码:A
DOI:10.3969/j.issn.1007-2985.2015.03.018
文章编号:1007-2985(2015)03-0082-08

