主动脉瓣关闭不全法建立新西兰兔心衰模型
王萧,董浩然,麦细焕,符路娣,桑传兰,梁旺
(1.广州中医药大学实验动物中心,广州 510405;2.河南中医学院,郑州 450008;
3.广州中医药大学第一附属医院,广州 510405)
主动脉瓣关闭不全法建立新西兰兔心衰模型
王萧1,董浩然2,麦细焕3,符路娣1,桑传兰1,梁旺1
(1.广州中医药大学实验动物中心,广州510405;2.河南中医学院,郑州450008;
3.广州中医药大学第一附属医院,广州510405)
【摘要】目的用主动脉瓣关闭不全法致新西兰兔心衰模型。方法运用导管术造成新西兰兔主动脉瓣膜关闭不全,制作超容量负荷型心衰模型。观察动物的毛色、精神状态、活动情况、饲料消耗指数、体重增加指数、呼吸频率等指标对该模型进行评价;检测血清SOD活力和MDA含量,判断模型组动物机体抗氧化能力;利用酶联免疫法检测血清中cAMP、cGMP的变化情况;利用基因芯片技术分析该模型基因表达差异。结果模型动物SBP、DBP和LVSP著性下降, LV+dp/dt和LV±dp/dt明显下降, LVDP显著上升。模型组与正常组比较,毛发枯槁,活动减少,进食减少,反应迟钝,精神萎靡,抓起时反抗减轻。模型组呼吸频率加快;模型组血清SOD活性低于正常组, MDA含量高于正常组;模型组血清cAMP明显低于正常组,cGMP明显高于正常组;利用基因芯片共检测出665个差异基因,其中与心功能较密切相关的基因主要与离子通道、肌收缩、信号转导等功能有关。结论采用主动脉瓣关闭不全法建立兔心衰模型方法可靠。主动脉关闭不全,使心脏前负荷增加,造成左心室舒张末期容积增加,导致左心室扩大肥厚及心力衰竭。心肌组织基因芯片检测结果显示,该模型基因表达出现了一定的变化。
【关键词】心衰;主动脉关闭不全;新西兰兔;动物模型
心血管疾病的发病率和病死率非常高, 严重威胁着人类的健康。充血性心力衰竭(CHF)是心血管疾病常见危重症。心脏前后负荷长期过重,心肌收缩力减弱,导致CHF[1]。本研究采用主动脉瓣关闭不全的方法制作新西兰兔血容量超负荷型心衰模型,以血流动力学指标判断造模标准,并通过多个指标对该模型进行评价[2,3]。
1材料与方法
1.1实验动物
32只普通级新西兰兔,雄性,3月龄, 体重1.8~2.3 kg,由广州中医药大学实验动物中心提供【SCXK(粤)2013-0020】,实验在广州中医药大学实验动物中心进行【SYXK(粤)2013-0085】。
1.2试剂与仪器
戊巴比妥钠(沃凯出品,批号:WS20051129),cAMP、cGMP酶联免疫吸附试验试剂盒(R&D),超氧化物歧化酶(SOD)测试盒(南京建成)。RM-6000四道生理记录仪(日本光电公司),UV-mini1420紫外可见分光光度计(日本岛津),4F、5F介入用穿刺鞘管套装、7F介入用引导钢丝(广州前茂医疗用品有限公司),酶标仪MK3(赛默飞世尔仪器有限公司)。
1.3实验方法
1.3.1造模及分组
32只新西兰兔随机选出16只造模,模型成功的14只随机分为模型15d和模型30 d组,每组7只,2只死于急性心衰,造模失败,未纳入统计。其余16只随机分为正常15 d组和正常30 d组,每组8只。
采用主动脉瓣关闭不全法[2-6]:将兔称重后固定,用戊巴比妥钠按30 mg/kg耳缘静脉注射麻醉,将动物仰位固定于手术台上,标记出右颈总动脉,消毒后分离右颈总动脉。分离颈总动脉结扎近心端,用止血钳夹住另一端,插入4F导管鞘管,埋管扎线固定。将静脉穿刺管插入鞘管中至主动脉瓣附近,用生理记录仪记录并计算主动脉收缩压(SBP)、主动脉舒张压(DBP)、左室收缩压(LVSP)、左室舒张压(LVDP)、左室最大上升速率(LV+ dp/dt)、最大变化速率(LV±dp/dt)等值。将导管退至瓣膜口处,用消毒过的7F引导钢丝沿穿刺管一次性捅穿瓣膜,再重新记录以上各值。
判断模型标准:LV± dp/ dtmax下降40%以上,LVEDP上升40%以上或LV±dp/ dtmax下降达不到40%时,则需DBP下降40%以上。符以上条件,且20 min内各参数稳定即为造模成功[6,7]。
1.3.2取材方法
造模后15 d和30 d分别对各组动物取材,检测相关指标。麻醉后耳中动脉取血5 mL,离心后取血清待测。取各组动物心脏称重,并计算心脏比重(心脏质量/体重);取左心室心肌组织,并剪成3块,取1块置于4%中性甲醛缓冲溶液中固定,样本按常规操作包埋,切片备病理检测用;取2块迅速至于液氮保存备组织芯片检测。
1.3.3一般体征观察
一般体征评价主要观察动物的毛色、精神状况、活动量、抓起反抗能力、呼吸频率、体重增加指数、饲料消耗指数。观察动物毛色光泽度;观察动物精神及活动情况;观察动物抓起反抗情况;术后第3天起,每3天观察一次动物呼吸情况,选取10个观察点,每次观察都使动物处于平静状态,轻轻抓起动物并轻柔抚摸动物使其放松处于平静状态,然后使其胸腹向上,测每分钟呼吸频率并记录;分别于造模后15 d和30 d称量动物体重,与造模前体重比较得出体重增加量,然后除以天数(15、30)即得出体重增加指数;每只动物每日消耗饲料量即为饲料消耗指数,每只动物每天给饲料200g,次日给料时称量剩余饲料重量,计算饲料消耗量,称量后清空料盒,重新给料200g,每日计算当天饲料消耗量。
1.3.4血清cAMP、cGMP与血清SOD、MDA含量检测
通过cAMP、cGMP酶联免疫吸附试验试剂盒检测血清cAMP和cGMP浓度,并计算cAMP/cGMP比值;通过SOD、MDA试剂盒检测血清SOD、MDA的含量。
1.3.5基因芯片检测
取左心室心肌组织,检测各组动物基因表达变化情况。基因芯片[Agilent Rabbit Oligo Microarray(4×44K)]由上海钰森生物技术有限公司提供并作基因检测。
1.4 统计方法

2实验结果
2.1血流动力学变化
造模后SBP、DBP和LVSP血流动力学指标显著性下降(P<0.05),LVDP显著上升(P<0.05),LV+dp/dt和LV±dp/dt 血流动力学指标明显下降(P<0.05)。其中SBP、DBP、LVSP、LVDP、LV+dp/dt、-dp/dt、LV±dp/dt的变化率分别为33.26%、39.65%、30.33%、279.35%、41.32%、46.02%、43.50% (表1)。
2.2一般体征变化
造模1d后各组动物均恢复进食,10d后模型组动物活动明显减少,进食减少,反应迟钝,正常组动物无明显变化。正常组新西兰兔毛色光亮,活动频繁,精神活泼,抓起时反抗强烈;造模后15d模型动物毛发枯槁,与正常组相比活动减少,精神萎靡,抓起反抗减轻;造模后30d模型动物毛发枯槁、发黄,活动显著减少,精神萎靡加重,抓起时反抗不明显。
正常组各个观察点观察动物呼吸次数比较无差异,各观察点模型组动物呼吸频率明显高于正常组(P<0.01),且随造模时间的增加,动物呼吸频率有加快的趋势,进一步证实了该模型的稳定性和慢性变化过程(表2)。
2.3体重增加指数和饲料消耗指数
与正常组比较,模型15 d组体重增加指数差异有显著性(P<0.01),饲料消耗指数差异显著造模(P<0.01);与正常组比较,模型30 d组体重增加指数差异有显著性(P<0.05),饲料消耗指数差异有显著性(P<0.05)(表3)。

Tab.1Hemodynamic changes before and after modelling
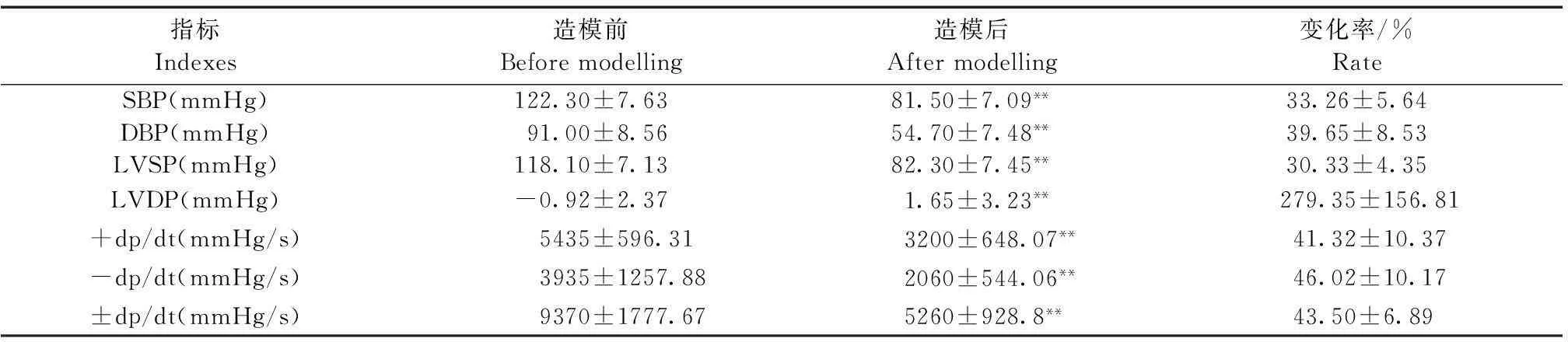
指标Indexes造模前Beforemodelling造模后Aftermodelling变化率/%RateSBP(mmHg)122.30±7.6381.50±7.09**33.26±5.64DBP(mmHg)91.00±8.5654.70±7.48**39.65±8.53LVSP(mmHg)118.10±7.1382.30±7.45**30.33±4.35LVDP(mmHg)-0.92±2.371.65±3.23** 279.35±156.81+dp/dt(mmHg/s) 5435±596.31 3200±648.07** 41.32±10.37 -dp/dt(mmHg/s) 3935±1257.88 2060±544.06** 46.02±10.17±dp/dt(mmHg/s)9370±1777.675260±928.8**43.50±6.89
注:造模后与造模前比较,**P<0.01。
Note. Compared with the indexs before modeling,**P<0.01.
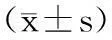
Tab.2Breath frequency at each observation time points

组别Groupsn3d6d9d12d15d正常15dNormalgroup15d848.22±2.5949.33±2.6449.33±2.5447.33±1.8047.22±1.48模型15dModelgroup15d753.13±3.09**54.88±2.89**55.88±3.18**57.5±3.51**57.63±3.81**n18d21d24d27d30d正常30dNormalgroup30d848.63±2.7249.25±2.4348.86±2.5949.13±2.0348.88±2.10模型30dModelgroup30d758.78±2.95**59.44±3.90**61.00±3.97**60.33±4.58**60.00±5.29**
注:与同一观测点正常组比较,**P<0.01。
Note. Compared with the normal groups at same observation time points,**P<0.01.
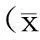
Tab.3Feed consumption index and weight gain index after modeling

组别Groupsn体重增加指数Weightgainindex饲料消耗指数Feedconsumptionindex正常15dNormalgroup15d826.87±3.41100.47±12.99模型15dModelgroup15d719.25±3.47**76.49±13.12**正常30dNormalgroup30d825.5±3.53100.92±11.54模型30dModelgroup30d721.00±3.41▲▲85.42±21.23▲
注:模型15 d组与正常15 d对照组比较,**P<0.01;模型30d组与正常30d对照组比较,▲P<0.05,▲▲P<0.01。
Note. Compared with the normal group at 15 d ,**P<0.01;Compared with the normal group at 30 d ,▲P<0.05,▲▲P<0.01.
2.4血清SOD、MDA测定
与正常15 d组比较,模型15 d组SOD活性明显低于正常15d组(P<0.05),与正常30 d组比较,模型30 d组SOD活性显著低于正常30 d组(P<0.01),而正常15 d组与正常30 d组比较,差异无显著性。与正常15 d组比较,模型15 d组MDA含量明显高于正常15d组(P<0.05),与正常30 d组比较,模型30 d组MDA含量高于正常30 d组(P<0.01),而正常15 d组与正常30 d组比较,差异无显著性(表4)。
2.5血清cAMP、cGMP的变化
与正常组比较,造模后15 d、30 d血清cAMP明显降低,血清cGMP明显升高,cAMP/cGMP比值明显下降;在各模型组中,与造模15 d组比较,造模30 d组血清中cAMP明显降低,cAMP/cGMP比值明显下降(表5)。

Tab.4Serum SOD activity and MDA content of each group
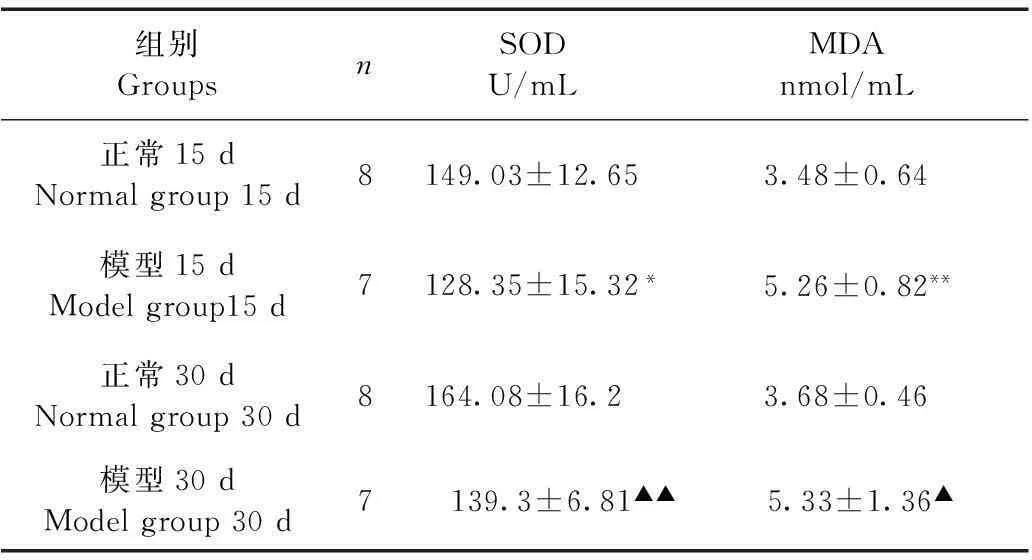
组别GroupsnSODU/mLMDAnmol/mL正常15dNormalgroup15d8149.03±12.653.48±0.64模型15dModelgroup15d7128.35±15.32*5.26±0.82**正常30dNormalgroup30d8164.08±16.23.68±0.46模型30dModelgroup30d7 139.3±6.81▲▲ 5.33±1.36▲
注:模型15 d组与正常15 d对照组比较,*P<0.05,**P<0.01;模型30d组与正常30d对照组比较,▲P<0.05,▲▲P<0.01。
Note. Compared with the normal group at 15 d ,*P<0.05,**P<0.01;Compared with the normal group at 30 d ,▲P<0.05,▲▲P<0.01.

Tab.5Serum cAMP and cGMP content of ecch group
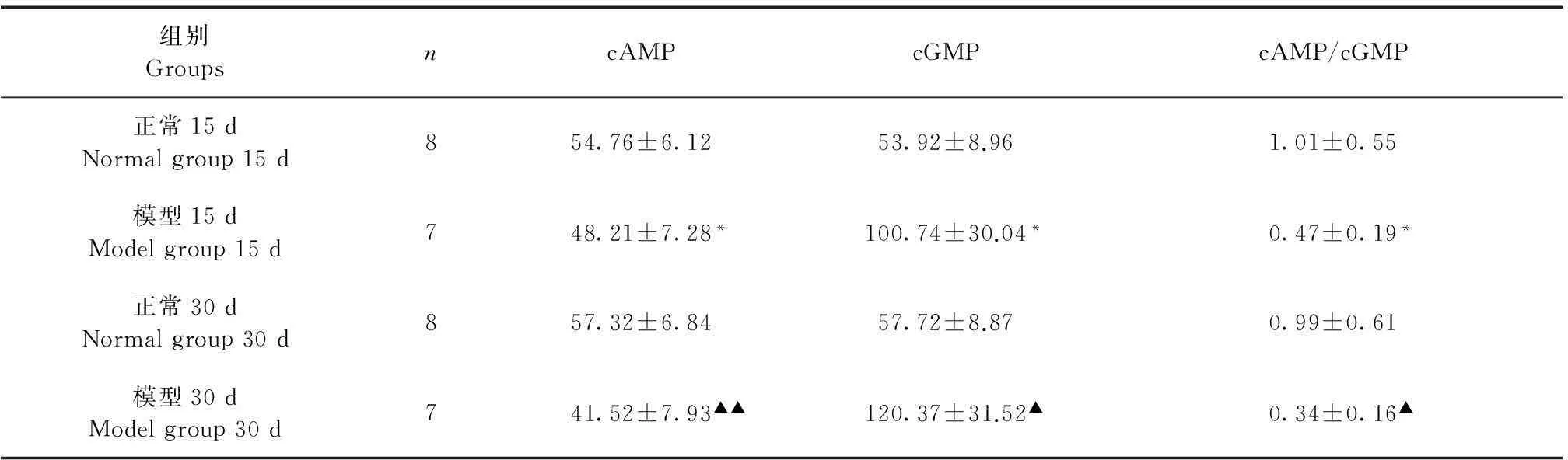
组别GroupsncAMPcGMPcAMP/cGMP正常15dNormalgroup15d854.76±6.1253.92±8.961.01±0.55模型15dModelgroup15d748.21±7.28*100.74±30.04*0.47±0.19*正常30dNormalgroup30d857.32±6.8457.72±8.870.99±0.61模型30dModelgroup30d741.52±7.93▲▲120.37±31.52▲0.34±0.16▲
注:模型15 d组与正常15 d对照组比较,*P<0.05;模型30 d组与正常30 d对照组比较,▲P<0.05,▲▲P<0.01。
Note. Compared with the normal group at 15 d ,*P<0.05;Compared with the normal group at 30 d ,▲P<0.05,▲▲P<0.01.
2.6基因芯片检测结果
15 d模型组与30 d模型组及同一时间点正常组的4张芯片,共检测43,663个基因。差异2倍以上的基因, 15 d正常组与30 d正常组之间有4843个基因。正常组间38,820无差异基因中,有4036个基因在造模后15 d组与正常15 d组间存在差异;2314个基因在30 d模型组与30 d正常组间存在差异。15 d、30 d两组差异基因有665个交集基因(如图1)。NCBI中功能注释明确的兔基因与人的基因序列比对,得到16个功能明确的基因,其中上调基因9个,下调基因7个,与心功能密切相关的基因主要与离子通道、肌收缩、信号转导等功能有关。
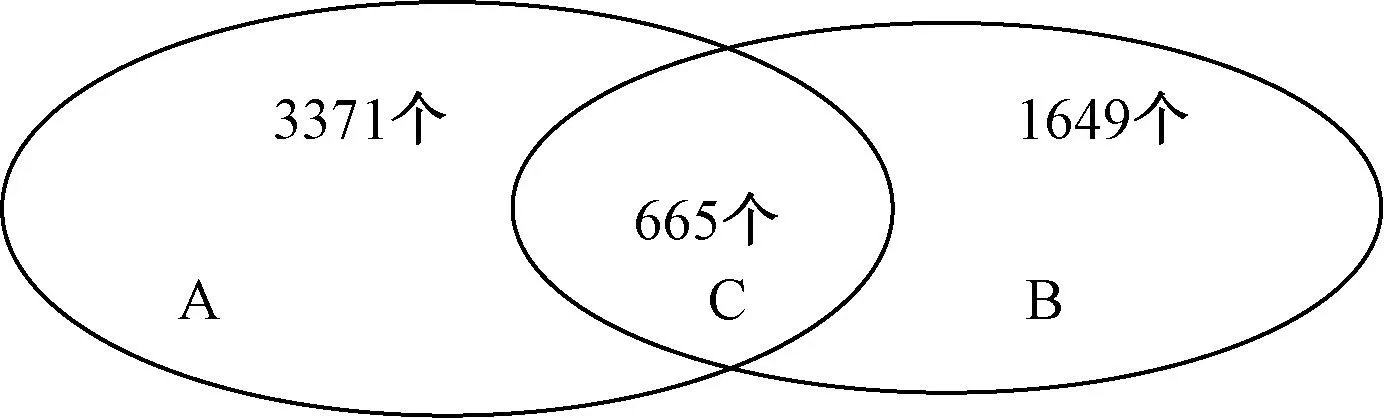
注:A. 15 d造模组与正常组比较差异基因;B. 30 d模型组与正常组比较差异基因;C. 15、30 d模型组与正常组比较存在差异基因。 图1 15、 30 d模型组与正常组比较存在基因差异情况A. Difference of gene expression of 15 d model group compared with the normal group; B. Difference of gene expression of 30 d model group compared with the normal group; C. Difference of gene expression of 15 d and 30 d model groups compared with the normal group. Fig.1 Differences of the gene expression of 15 d and 30 d model groups compared with the normal group
3讨论
主动脉关闭不全时,左心室舒张期的同时接受来自于左心房泵入的血液和主动脉返流的血液,导致左心室充血压力过度,压力超负荷。 LV±dp/dt是评价心肌收缩能力的重要指标;LVDP间接反映了左心室功的功能,左心室舒张不全时或者回心血量增加时会升高。造模前与造模后血流动力学各指标均有显著变化,主动脉瓣关闭不全可使LV±dp/dt绝对值减少,DBP下降, LVDP升高,这与文献报道相符[7]。
测定MDA含量,可检测脂质过氧化程度[8,9]。SOD是一种胞质中能够清除氧自由基的重要抗氧化酶,保护细胞免受强毒性氧自由基损伤[10]。体内自由基的清除主要依靠SOD等抗氧化酶系统,SOD含量能够反映机体的抗氧化能力,因此测定SOD活性能够反映出心肌内抗脂质氧化能力[11]。
模型组血清SOD活性明显低于正常组,说明模型组动物的抗氧化能力低于正常组,模型组血清MDA含量明显高于正常组,表明模型组动物机体受自由基攻击较强,氧化程度加重,受损程度高。该模型心功能降低,机体自由基含量增加,使机体抗氧化能力降低。
血清cAMP和cGMP能够作为衡量心功能的一个敏感性指标,其血清浓度的异常变化在心血管疾病的发生过程中起着重要作用,二者功能作用相反,cAMP与心脏功能呈正相关,cGMP负相关[13-16]。cAMP血清浓度的增加在一定程度上可能是机体的一种代偿机制,cGMP可抑制心肌收缩力,促进血小板聚积,而加重心衰[17]。本研究结果表明,随着心衰程度加重,血清cGMP含量增加,而血清cAMP含量和cAMP/cGMP比值下降,提示血清cAMP、cGMP含量和cAMP/cGMP比值可较好地反映兔心衰程度,可作为敏感性指标对该模型进行评价。
模型组与正常组基因表达发生了一些变化,从基因表达层面上进一步揭示了该模型的一些病理机制。心衰与心肌收缩舒张、信号转导、离子通道等明显相关[18-21]。本研究筛选的16个心功能密切相关的基因,主要与离子通道、心肌收缩、信号转导等功能相关,为探明主动脉关闭不全造成心衰的发病机制打下了一定基础。
参考文献
[1]Maillet M, Lynch JM, Sanna B,etal.Cdc42 is an antihypertrophic molecular switch in the mouse heart [J].J Clin Invest,2009, 119(10): 3079-3088.
[2]许庆文,刘启德,王萧,郑辉.血容量超负荷型兔心功能不全模型方法探讨[J].中药新药与临床药理,2002,13(03):172-173+191.
[3]刘惠良. 心脏收缩力调节对慢性心力衰竭兔心功能影响及其机制研究[D].河北医科大学,2014.
[4]徐淑云.药理实验方法学[M].第二版.北京,人民卫生出版社,1991:962.
[5]王萧,许庆文,翁书和.强心方对超容量负荷型心衰兔模型的治疗作用[J].中药新药与临床药理,2002,13(1):26-27.
[6]王萧,郭学军,谢玲玲,等.强心方对超容量负荷型心衰模型兔的治疗作用[J].广州中医药大学学报,2006,23(3):241-244.
[7]卢兴.心力衰竭[M].北京:人民卫生出版社,1986:1117.
[8]杨晓荣. 脑心康Ⅱ号口服液对心肌缺血大鼠SOD、GSH-PX、MDA的影响[D].吉林大学,2011.
[9]吴艳春. 芪参护心汤对急性心肌缺血再灌注损伤大鼠MDA及SOD的影响[D].黑龙江中医药大学,2009.
[10]刘国利,沈途,张海燕,等.异氟醚预处理对幼兔缺血再灌注损伤心肌MDA、SOD及 ICAM-1mRNA 的影响[J].山东医药,2010,50(51):23-24.
[11]王嵘,苏晓灵,周白丽.葛根素对兔心肌缺血再灌注损伤时SOD、ANF含量的变化[J].青海医学院学报,2005,26(2):102-104.
[12]冼绍祥,心力衰竭中西医结合研究基础与临床[M].上海:上海科学技术出版社,2011:89.
[13]李艳芳,张献.心脏环磷酸腺苷和环磷酸鸟苷的受体调节及其交互作用[J].中国循环杂志,2002,17(3):238-240.
[14]Miller CL,Cai Y,Oikawa M et al.Cyclic nucleotide phosphodiesterase 1A: a key regulator of cardiac fibroblast activation and extracellular matrix remodeling in the heart[J].Basic Res Cardiol,2011,106:1023-1039.
[15]李艳芳,张献.心脏环磷酸腺苷和环磷酸鸟苷的受体调节及其交互作用[J].中国循环杂志,2002,17:238-240.
[16]金戈,董晓丽,明海霞,等. 益气活血颗粒对大鼠心气虚证cAMP/cGMP影响的研究[J]. 中医药学报,2013,03:75-79.
[17]丁娜. 不同频率电针对心肌缺血模型大鼠心包经穴区电阻值及NE、cGMP影响的研究[D].北京中医药大学,2013.
[18]Miyamoto MI, del Monte F, Schmidt U ,et al. Adenoviral gene transfer of SERCA2a improves left-ventricular function in aortic-banded rats in transition to heart failure[J].Proc Natl Acad Sci U S A,2000,18,97(2):793-798.
[19]石向江,刘璐.心衰的基因治疗进展[J].新疆医学,2007,37(1):99-102.
[20]Chen J, Lee SK, Abd-Elgaliel WR, et al. Assessment of cardiovascular fibrosis using novel fluorescent probes[J]. PLoS One,2011,20,6(4):e19097.
[21]Sesti C, Kloner RA, Gene therapy in congestive heart failuae[J]. Circulation,2004,110:242-243.
研究报告
Establishment of a rabbit model of heart failure by aortic regurgitation
WANG Xiao1, DONG Hao-ran2, MA Xi-huan3, FU Lu-di1, SANG Chuan-lan1, LIANG Wang1
(1.Laboratory Animal Center, 3. the First Affiliated Hospital, Guangzhou University of Traditional
Chinese Medicine, Guangzhou 510405, China; 2. Henan University of TCM, Zhengzhou 450008)
【Abstract】ObjectiveTo establish a New Zealand rabbit model of heart failure by aortic regurgitation. Methods Adapting catheterization-induced aortic regurgitation to establish a volume overloat rabbit model of heart failure. The SBP, LVSP, LVDP, LV+dp/dt and LV±dp/dt were observed before and after modeling. The successful criteria of heart failure: the LV±dp/dtmax was decreased more than 40% and the LVDP increased more than 40%, or the LV±dp/dtmax fell down to less than 40% and the DBP should be decrease more than 40%. Evaluating the model by observing the coat color, mental status, physical activity, calculating the feed consumption index, weight gain index, heart rate, respiration frequency and other indicators.The activity of serum SOD and MDA concentration were assayed to determine the antioxidant capacity of the model animals. Enzyme-linked immunosorbent assay kit was used to detect the serum cAMP and cGMP concentration. Gene chip technology was used to analyze the difference of gene expression. Results After modeling, the hemodynamic index of SBP, DBP and LVSP were significantly decreased, LVDP was significantly decreased, LVDP was significantly increased and the LV+dp/dt and LV±dp/dt were significantly decreased. Compared with the normal control group, the model animals showed coat withered, less movement, less eating, unresponsiveness, listlessness, and reduced grab resistance after modeling. The respiratory rate of the model group was significantly increased, and this trend was increased over time. The serum SOD activity was lower, MDA concentration was higher, cAMP concentration was lower, and cGMP concentration was higher in the model group. 665 differentially expressed genes were detected. Compared with the human gene sequences, 16 characteristic genes were obtained. In these 16 genes, which were closely related to heart function, were mainly related to ion channels, muscle contraction, and signal transduction function. Conclusions This reported method to establish rabbit model of heart failure by using aortic regurgitation is reliable. The aortic regurgitation increases cardiac preload, than leads to an increase of the left ventricular end-diastolic volume, and finally results in left ventricular hypertrophy and heart failure. The results of myocardial tissue gene chip test show that there are some changes in gene expression of the model rabbits.
【Key words】Heart failure; Aortic regurgitation; New Zealand rabbit; Animal model
[收稿日期]2014-11-24
Doi:10.3969/j.issn.1005-4847.2015.02.005
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0127-05
[作者简介]王萧(1972-),男,博士,研究员,研究方向:人类疾病动物模型,E-mail: xwang72@gzucm.edu.cn
[基金项目]广东省科技计划(No.2013B040200033);广东省自然科学基金(No.815104071000001)。

