活血止痛贴微生物限度检查方法验证
王俊贵州省食品药品检验所,贵州 贵阳 550004
活血止痛贴微生物限度检查方法验证
王俊
贵州省食品药品检验所,贵州贵阳550004
【摘要】目的:建立活血止痛贴微生物限度检查方法.方法:按照2010版《中国药典》一部的微生物限度检查法,采用常规平皿法和平皿稀释法对各试验菌的回收率逐一进行验证;采用常规法和稀释法进行控制菌铜绿假单胞菌和金黄色葡萄球菌的方法验证.结果:大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌采用平皿稀释法时,回收率均高于70%;白色念珠菌、黑曲霉采用常规平皿法时回收率均高于70%,采用稀释法检查控制菌铜绿假单胞菌和金黄色葡萄球菌时实验组检出实验菌.结论:活血止痛贴细菌计数采用平皿稀释法检查,霉菌和酵母菌计数采用常规平皿法检查,控制菌铜绿假单胞菌和金黄色葡萄球菌采用稀释法检查,方法经验证有效,可用于此药品的微生物限度检查,能有效控制药品质量,准确可靠.
【关键词】活血止痛贴;微生物限度检查法;稀释法
Microbial limit examination method validation of invigorate the circulation of analgesic paste
WANG jun
Guizhou province food and drug inspection,Guiyang 550004,China
Abstract:Objective To establish microbial limit inspection method of invigorate the circulation of analgesic paste.Methods According to Chinese pharmacopoeia 2010 version of the microbial limit test,verify the recovery of each test bacteria individually using the conventional plate method and plate dilution method; method validation to control bacteria Pseudomonas aeruginosa and Staphylococcus aureus using the conventional method and dilution method.Results When Escherichia coli,Staphylococcus aureus,Bacillus subtilis using plate dilution method,recoveries were higher than 70%; Recoveries were higher than 70% when Candida albicans and Aspergillus niger using conventional plate method,detected bacteria in the experimental group when checking control bacteria Pseudomonas aeruginosa and Staphylococcus aureus using dilution method.Conclusion Bacteria count of invigorate the circulation of analgesic paste to check by plate dilution method,mold and yeast count to check by the conventional plate method,control bacteria Pseudomonas aeruginosa and Staphylococcus aureus to check by the dilution method,the method validated,available for microbial limit test to this medicines,can effectively control drug quality,accurate and reliable.
Key words:invigorate the circulation of analgesic paste; Microbial limit test; Dilution method.
1 实验材料
1. 1供试品活血止痛贴(批号: 140401、140402、140403,贵州心意药业有限责任公司),规格: 2. 3g/贴,9 贴/盒.
1. 2仪器高压蒸汽灭菌器、净化操作间、净化工作台、生物安全柜、振荡器、电热恒温水浴箱、电热恒温培养箱.1. 3培养基pH 7. 0无菌氯化钠-蛋白胨缓冲液、营养琼脂培养基、玫瑰红钠琼脂培养基、胆盐乳糖培养基、营养肉汤、溴化16烷基三甲胺琼脂培养基、甘露醇氯化钠琼脂培养基(均由北京陆桥技术有限责任公司生产) .
1. 4菌种大肠埃希菌( Escherichia coli)[CMCC ( B) 44102]第3代;金黄色葡萄球菌( Staphylococcus aureus) [CMCC ( B) 26003]第3代;枯草芽孢杆菌( Bacillus subtilis)[CMCC ( B) 63501]第3代;白色念珠菌( Candida albicans)[CMCC ( F) 98001]第3代;黑曲霉( Aspergillus niger)[CMCC ( F) 98003]第3代;铜绿假单孢菌( Pseudomonas aeruginosa)[CMCC ( B) 10104]第3代.
2 方法与结果
2. 1菌液制备方法接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的新鲜培养物至营养肉汤培养基中,置30~35℃培养18~24h,分别取上述培养物1ml,加0. 9%的无菌氯化钠溶液9ml,10倍递增稀释制成每1ml含菌数为50~100cfu的菌悬液;接种白色念珠菌的新鲜培养物至改良马丁培养基中,置23~28℃培养24~48h,取培养物1ml,加0. 9%无菌氯化钠溶液9ml,10倍递增稀释制成每1ml含菌数为50~100cfu的菌悬液;接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基中,置23 ~28℃培养5~7d,加入5ml含0. 05% ( ml/ml)聚山梨酯80的0. 9%无菌氯化钠溶液,将孢子洗脱.吸出孢子悬液至无菌试管内.取原液1ml,加含0. 05% ( ml/ml)聚山梨酯80的0. 9%无菌氯化钠溶液9ml,10倍递增稀释制成每1ml含孢子数为50~100cfu的孢子悬液.
2. 2供试液制备按2010年版《中国药典》一部附录微生物限度检查法之规定,取供试品100cm2,放置于无菌纸上,粘贴面朝上,用无菌纱布覆盖贴膏剂的粘贴面,然后用无菌剪刀剪碎,置500ml无菌的含玻璃珠的三角瓶中,加30ml的十四烷基酸异丙酯,45℃保温振摇至供试品分散均匀,加pH 7. 0无菌氯化钠-蛋白胨缓冲液至200ml,充分振摇,将部分油脂倒出,将剩余萃取液倒入无菌的分液漏斗中待油水明显分层,萃取,用三角烧瓶收集水层作为1 ∶20供试液,备用.
2. 3菌落计数方法的验证
2. 3. 1试验组取1∶20供试液分1、0. 5、0. 2ml和含50 ~100cfu的试验菌液(大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉),分别注入平皿中,立即倾注营养琼脂培养基(大肠埃希菌、金黄色葡萄球菌、
枯草芽孢杆菌)和玫瑰红钠琼脂培养基(白色念珠菌和黑曲霉),每株试验菌平行制备2个平皿,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌置30~35℃培养3d,白色念珠菌和黑曲霉置23~28℃培养5d,测定其菌数.
2. 3. 2菌液组分别吸取含50~100cfu的试验菌液(大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉),注入灭菌平皿中,立即倾注营养琼脂培养基(大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌)和玫瑰红钠琼脂培养基(白色念珠菌和黑曲霉)每株试验菌平行制备2个平皿,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌置30~35℃培养3d,白色念珠菌和黑曲霉置23~28℃培养5d,测定其菌数.
2. 3. 3供试品对照组取1∶20供试液分1、0. 5、0. 2ml分别注入平皿中,立即倾注营养琼脂培养基和玫瑰红钠琼脂培养基,细菌计数和霉菌及酵母菌计数分别平行制备2个平皿,营养琼脂培养基置30~35℃培养3d,玫瑰红钠琼脂培养基置23~28℃培养5d,测定其菌数.
2. 3. 4回收率计算各试验菌株的回收率= (实验组平均菌落数-供试品对照组平均菌落数)÷菌液组平均菌落数×100%,结果见表1-3.
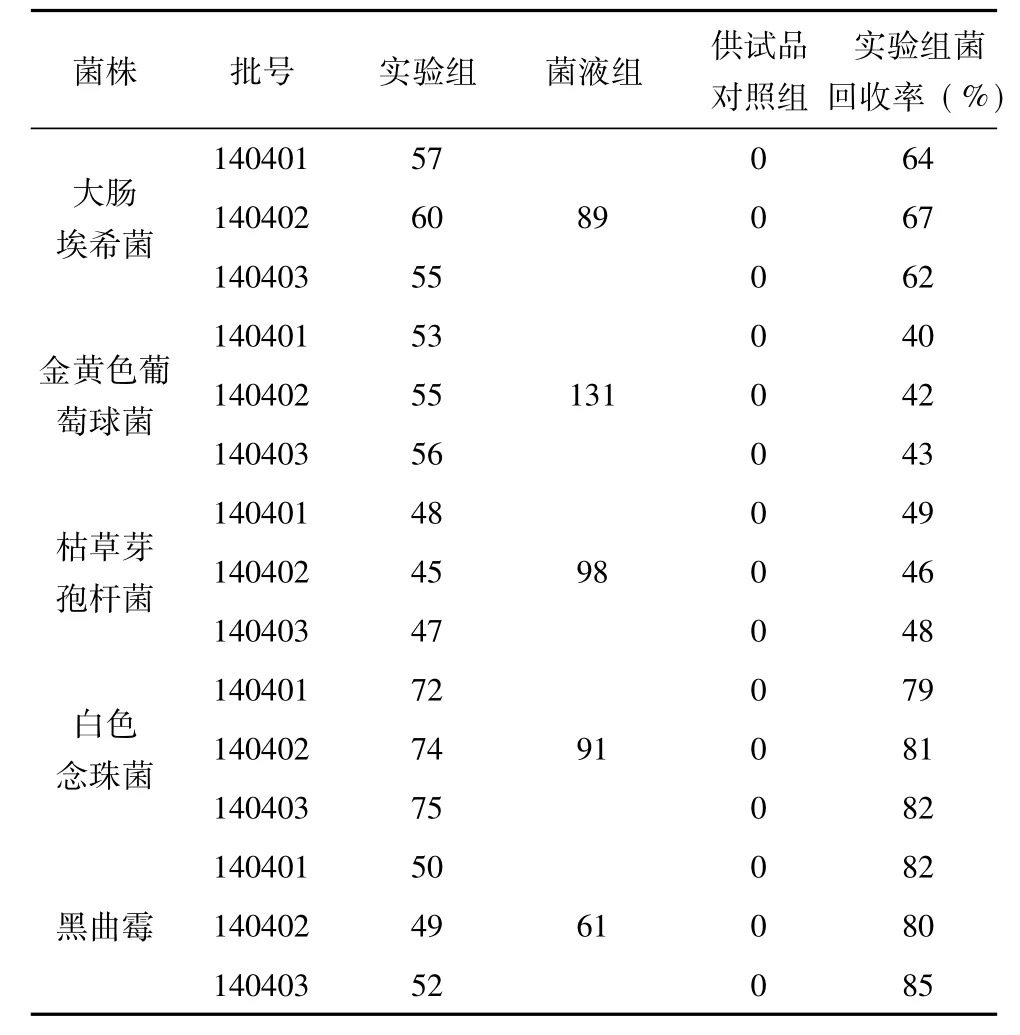
表1 1ml/皿细菌、霉菌及酵母菌计数方法的验证测定结果( %)
由表1、表2、表3的结果可知,平皿稀释法试验大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌3株菌株回收率均能达到70%以上,常规平皿法试验白色念珠菌、黑曲霉2株菌株回收率均能达到70%以上,说明平皿稀释法法可用于活血止痛贴的细菌计数,常规平皿法可用于活血止痛贴的霉菌及酵母菌计数.
2. 4控制菌检查方法的验证
2. 4. 1金黄色葡萄球菌检查方法的验证
2. 4. 1. 1试验组分别取1∶20的供试液各20ml及含50~100cfu金黄色葡萄球菌菌液,分别接种至100、200ml的营养肉汤培养基内,34℃培养24h,可见100ml培养基不混浊,200ml培养基混浊,取上述两种培养物,划线接种至甘露醇氯化钠琼脂培养基的平板上,培养24h,可见100ml的无菌生长,200ml的有菌落生长,呈金黄色,圆形凸起,边缘整齐,光滑湿润,外周有黄色环.
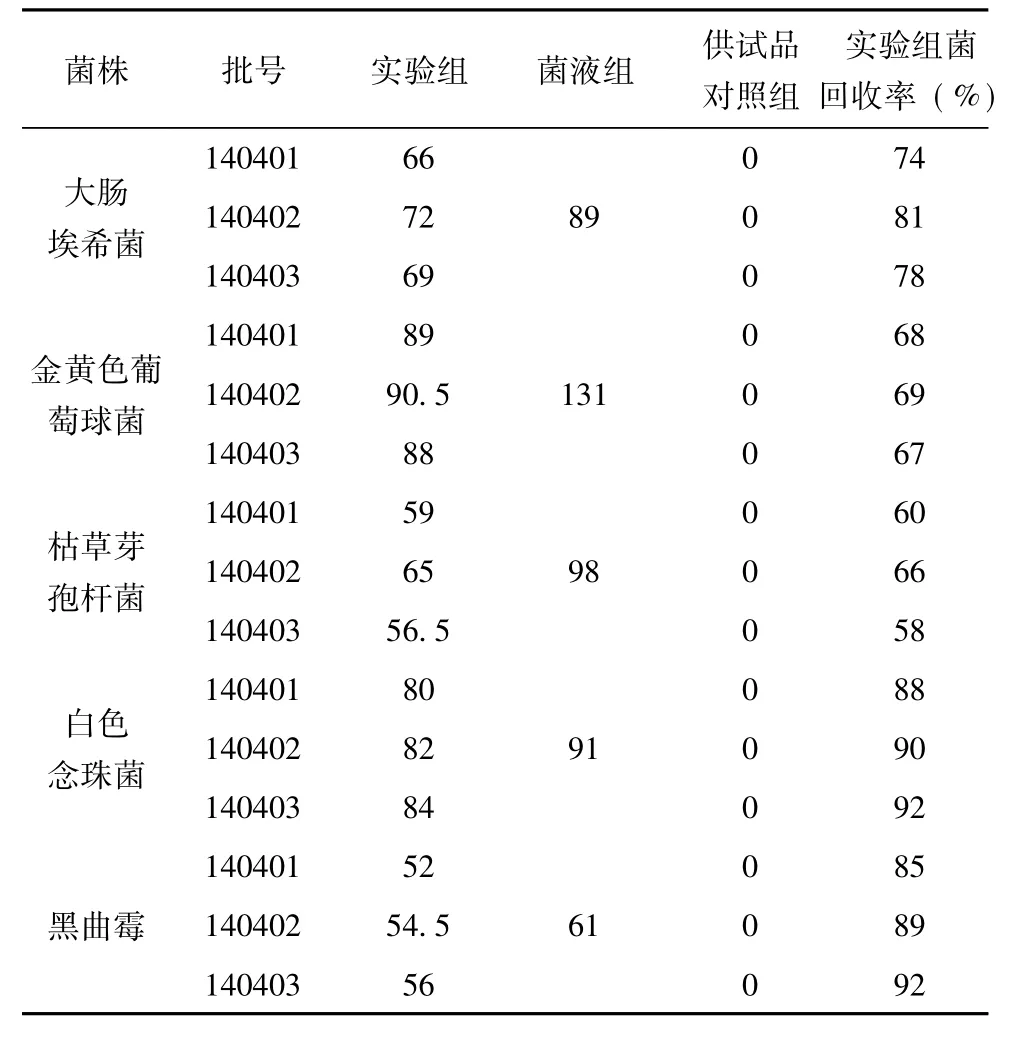
表2 0. 5ml/皿细菌、霉菌及酵母菌计数方法的验证测定结果( %)

表3 0. 2ml/皿细菌、霉菌及酵母菌计数方法的验证测定结果( %)
2. 4. 1. 2阴性菌对照组取1∶20的供试液20ml及含50~100cfu大肠埃希菌菌液,接种至200ml的营养肉汤培养基内,34℃培养24h.取上述培养物,划线接种至甘露醇氯化钠琼脂培养基的平板上,培养24h,平板上无菌生长.
2. 4. 1. 3验证结果上述方法试验组100ml未检出金黄色葡萄球菌,200ml检出了金黄色葡萄球菌,阴性菌对照组未检出大肠埃希菌.说明稀释法200ml营养肉汤培养基可以用于退热贴金黄色葡萄球菌的检查.结果见表4.

表4 控制菌金黄色葡萄球菌验证结果
2. 4. 2铜绿假单胞菌检查方法的验证
2. 4. 2. 1试验组分别取1∶20的供试液各20ml及含50~100cfu铜绿假单胞菌菌液,分别接种至100、200ml的胆盐乳糖增菌培养基内,34℃培养24h,可见100ml培养基不混浊,200ml培养基混浊,有菌膜生长,取上述两种培养物,划线接种至溴化16烷基三甲胺琼脂培养基平板上,培养24h,可见100ml的无菌生长,200ml的有菌落生长,呈灰白色,扁平、无定形、周边有扩散现象,表面湿润,菌落周围有水溶性蓝绿色素扩散,使培养基显蓝绿色.
2.4.2.2阴性菌对照组取1∶20的供试液20ml及含50~100cfu大肠埃希菌菌液,接种至200ml的胆盐乳糖增菌培养基内,34℃培养24h.取上述培养物,划线接种至溴化16烷基三甲胺琼脂培养基平板上,培养24h,平板上无菌生长.
2. 4. 2. 3验证结果上述方法试验组100ml未检出铜绿假单胞菌,200ml检出了铜绿假单胞菌,阴性菌对照组未检出铜绿假单胞菌.说明稀释法200ml胆盐乳糖增菌培养基可以用于活血止痛贴铜绿假单胞菌的检查.结果见表5.

表5 控制菌铜绿假单胞菌验证结果
3 结论
综上所述,活血止痛贴细菌计数采用平皿稀释法检查,霉菌和酵母菌计数采用常规平皿法检查,控制菌铜绿假单胞菌和金黄色葡萄球菌采用稀释法检查,方法经验证有效,可用于此药品的微生物限度检查,能有效控制药品质量,准确可靠.
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010: 79-88.
[2]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010: 351-407.
收稿日期:( 2014. 11. 29)
【文章编号】1007-8517 ( 2015) 04-0014-03
【文献标志码】A
【中图分类号】R927. 11

