组织特异miRNA在小鼠造血体系细胞终末分化中的表达和意义
何洁华 廖建友 吴珏 邓伟溪
组织特异miRNA在小鼠造血体系细胞终末分化中的表达和意义
何洁华 廖建友 吴珏 邓伟溪
【摘要】目的 鉴定小鼠造血体系发育过程中特异性表达的miRNAs,探讨其调控细胞终末分化的分子机制。方法 PMA诱导HL-60分化为巨噬细胞样细胞,Cayman吞噬作用检测试剂盒结合荧光显微镜显影检测诱导后细胞的吞噬作用,Real-time PCR检测巨噬细胞分化指标CD 11 b、CD 4以及miR-155的表达。结果 成功建立使用PMA诱导人前髓性白血病细胞HL-60分化为巨噬细胞样细胞模型,并发现组织特异性miR-155随着巨噬细胞分化表达水平逐渐上调。结论 造血体系特异miR-155参与调控巨噬细胞终末分化,揭示组织特异性miRNAs调控小鼠组织细胞分化和组织发育的普遍意义。
【关键词】造血体系特异miRNA;巨噬细胞;终末分化
研究发现[1-2],小鼠各个组织中存在着一批时空特异性表达miRNA,它们的表达随着组织发育进程而改变,同时只在某个组织中高表达,暗示这些miRNA在组织的发育和组织细胞的定向分化过程中发挥着重要的作用[3]。在前期研究中发现起源于内胚层的肝脏的特异性表达miR-122在小鼠肝细胞分化和肝脏发育中有重要的调控作用[4],本研究在起源于中胚层造血系统中鉴定到特异性表达miR-155参与巨噬细胞终末分化,为证明组织特异性miRNA在小鼠各组织细胞命运决定和组织发育过程中的调控作用是普遍存在的提供依据。
1 材料与方法
1.1 材料
人前髓性白血病细胞株HL-60 RPMI-1 640 完全培养基培养。细胞培养的胎牛血清、培养基均购自Invitrogen公司;RT-PCR kit购自Takara公司;PMA购自Sigama公司;巨噬细胞吞噬作用检测试剂盒购自Cayman公司。
1.2 HL-60细胞体外诱导分化为巨噬细胞
HL-60接种到6孔板并同时加入PMA 进行诱导,以0.1 nM,1 nM终浓度加入,诱导两天后检测细胞形态变化,并收取RNA进行检测。
1.3 巨噬细胞吞噬作用检测
使用Cayman吞噬作用检测试剂盒结合荧光显微镜拍照检测诱导后细胞的吞噬作用,主要根据细胞是否吞噬了表面涂有带荧光标记rabbit-IgG的玻璃珠子,即表示体外细胞的吞噬能力的强弱。
1.4 Real-time PCR
Trizol试剂分别提取细胞总RNA,逆转录试剂盒将RNA反转为cDNA,然后于SYBR Green荧光定量试剂盒检测,miRNA的表达量以U 6的表达进行标准化。
1.5 数据处理及统计分析
qRT-PCR的结果数据来自于至少3次独立实验,每次3个复孔。在进行两组之间的差异分析时使用双尾的Student’s Test;进行多组之间的差异分析时使用ANOVA,P<0.05,差异具有统计学意义。
2 结果
2.1 巨噬细胞体外诱导分化模型的建立
HL-60细胞在0.1 nM和1 nM的PMA诱导后,细胞从原来的悬浮状态变成贴壁生长状态,吞噬作用检测显示细胞能够吞噬带有荧光标记的玻璃珠子。见图1 A。荧光定量PCR显示巨噬细胞分化标志物CD 11 b和CD 14 mRNA 表达上调。见图2 B。综上所示,我们成功构建了使用PMA诱导HL-60细胞分化为巨噬细胞的体外细胞诱导模型。
2.2 miR-155参与调控造血体系中巨噬细胞的分化发育过程
在HL-60诱导分化为巨噬细胞的细胞模型中确定各造血体系特异性表达的miRNA的表达情况,见图2。在多个特异性miRNA中,只有miR-155的表达随着PMA诱导HL-60分化为巨噬细胞的分化水平提高,表达量逐渐上调,指示miR-155在巨噬细胞分化发育中具有调控作用。
3 讨论
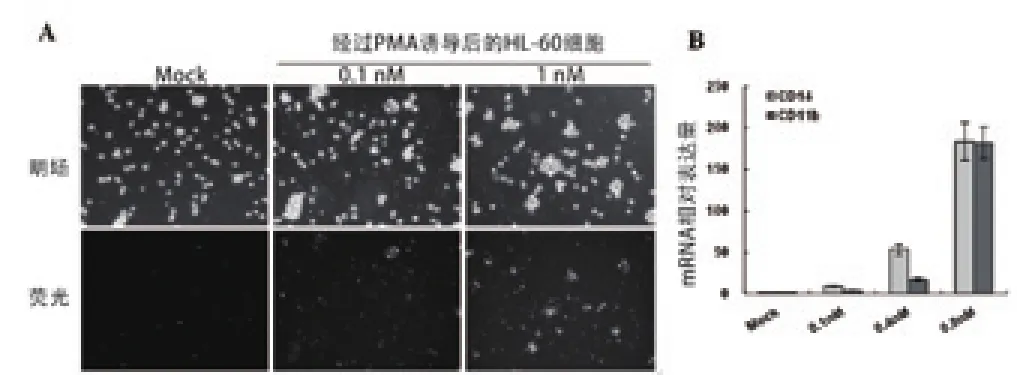
图1 PMA诱导HL-60细胞终末分化水平检测
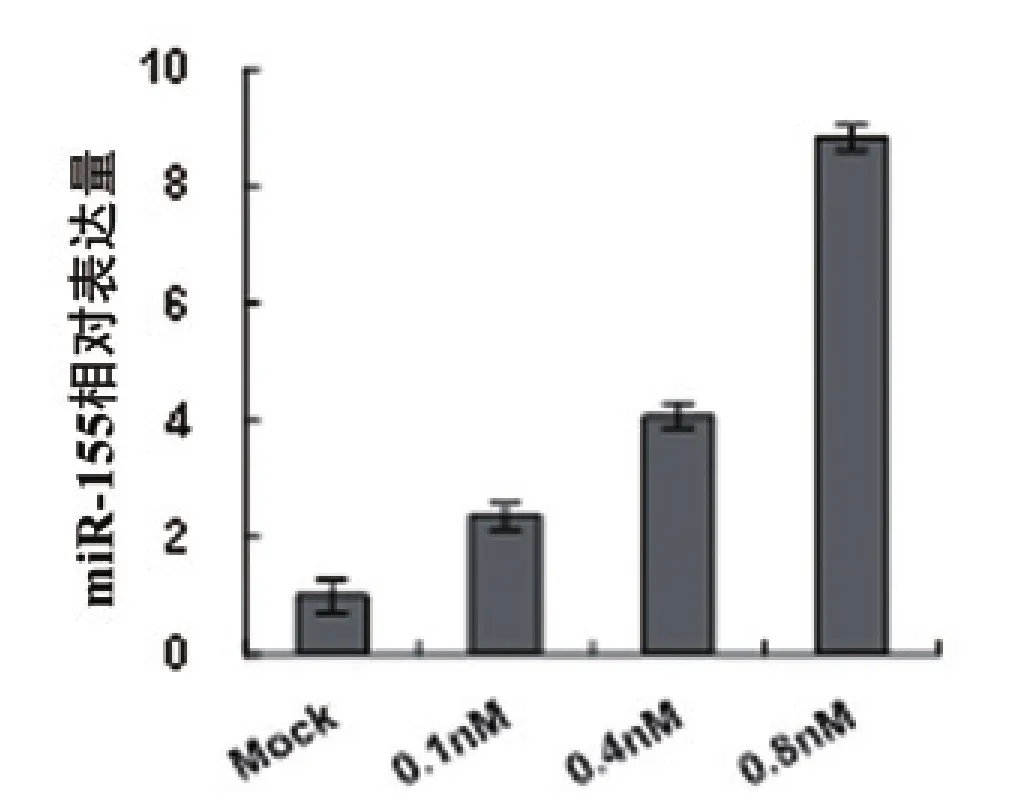
图2 miR-155表达在巨噬细胞分化发育过程中上调
鉴于我们实验小组在前期的研究成果,证实了小鼠肝脏特异性表达的miR-122能调节肝脏细胞在肝脏发育过程中增殖和终末分化的平衡,使得肝脏组织的发育顺利进行[5]。众所周知,miR-122是肝脏中表达量最高的miRNA,占了肝脏中miRNA总量的70%,而且组织特异性极高[6],在其它组织中基本不表达。过往对于miR-122的研究主要集中在其对于肝炎和肝癌的发生发展中的调控作用[7]。我们的研究首次揭示了miR-122在肝脏细胞的分化和肝脏的发育过程中发挥极其重要的调控作用,而组织特异性miRNA在组织的发育过程中的调控作用的研究已逐渐成为miRNA的研究热点[8]。因此,进一步猜想,是否在小鼠的其它的组织中也存在着像miR-122这样对于组织的发育具有重要调控作用的组织特异性miRNA。我们将从小鼠组织特异性miRNA开始入手。在本研究中,我们惊喜地在起源于中胚层的造血体系中证明,组织特异性miR-155的表达量随着巨噬细胞的分化程度表达量逐渐上调,暗示其在巨噬细胞终末分化过程中发挥重要调控作用。以往的研究已有证明CUX 1在巨噬细胞系的发育过程中发挥着重要的调控作用,它主要是通过抑制髓单核细胞特异性基因gp 91-phox 发挥功能的,该基因只在终末分化的髓单核细胞中表达,CUX 1通过DNA结合的方式对gp 91-phox的抑制作用的下调是诱导巨噬细胞发育的必需步骤[9-10]。因此,我们大胆提出假设:组织特异性miR-155是否通过靶向转录抑制因子CUX 1 调控小鼠造血体系细胞命运决定,该调控机制是否为组织特异性miRNA参与细胞终末分化的通用机制?在后续的研究中,我们将进一步探讨miR-155调控巨噬细胞终末分化的分子机制,并集中筛选miR-155的靶向基因及其调控机制,探索组织特异性miRNA在调控组织细胞命运决定和组织分化发育的通用机制。
参考文献
[1] 郑玉姝,赵朴,刘兴友. 特异性miRNA调节机理研究进展[J].中国生物工程杂志,2008,28(2):106-109.
[2] 俞巧,刘振华,刘俊文. 特异性microRNAs在心血管系统中的功能研究进展[J]. 现代生物医学进展,2010,10(3):588-589.
[3] Zhao Y, Samal E, Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature 2005,436 (7048):214-220.
[4] Hui X, Jie-hua H, Zhen-dong X et al. Liver-enriched transcription factors regulate microRNA-122 that targets CUTL1 during liver development[J]. Hepatology.,2010,52(4):1431-1442.
[5] Martinez Nj Fau. Gregory RI. MicroRNA gene regulatory pathways in the establishment and maintenance of ESC identity[J]. Cell Stem Cell,2010,7(1)31-35.
[6] Landgraf P, Rusu M, Sheridan R et al. A mammalian microRNA expression atlas based on small RNA library sequencing[J]. Cell,2007,129(7):1401-1414.
[7] 魏来. 丙型肝炎研究进展[J]. 中国继续医学教育,2010,2(3):9-17.
[8] Winter J, Jung S, Keller S, Gregory RI, Diederichs S. Many roads to maturity: microRNA biogenesis pathways and their regulation[J]. Nat Cell Biol,2009,11(3):228-234.
[9] Hulea L, Nepveu A. CUX1 transcription factors: from biochemical activities and cell-based assays to mouse models and human diseases[J]. Gene,2012,497(1):18-26.
[10] Liu KC, Lin BS, Zhao M et al . Cutl1: a potential target for cancer therapy[J]. Cell Signal,2013,25(1):349-354.
作者单位:510120中山大学孙逸仙纪念医院医学研究中心
广东省自然科学基金项目:2014A030313175
The Significance of Tissue Specific miRNA in Mice of Hematopoietic System Cells Terminal Differentiation Expression
HE Jiehua LIAO Jianyou WU Jue DENG Weixi Sun Yat-Sen Memorial Hospital Medical Research Center of Sun Yat-Sen University, Guangzhou 510120, China
[Abstract]Objective To identify the specific miRNA during the development of hematopoietic system, and explore its molecular mechanism. Methods Induction of HL-60 differentiating into macrophage cells with PMA, detection of the phagocytosis with cayman phagocytosis assay kit, expression of miR-155, CD 11 b and CD 14 mRNA were tested by real-time PCR. Results Establish in the induction macrophage differentiation model of HL-60 by PMA successfully, and found that expression of miR-155 increased gradually during differentia. Conclusion Hematopoietic system specific miR-155 regulates macrophage terminal differentiation. This observation indicates an universal regulatory mechanism that different tissue-specific miRNAs are employed to control different tissues development.
[Key words]Hematopoietic system specific miRNA, Macrophage cells, Terminal differentiation
基金项目:国家自然科学基金项目:C060604
doi:10.3969/j.issn.1674-9308.2015.23.014
【文章编号】1674-9308(2015)23-0019-02
【文献标识码】B
【中图分类号】R329.2+3

