大脑中动脉粥样硬化的狭窄度与卒中机制
—— 一项高分辨磁共振研究
虞雁南,许玉园,李明利,高山,冯逢,徐蔚海
颅内动脉粥样硬化(intracranial atherosclerotic disease,ICAD)是亚洲人群卒中的首要病因[1]。在我国,ICAD占缺血性卒中病因分型的33%~50%[2],且ICAD与卒中的复发相关[3-4]。大脑中动脉(middle cerebral artery,MCA)粥样硬化引起的卒中机制复杂,目前认为有斑块堵塞穿支口,栓子脱落引起动脉-动脉栓塞,栓子脱落、栓子清除障碍和血流动力学紊乱等因素引起分水岭梗死。高分辨磁共振(high-resolution MRI,HRMRI)技术的出现,研究者能够观察活体颅内动脉管腔、管壁、斑块形态及斑块内成分,可以进一步明确ICAD与卒中的病理生理过程。
低分子肝素治疗急性卒中试验(trial of ORG 10 172 in acute stroke treatment,TOAST)和中国缺血性卒中亚型(Chinese Ischemic Stroke Subclassification,CISS)分型中将ICAD定义为狭窄率≥50%或有易损性斑块的动脉。研究表明HRMRI可用于探索潜在的卒中病因[5],即使磁共振血管成像中MCA无狭窄,HRMRI中仍可观察到斑块存在;轻度狭窄(<50%)的MCA中可观察到不稳定斑块[6-7]。本课题组的另一项研究比较了症状性MCA狭窄患者与非症状性MCA狭窄患者,尽管两组具有相近的狭窄率,但有不同的管壁面积和重塑率[8]。以上证据表明,正常或轻度狭窄的MCA也可能成为卒中的病因之一,但是目前尚缺乏相关研究数据。
本研究旨在利用HRMRI探索不同狭窄率的MCA斑块特征及其可能的卒中机制。本研究假设:①轻度狭窄和重度狭窄组患者卒中类型比例不同,且轻度狭窄患者亦可引起栓塞性梗死;②栓塞性梗死与斑块形态学指标相关。
1 对象与方法
1.1 患者收集 本研究连续收集2009-2014年于北京协和医院就诊的缺血性卒中患者。纳入标准:①发病时间2周内;②卒中发生于MCA供血区;③HRMRI上MCA M1段存在斑块。排除标准:①心源性栓塞、颅外动脉粥样硬化性及其他病因的卒中;②影像质量欠佳,不能测量斑块。
1.2 磁共振成像方案 所有2009-2013年7月的患者均进行了常规T2加权、弥散加权、三维时间飞跃法磁共振血管成像(three dimensional time of flight magnetic resonance angiography,3D-TOF-MRA)和双侧MCA的高分辨磁共振扫描。高分辨磁共振扫描包括垂直于MCA M1段的横断面T2和T1扫描,层厚2 mm,层间距0~0.2 mm。分辨率为0.25 mm×0.25 mm(T2WI)及0.3 mm×0.3 mm(T1WI)。TR/TE=3000/40 ms(T2WI),600/12 ms(T1WI)。
1.3 影像处理 影像后处理与测量使用OsirixMD软件(Pixmeo公司,瑞士)。读片者采用盲法,分别对梗死类型和斑块形态学进行测量。根据弥散加权成像(diffusion weighted imaging,DWI)将梗死类型分为穿支、皮层、分水岭和混合型梗死[9],并采用半自动法测量DWI上高信号的梗死体积。梗死所属血管分布区参考已发表的模板[10]。穿支梗死定义为皮层下穿支分布区域的梗死,皮层梗死定义为MCA分布区内的累及皮层的梗死,分水岭梗死包括放射冠及半卵圆区的内分水岭梗死和累及皮层的前后分水岭梗死,混合型梗死定义为前3种梗死中至少任意两种的混合。在后续分析中,将皮层、分水岭和混合型梗死归为栓塞性梗死[11],与穿支梗死相比较。
在矢状位HRMRI上,测量病灶侧MCA M1段最狭窄层面的管腔面积、管壁面积,以病灶侧或对侧正常血管层面作为参照点,测量参照管腔面积和参照管壁面积(若参照点在同侧,则以狭窄点前后的正常血管层面平均值作为参照面积)。计算狭窄率=(1-管腔面积/参照管腔面积)×100%,重塑率=管壁面积/参照管壁面积×100%。斑块形态学指标包括斑块位置、长度、厚度、信号和斑块连续性。根据矢状位HRMRI,MCA斑块位置可根据斑块最厚点的方向,将之分为上、下、前、后壁斑块[12]。斑块厚度为MCA最狭窄层面的斑块厚度,斑块长度根据斑块累及的HRMRI层数乘以层厚计算,目测估计管腔内斑块信号均匀或混合[6]。斑块表面连续性定义为斑块与管腔交界面的完整性,若连续性被破坏,则交界面处可见溃疡凹向斑块,且溃疡内为管腔信号[8,13](图1)。
根据狭窄率,将狭窄率>50%的患者归入重度狭窄组,将狭窄率≤50%的患者归入轻度狭窄组。
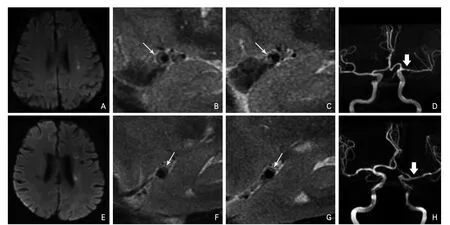
图1 斑块表面连续性示例
1.4 统计学分析 二分类变量采用Fisher精确检验或χ2检验,两组间连续变量比较采用t检验,非正态分布变量采用Mann-Whitney U检验,连续变量间相关性采用相关性分析。单因素分析中P<0.1的因子纳入二元Logistic回归。P<0.05表示差异存在显著性。
2 结果
研究共纳入102例患者,其中重度狭窄组39例(38.2%),轻度狭窄组63例(61.8%)。两组患者基线资料及影像学指标统计比较见表1。
重度狭窄组患者中,穿支梗死14例(35.9%),皮层梗死9例(23.1%),分水岭梗死4例(10.3%),混合型梗死12例(30.8%);轻度狭窄组患者中,穿支梗死44例(69.8%),皮层梗死8例(12.7%),分水岭梗死3例(5.8%),混合型梗死8例(12.7%),两组构成类型比较,差异有显著性(P=0.014)(图2)。
与轻度狭窄组患者相比,重度狭窄组患者斑块更长(P<0.001)、更厚(P<0.001)、斑块信号混合(P<0.001)、梗死体积更大(P=0.028)。两组间斑块分布比较差异无显著性。将斑块长度、厚度、信号和表面连续性作为因子纳入二元Logistic回归,采用前进法,结果表明斑块厚度(P<0.001,OR87.792,95%CI13.120~587.453)和斑块混合信号(P<0.007,OR7.358,95%CI1.725~31.382)是MCA狭窄率>50%的独立预测因子。
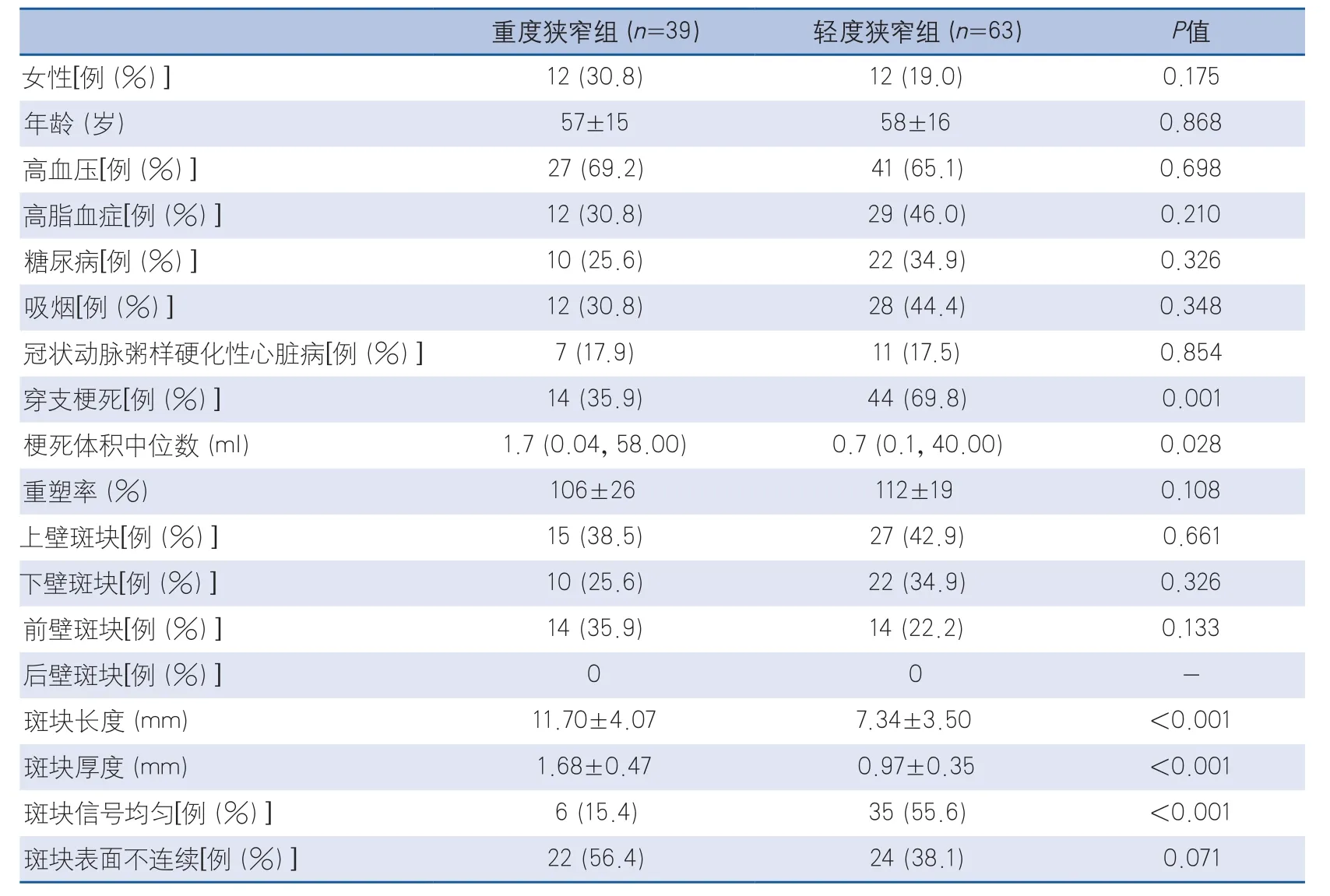
表1 重度狭窄组与轻度狭窄组基线数据及影像学指标统计比较
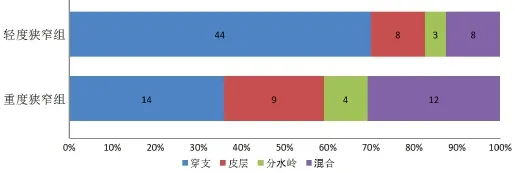
图2 重度狭窄组和轻度狭窄组各梗死类型的分布
重度狭窄组中,梗死类型与各项斑块形态学指标无相关性,斑块表面不连续的患者梗死体积大(P=0.004),但梗死类型、斑块信号与梗死体积无关(P>0.05)。轻度狭窄组中,栓塞性梗死患者斑块表面不连续更常见(P=0.002),斑块厚度更大(P=0.032),但栓塞性梗死与斑块信号、斑块长度及分布无关;梗死体积与斑块表面连续性无关。二元Logistic回归表明,斑块表面不连续是轻度狭窄组发生栓塞性梗死的独立预测因子(P=0.003,OR5.778,95%CI1.788~18.672)。
3 讨论
本研究是首个比较不同MCA狭窄度与斑块形态学相关性的HRMRI研究。本研究发现狭窄度与斑块信号、长度和厚度均有相关性,斑块信号与厚度是狭窄度的独立预测因子。轻度狭窄组和重度狭窄组患者卒中类型比例不同。轻度狭窄组内患者亦可引起栓塞性梗死,而且本研究首次发现,斑块不连续是轻度狭窄组栓塞性梗死的独立危险因素。
本研究发现,重度狭窄和轻度狭窄相比,有更多混合信号斑块、更大的斑块长度和厚度,且斑块信号和厚度是狭窄度的独立预测因子。既往颈内动脉和冠状动脉的研究表明,易损性斑块的特点包括斑块内钙化、纤维成分、脂质、斑块内出血和斑块血管新生[14-15]。在MRI T2加权成像上,由于纤维帽表现为等-高信号、斑块内钙化和脂质表现为低信号,因此易损性斑块通常表现为混合信号,斑块内出血和斑块血管新生分别在T1加权成像和T1增强上表现为高信号[7,16]。对于MCA斑块成分和影像学表现的关系仍不清楚,目前仅有有限的病理研究佐证了MCA斑块在MRI中也有类似的信号表现[17]。因此混合信号斑块可能与进展的粥样硬化性疾病及易损性斑块相关。本研究中重度狭窄组比轻度狭窄组有更多混合信号斑块、更大的斑块长度和厚度,均提示重度狭窄组的粥样硬化性疾病严重程度更高。
本研究发现轻度狭窄组有69.8%发生穿支梗死,重度狭窄组有35.9%发生穿支梗死,两组差异有显著性。重度狭窄与轻度狭窄组的穿支梗死比例与此前报道的亚洲人群研究相似[11]。既往欧美人群中,重度MCA狭窄中有25%为穿支梗死[9],比例较亚洲人群稍低,但与本研究数据比较差异无显著性(P=0.179)。重度狭窄组发生栓塞性梗死的概率较穿支梗死更大,因MCA斑块总体粥样硬化程度更重,斑块易损性更高、更易破裂[18],且狭窄对血流动力学影响更大,因而会有更多的动脉-动脉栓塞、分水岭梗死和混合机制梗死[14]。轻度狭窄组穿支梗死比例显著高于栓塞性梗死,本研究在部分患者中可观察到斑块堵塞穿支口,但更多的患者的病理生理机制尚不清楚,可能是MCA斑块或栓子堵塞穿支口和穿支动脉疾病混合作用的结果。椎基底动脉的研究也显示,部分无狭窄的斑块可造成穿支口的堵塞[19],因此可能部分归因于小动脉疾病的卒中患者是由较轻的ICAD引起。未来还需更高分辨率的影像学技术,以提供穿支及穿支口病变的信息。
本研究还发现,狭窄率≤50%的斑块表面不连续是栓塞性梗死的独立危险因素,狭窄率>50%的斑块形态学与梗死类型无关,但斑块表面不连续与较大梗死体积相关。既往MRI研究中可观察到颈动脉斑块不连续,且该现象与斑块破裂的病理结果高度一致[14],与缺血事件显著相关[13]。既往研究中,本课题组观察到MCA也存在斑块表面不连续,可能与斑块破裂相关[8](图1)。本研究中,轻度狭窄组仍有30.2%的患者发生栓塞性梗死,并且斑块表面不连续是栓塞性梗死的独立危险因素,提示其卒中机制可能是斑块破裂引起的动脉-动脉栓塞,因此一部分栓塞性梗死可能来源于轻度狭窄的MCA粥样硬化性疾病。既往研究也发现轻度粥样硬化性疾病可导致动脉-动脉栓塞,斑块破裂、斑块内出血可见于37.5%的正常或轻度狭窄的患侧颈动脉[5,20],Hyafil等[21]观察到30%狭窄度的颈内动脉斑块破裂、血栓形成和局部斑块炎症细胞浸润。本研究是首个发现MCA斑块不连续性与栓塞性病灶相关性的研究,未来研究中需进一步探索HRMRI上斑块不连续与斑块破裂的病理学表现的相关性,并且进行微栓子监测等手段明确其病理生理过程。
重度狭窄组中有35.9%为穿支梗死,且与斑块分布梗死类型无关,这与本课题组之前的研究结果有所不同[12]。可能的原因包括:①重度狭窄组的MCA斑块粥样硬化程度重,各方向的斑块均可逐渐累及穿支口;②栓子脱落堵塞穿支口[22];③穿支动脉疾病,导致穿支远端区域梗死。斑块表面不连续在轻度狭窄组中与栓塞性梗死相关,但在重度狭窄组中与栓塞性梗死无关,可能的原因有:①其他机制参与,如管腔严重狭窄使血流受限;②重度狭窄组患者ICAD累及广泛,可能栓子起源于M2段或更远端的斑块破裂;③目前HRMRI分辨率还不能发现所有的斑块破裂。
本研究存在一些局限性,包括单中心、回顾性的研究方法。本研究中已排除颅外动脉粥样硬化性斑块,但尚不能排除由颅内段颈内动脉斑块引起的梗死,因此本研究可能高估MCA斑块相关的栓塞性梗死。目前3D T1技术可以观察颅内段颈内动脉和完整的Willis环血管,因此在未来研究中,有必要使用3D T1技术排除颅内段颈内动脉斑块后再进行MCA斑块分析[15]。本研究中提出的斑块信号和表面连续性不能与病理结果相联系,因此仅限于影像学发现,病理意义尚不明确。在未来的研究中,应进一步探索影像学与病理学之间的联系。此外,本研究仅对穿支与栓塞性梗死进行分析。近期研究表明,分水岭梗死患者在随访期卒中及心血管病事件的复发的风险显著升高[23],未来进一步探索分水岭梗死与HRMRI影像学指标将有助于卒中的二级预防。
本研究的结论包括MCA狭窄率>50%和≤50%的患者具有不同的卒中分型比例和斑块形态学,斑块信号与厚度是狭窄度的独立预测因子。狭窄率≤50%的斑块表面不连续是栓塞性梗死独立预测因子,提示轻度狭窄MCA斑块破裂可能是引起栓塞性病灶的机制;狭窄率>50%的斑块形态学与梗死类型无关,斑块表面不连续与梗死体积相关。本研究的结论可为ICAD引起卒中的机制和二级预防决策提供更多证据。
1 Wong LK. Global burden of intracranial atherosclerosis[J]. Int J Stroke,2006,1:158-159.
2 Gorelick PB,Wong KS,Bae HJ,et al. Large artery intracranial occlusive disease:a large worldwide burden but a relatively neglected frontier[J]. Stroke,2008,39:2396-2399.
3 Arenillas JF,Molina CA,Montaner J,et al.Progression and clinical recurrence of symptomatic middle cerebral artery stenosis:a long-term followup transcranial Doppler ultrasound study[J]. Stroke,2001,32:2898-2904.
4 Kern R,Steinke W,Daffertshofer M,et al. Stroke recurrences in patients with symptomaticvsasymptomatic middle cerebral artery disease[J].Neurology,2005,65:859-864.
5 Osborn EA,Jaffer FA. Imaging atherosclerosis and risk of plaque rupture[J]. Curr Atheroscler Rep,2013,15:359.
6 Li ML,Xu WH,Song L,et al. Atherosclerosis of middle cerebral artery:evaluation with highresolution MR imaging at 3T[J]. Atherosclerosis,2009,204:447-452.
7 Kim JM,Jung KH,Sohn CH,et al. Middle cerebral artery plaque and prediction of the infarction pattern[J]. Arch Neurol,2012,69:1470-1475.
8 Xu WH,Li ML,Gao S,et al. In vivo high-resolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J].Atherosclerosis,2010,212:507-511.
9 López-Cancio E,Matheus MG,Romano JG,et al. Infarct patterns,collaterals and likely causative mechanisms of stroke in symptomatic intracranial atherosclerosis[J]. Cerebrovasc Dis,2014,37:417-422.
10 Tatu L,Moulin T,Vuillier F,et al. Arterial territories of the human brain[J]. Front Neurol Neurosci,2012,30:99-110.
11 Lee DK,Kim JS,Kwon SU,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusion-weighted imaging study[J]. Stroke,2005,36:2583-2588.
12 Xu WH,Li ML,Gao S,et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J]. Stroke,2011,42:2957-2959.
13 Yuan C,Zhang SX,Polissar NL,et al. Identi fi cation of fibrous cap rupture with magnetic resonance imaging is highly associated with recent transient ischemic attack or stroke[J]. Circulation,2002,105:181-185.
14 Saam T,Hatsukami TS,Takaya N,et al. The vulnerable,or high-risk,atherosclerotic plaque:noninvasive MR imaging for characterization and assessment[J]. Radiology,2007,244:64-77.
15 Dieleman N,van der Kolk AG,Zwanenburg JJ,et al. Imaging intracranial vessel wall pathology with magnetic resonance imaging:current prospects and future directions[J]. Circulation,2014,130:192-201.
16 Xu WH,Li ML,Gao S,et al. Middle cerebral artery intraplaque hemorrhage:prevalence and clinical relevance[J]. Ann Neurol,2012,71:195-198.
17 Turan TN,Rumboldt Z,Granholm AC,et al.Intracranial atherosclerosis:correlation between in-vivo 3T high resolution MRI and pathology[J].Atherosclerosis,2014,237:460-463.
18 Wong KS,Gao S,Chan YL,et al. Mechanisms of acute cerebral infarctions in patients with middle cerebral artery stenosis:a diffusion-weighted imaging and microemboli monitoring study[J]. Annneurol,2002,52:74-81.
19 Chung JW,Kim BJ,Choi BS,et al. High-resolution magnetic resonance imaging reveals hidden etiologies of symptomatic vertebral arterial lesions[J]. J Stroke Cerebrovas Dis,2014,23:293-302.
20 Freilinger TM,Schindler A,Schmidt C,et al. Prevalence of nonstenosing,complicated atherosclerotic plaques in cryptogenic stroke[J]. JACC Cardiovasc Imaging,2012,5:397-405.
21 Hyafil F,Klein I,Desilles JP,et al. Rupture of nonstenotic carotid plaque as a cause of ischemic stroke evidenced by multimodality imaging[J].Circulation,2014,129:130-131.
22 Fisher CM. Capsular infarcts:the underlying vascular lesions[J]. Arch Neurol,1979,36:65-73.
23 Psychogios K,Stathopoulos P,Takis K,et al. The pathophysiological mechanism is an independent predictor of long-term outcome in stroke patients with large vessel atherosclerosis[J]. J Stroke Cerebrovasc Dis:the Official Journal of National Stroke Association,2015,24:2580-2587.

