大豆饲料产品中主要抗营养因子含量的检测与分析
周天骄 谯仕彦 马 曦 贺平丽(中国农业大学动物科技学院,动物营养学国家重点实验室,北京100193)
大豆饲料产品中主要抗营养因子含量的检测与分析
周天骄 谯仕彦 马 曦 贺平丽∗
(中国农业大学动物科技学院,动物营养学国家重点实验室,北京100193)
摘 要:本试验旨在应用间接竞争酶联免疫吸附测定(ELISA)法以及色谱法测定不同加工工艺的大豆饲料产品中主要大豆抗营养因子大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子以及大豆中蔗糖、棉子糖和水苏糖的含量。采用ELISA试剂盒对国内257份大豆制品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量进行检测与分析;利用离子色谱建立了大豆产品中蔗糖、棉子糖和水苏糖的灵敏、准确的同步测定法,并对国内92份大豆制品中寡糖含量进行检测与分析。结果表明:发酵豆粕、膨化大豆、大豆浓缩蛋白和大豆分离蛋白中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量相对较低;本试验所建立的离子色谱同步测定大豆中蔗糖、棉子糖和水苏糖的方法具有灵敏度和准确性高、重现性好的优点,适用于大豆寡糖的测定;通过对实际样品的检测和分析,发现发酵豆粕和大豆分离蛋白中3种大豆寡糖含量均相对较低。本试验所得到不同加工工艺的大豆产品中主要抗营养因子含量的相关数据将为大豆在畜禽饲料中的高效利用提供很好的技术支撑。
关键词:ELISA;离子色谱;抗营养因子;大豆产品
大豆因其富含蛋白质且氨基酸平衡而成为人类和动物优质的植物蛋白质源。随着畜禽养殖业和饲料业的快速发展,豆粕作为主要植物性蛋白质原料,其需求量逐年递增。然而,豆粕中含有多种抗营养因子,如蛋白酶抑制因子、大豆球蛋白、β-伴大豆球蛋白以及寡糖等,这在一定程度上限制了其在饲料中的应用,尤其是幼畜饲料。近几十年来,科研工作者致力于研究通过不同的加工工艺来消除或降低大豆中的抗营养因子,如通过加热法钝化蛋白酶抑制因子、微生物发酵以及膨化法降低大豆蛋白致敏性等,以期大豆及大豆制品能够在食品和饲料领域得到更广泛的应用。但由于技术水平、工艺参数等的不同,造成大豆产品质量良莠不齐,之前由于检测技术的限制,很难直观准确地评价其钝化消除效果,因此如何快速准确测定大豆中的各种抗营养因子水平已成为了大豆制品质量评定以及大豆制品加工工艺监控等工作中必须解决的问题。
大豆中胰蛋白酶抑制因子与脲酶有相似的含量和活性,可通过检测脲酶活性间接反映胰蛋白酶抑制因子活性[1],但该法灵敏度低且对于过度加热豆粕测定准确度很低,此外还有酶化学检测法、免疫化学测定法等,其中酶化学法灵敏度低且对加热过度的豆粕测定结果变异较大,而通过酶联免疫吸附测定(ELISA)法直接测定胰蛋白酶抑制因子的灵敏度、准确性和重复性均较好[2]。大豆球蛋白、β-伴大豆球蛋白的检测方法包括电泳法、色谱法、质谱法、液质联用、免疫化学法、实时PCR(real⁃time PCR)以及多重PCR(multiplex⁃PCR)[3-6]等,其中电泳法多用于定性和半定量,不能用于准确定量大豆球蛋白及β-伴大豆球蛋白含量;虽然色谱法、质谱法、液质联用的灵敏度和准确性高,但需要较为昂贵的仪器和复杂的操作和分析过程,无法实现现场检测;基于PCR技术的检测方法虽简便,特异性和灵敏度高,但由于结果可能出现交叉污染造成假阳性等限制了该方法的广泛应用,而基于免疫学所建立的ELASA法具有特异性强和灵敏度高等优点,同时还可以实现现场检测,推广性强。早期大豆寡糖的分析方法一般采用纸色谱法、薄层色谱法及柱色谱法,能够在糖类分离的基础上对样品中的各种糖类逐一定量分析,但存在分离效力有限且非专一性响应的问题,随着现代分析技术的进步,先进的仪器分析方法已经应用于糖类的检测和分析中,如气相色谱法(GC)、高效液相色谱法(HPLC)和毛细管电泳法(CE)、质谱(MS)[7-8]等,这些方法分离能力高,且灵敏、准确。近年来,离子色谱以其特异的阴离子交换分离技术和灵敏的脉冲安培检测技术,在糖的检测领域得到越来越广泛的应用,逐渐取代了其他的糖检测技术。此方法简单,不需衍生和复杂的样品前处理就能分析几乎所有的单糖和大部分的寡糖及低聚糖,这不仅节约了大量的时间和成本,而且避免了一些有毒的衍生试剂的使用,减少了环境污染[9-10]。脉冲安培检测器具有非常高的灵敏度,低至pmol级的糖类也可得到很好的检测。随着离子色谱分析技术的发展及其在寡糖和多糖方面出色的分离能力,使其能够在对寡糖的研究过程起到更重要的作用。
本试验建立了检测大豆产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量的灵敏、准确的间接竞争ELISA方法,同时建立了蔗糖、棉子糖和水苏糖的灵敏、准确、重现性好的离子色谱检测方法,利用上述建立的方法分析测定了257份不同加工工艺的大豆产品中抗营养因子的含量,为大豆及大豆加工产品在畜禽饲料中的高效利用提供技术保障。
1 材料与方法
1.1 试验材料
1.1.1 试剂
大豆球蛋白定量检测试剂盒、β-伴大豆球蛋白定量检测试剂盒和胰蛋白酶抑制因子定量检测试剂盒均由北京龙科方舟生物工程技术有限公司提供。
D-蔗糖(≥99.5%,Sigma公司),D-棉子糖(≥98%,Sigma⁃Aldrich公司),D-水苏糖(≥98%,Sigma公司),NaOH溶液(50%,W/W,Fluka公司),其他试剂为分析纯试剂。所有用水均为电阻率≥18.2 MΩ·cm的超纯水,0.22 μm微孔尼龙膜(天津富集司)。
1.1.2 主要仪器
ICS-3000型离子色谱仪(美国Dionex公司),Chromeleon 6.80色谱工作站,AS自动进样器,Milli⁃QAdvantageA10超纯水机(美国Millipore公司),离心机(德国Eppendorf公司),JB-12多磁力搅拌器(荣华仪器制造厂),台式高速冷冻离心机(美国Thermo公司),酶标仪(美国BIO⁃RAD公司),隔水式培养箱(常州恒德仪器有限公司)。
1.1.3 标准溶液和淋洗液的配制
标准溶液的配制:准确称取蔗糖、棉子糖和水苏糖标准品各25.00 mg溶于50 mL超纯水中,并用超纯水将该母液稀释到5 μg/mL,摇匀,配制成混合标准工作溶液,备用。
NaOH淋洗液的配制(250 mmol/L):在1 L容量瓶中加入987 mL超纯水,再移入13.0 mL 50%NaOH溶液,摇匀备用。
1.2 样品采集
257份大豆样品,包括去皮豆粕、发酵豆粕、膨化大豆、大豆浓缩蛋白、大豆分离蛋白等不同加工工艺的大豆产品,采集自全国各地的饲料生产企业。
1.3 间接竞争ELISA法检测大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子
1.3.1 大豆球蛋白、β-伴大豆球蛋白检测的样品前处理
将待测样品粉碎后,收集能够通过孔径小于0.25 mm标准筛的颗粒,称取0.3 g样品于50 mL离心管中,加入30 mL 1×样品提取工作液,于25℃振荡提取16 h,静置2 min。取上层液体于4 000 r/min离心5 min,取上清液用1×样品稀释工作液稀释70倍(稀释方法:先取100 μL上清液加到装有600 μL 1×样品稀释工作液的容器中混匀,然后再取混合液100 μL加到装有900 μL 1×样品稀释工作液的容器中混匀待用)。
1.3.2 胰蛋白酶抑制因子检测的样品前处理
将待测样品粉碎后,收集能够通过孔径小于0.25 mm标准筛的颗粒,称取0.1 g样品加入到已配好的30 mL 1×样品提取工作液中,于25℃振荡提取16 h,静置2 min。取上层液体于4 000 r/min离心5 min,取上清液用样品稀释液稀释到适合的工作浓度(豆粕、发酵豆粕、膨化大豆等样品建议稀释比例为1∶300。稀释方法:取30 μL上清液加到装有270 μL样品稀释液的容器中混匀,量取30 μL混合液加到装有870 μL样品稀释液的容器中混匀待用)。
1.3.3 蛋白定量检测及结果判定
分别以每种大豆抗原蛋白或胰蛋白酶抑制因子的标准工作液浓度(μg/mL)的对数为横坐标,以百分吸光率为纵坐标,绘制标准工作曲线,用标准曲线对试样进行定量,其中百分吸光率等于校准品或样品的吸光度值的平均值(双孔)除以第1个校准品(0标准)的吸光度值,再乘以100。
1.4 离子色谱法测定大豆及大豆制品中的3种寡糖
1.4.1 大豆制品寡糖的提取
称取粉碎后待测样品0.5 g左右,先加入20 mL无水乙醇,振荡混匀,接着加入80%甲醇30 mL,磁力搅拌1 h,提取液用8 000 r/min离心5 min,取1 mL上清定容于50 mL容量瓶中,0.22 μm尼龙滤膜过滤,滤液用于离子色谱测定。
1.4.2 色谱条件
分析柱:CarboPac PA10(250 mm×4 mm);保护柱:CarboPac PA10(50 mm×4 mm);淋洗液条件:梯度洗脱0~15 min,23 mmol/L NaOH;15.1~25.0 min,23~150 mmol/L NaOH;25.1~30.0 min,150 mmol/L NaOH;30.1~35.0 min,23 mmol/L NaOH;流速1.0 mL/min;检测器:ED 3000脉冲安培检测,Au工作电极,Ag/AgCl参比电极模式,四电位波形检测;进样量:25 μL;进样方式:自动进样;柱温:30℃。
1.4.3 结果计算
分别以每种寡糖的标准工作液浓度(μg/mL)为横坐标,以色谱峰面积为纵坐标,绘制标准工作曲线,按外标法用标准曲线对试样进行定量。
1.5 数据处理与分析
试验数据采用SPSS 18.0软件进行统计分析,试验结果用平均值±标准差表示。
2 结果与分析
2.1 大豆加工产品中大豆抗原蛋白以及胰蛋白酶抑制因子含量的检测与分析
2.1.1 方法校正曲线绘制及回收率测定
按照试剂盒测定程序测定标准曲线,得到β-伴大豆球蛋白定量检测试剂盒浓度在0.4~28 μg/mL内,线性关系良好(R2≥0.99);大豆球蛋白定量检测试剂盒浓度在0.2~25.6 μg/mL内,线性关系良好(R2≥0.98);胰蛋白酶抑制因子定量检测试剂盒浓度在0.015~1.220 μg/mL内,线性关系良好(R2≥0.99)。同时分别用回收率和相对标准偏差考察了试剂盒的准确性和重复性,所得回收率及相对标准偏差见表1。结果表明,上述3种大豆抗营养因子的平均回收率在86.9%~107.3%之间,相对标准偏差小于7%,该方法满足定性鉴别和定量测定的需要,检测限、准确度和精密度均满足规定要求,所以该方法是用来测定大豆中大豆抗原蛋白以及胰蛋白酶抑制因子含量的可靠方法。

表1 3种大豆主要抗营养因子在大豆样品中的回收率及相对标准偏差Table 1 Recoveries and RSD of three main soybean antinutritional factors from soybean samples(n=6)
2.1.2 大豆加工产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量的测定结果
257份样品可分为7类(去皮豆粕、带皮豆粕、发酵豆粕、去皮膨化豆粕、膨化大豆、大豆浓缩蛋白、大豆分离蛋白),表2详细列举了这些大豆产品的产地及3种蛋白类抗营养因子含量的最大值、最小值和平均值。由表2可知,同一种大豆加工产品,不同地区之间大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量的最小值或最大值差异较大,如与黑龙江和山东相比,京津冀和浙江的去皮豆粕中β-伴大豆球蛋白含量的最小值较低。因此,采用平均值表示不同加工工艺的大豆产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子的含量可以较为直观地比较出不同加工工艺对抗原蛋白的钝化效果,虽然变异较大,但仍具有一定的参考价值。图1更直观地展示了不同大豆加工产品中3种蛋白类抗营养因子的含量及钝化降解效果。由图1可知,豆粕经发酵、膨化或浓缩等工艺处理后,3种抗营养因子的含量明显降低,其中发酵豆粕、膨化大豆、大豆浓缩蛋白和大豆分离蛋白中大豆球蛋白、β-伴大豆球蛋白含量均降至53.9 mg/g以下,胰蛋白酶抑制因子含量降低至21.6 mg/g以下,与带皮豆粕相比,这3种抗营养因子含量均至少降低了60%。然而,去皮的膨化豆粕中抗营养因子含量没有明显下降,其去除抗营养因子的效果不明显。
2.2 大豆加工产品中蔗糖、棉子糖和水苏糖含量的检测与分析
2.2.1 标准曲线、线性范围及检出限
分别配制5个不同浓度的3种寡糖的标准溶液,在上述色谱条件下进行测定。分别得到蔗糖、棉子糖和水苏糖的工作曲线的线性范围为0.2~100.0 μg/mL,R2>0.995,检出限在0.02~0.05 μg/mL之间。
2.2.2 方法的准确度和精确度
本试验对样品进行了100和50 mg/g 2个水平的添加浓度,每个浓度设6个平行,所得回收率及相对标准偏差见表3。结果表明,3种寡糖的平均回收率在80%~99%之间,相对标准偏差小于6%,该方法满足定性鉴别和定量测定的需要,检测限、准确度和精密度均满足规定要求,所以该方法是用来测定大豆中寡糖含量的可靠方法。此外,样品的色谱峰见图2,从图2中可以看出,样品中寡糖的分离效果很好。
2.2.3 大豆加工产品中蔗糖、棉子糖和水苏糖含量的测定与分析
92份样品可分为5类(豆粕、发酵豆粕、膨化大豆、大豆浓缩蛋白和大豆分离蛋白),利用本试验所建立的离子色谱方法对上述样品进行检测,所得到的每一类样品中3种大豆寡糖的含量和平均值如表4所示。由表4可知,大豆3种寡糖中蔗糖含量最多,水苏糖含量次之,棉子糖含量最少,同一大豆加工工艺,不同厂家生产的产品中同一寡糖的含量也差异较大。对于不同加工工艺产品,结果表明豆粕经发酵工艺处理后,其中蔗糖和水苏糖的含量均明显下降,比发酵前降低了70%,大豆分离蛋白中3中寡糖的含量也明显降低,但膨化豆粕中3种大豆寡糖含量没有明显下降;大豆浓缩蛋白大豆寡糖含量反而升高,这与前人研究的醇法大豆浓缩蛋白中可溶性低聚糖约占干物质10%的结果相吻合[11]。
3 讨 论
大豆中因含有多种抗营养因子,如大豆球蛋白、β-伴大豆球蛋白、胰蛋白酶抑制因子和寡糖等,这些物质的存在一定程度上影响了大豆产品的质量和营养价值。通过膨化、微生物发酵以及大豆浓缩蛋白等加工工艺可有效降低大豆中抗营养因子含量,但是由于技术水平、工艺参数等的不同,造成大豆产品质量良莠不齐。本试验通过间接竞争ELISA法检测了不同加工工艺的大豆产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量,分析发现同一种大豆加工产品,不同地区之间大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量的差异较大,其原因可能是不同企业生产的大豆产品,即使是同一种加工工艺,但由于具体工艺参数不同,对大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子等抗营养因子的钝化降解效果差异很大。但综合比较,发酵豆粕、膨化大豆、大豆浓缩蛋白和大豆分离蛋白中上述3种抗营养因子含量较低,产生上述结果原因是:1)微生物发酵产生的酶类可降解胰蛋白酶抑制因子和大豆过敏蛋白[12];2)胰蛋白酶抑制因子具有热不稳定性,热加工(蒸汽处理、膨化)可使其失活,膨化过程中的高温高压和机械剪切可以使抗营养因子钝化[13];3)工业上普遍采用醇法大豆浓缩蛋白加工工艺,而大豆过敏蛋白和胰蛋白酶抑制因子等经乙醇浸出后可被去除或失活[14],大豆分离蛋白加工过程中的碱萃取的高pH体系可引起蛋白质聚集体发生解聚,甚至引起蛋白质的肽键断裂,降低大分子蛋白质组分的含量[11]。然而,去皮的膨化豆粕中抗营养因子含量没有明显下降,原因可能是大部分膨化豆粕样品严格意义上属于膨胀豆粕,压力、温度和机械剪切力没有膨化工艺强,因此去除抗营养因子的效果不明显[15]。此外,本试验还分析发现发酵工艺可降低寡糖的含量,其原因可能是微生物发酵过程中需要消耗糖。

表2 大豆加工产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子的含量范围Table 2 The content range of glycinin, β-conglycinin and trypsin inhibitor in soybean products

续表2


图1 大豆加工产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量分析图Fig.1 The analysis graphics of the contents of glycinin,β⁃conglycinin and trypsin inhibitor in soybean products

表3 3种寡糖在大豆样品中的添加回收率及相对标准偏差Table 3 Recoveries and RSD of three kinds of oligosaccharides from soybean samples(n=6)

图2 大豆样品的色谱分离图Fig.2 The chromatograms of soybean sample
4 结 论
①本试验通过间接竞争ELISA法检测了不同加工工艺的大豆产品中大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制因子含量,分析发现发酵豆粕、膨化大豆、大豆浓缩蛋白和大豆分离蛋白中上述3种抗营养因子含量较低。
②本试验建立了一种离子色谱同步测定大豆中蔗糖、棉子糖和水苏糖含量的简便快捷、灵敏度和准确性高、重现性好的方法,适用于大豆寡糖的测定。通过该方法分析比较了不同加工工艺的大豆产品中大豆寡糖含量,发现发酵豆粕和大豆分离蛋白中3种大豆寡糖含量较低,推荐使用发酵以及大豆蛋白分离技术来钝化大豆球蛋白、β-伴大豆球蛋白、胰蛋白酶抑制因子以及大豆中蔗糖、棉子糖和水苏糖。
③本试验所得到不同加工工艺的大豆产品中主要抗营养因子含量的相关数据可为大豆产品在畜禽饲料中的高效利用提供参考。
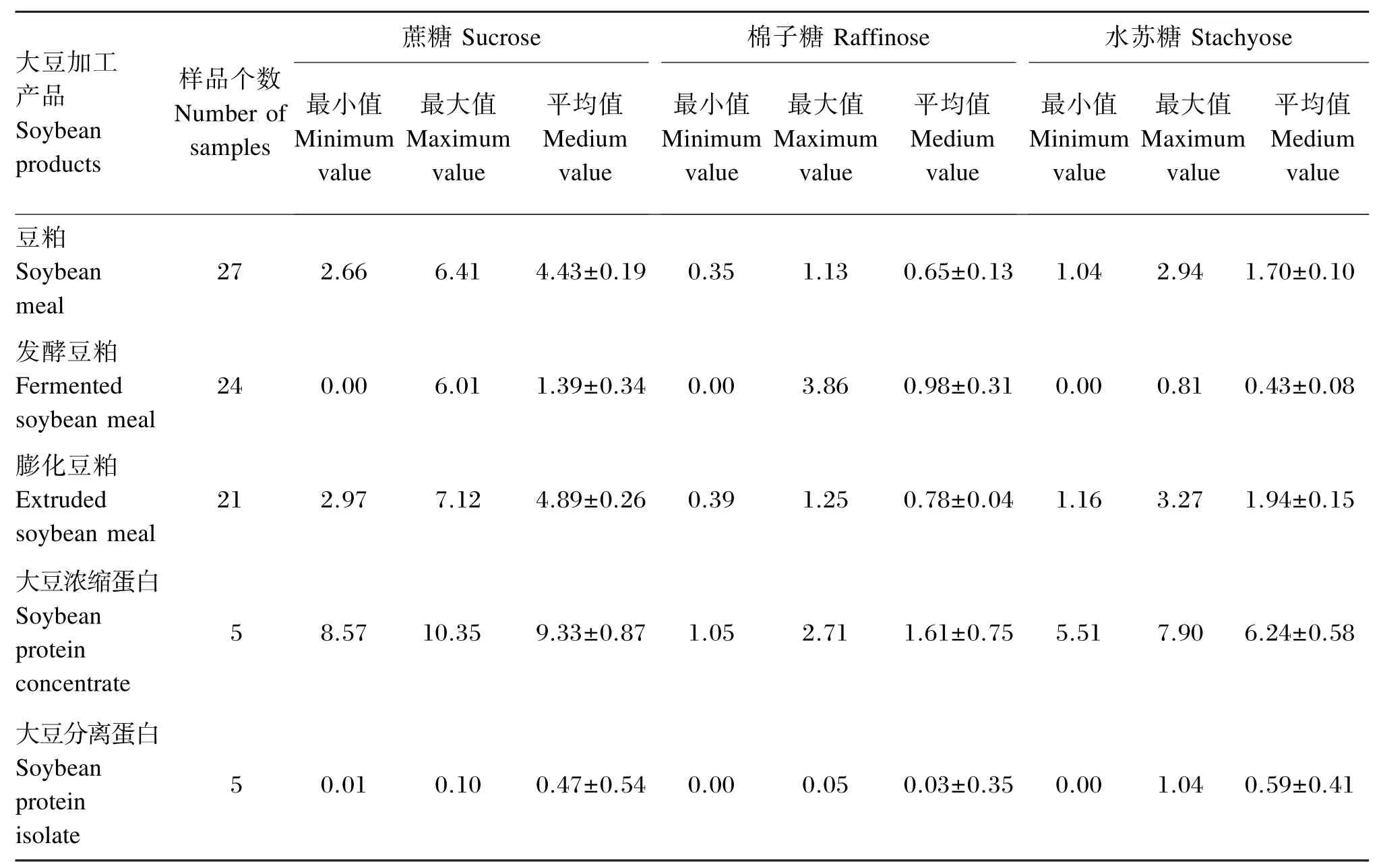
表4 大豆加工产品中蔗糖、棉子糖和水苏糖的含量范围Table 4 The content ranges of sucrose,raffinose and stachyosein in soybean products %
参考文献:
[1] 周其山.豆浆中脲酶活性含量测定法[J].食品科学,1989(4):42-44.
[2] 张国龙,李德发.大豆胰蛋白酶抑制因子酶联免疫吸附测定方法的研究[J].动物营养学报,1997,9(1):12-20.
[3] ROUQUIÉ D,CAPT A,EBY W H,et al.Investigation of endogenous soybean food allergens by using a 2⁃di⁃mensional gel electrophoresis approach[J].Regulatory Toxicology and Pharmacology,2010,58(3S):S47-S53.
[4] HOUSTON N L,LEE D G,STEVENSON S E,et al.Quantitation of soybean allergens using tandem mass spectrometry[J].Journal of Proteome Research,2011,10(2):763-773.
[5] HEI W J,LI Z,MA X,et al.Determination of beta⁃conglycinin in soybean and soybean products using a sandwich enzyme⁃linked immunosorbent assay[J].Analytica Chimica Acta,2012,734:62-68.
[6] BAUER T,KIRSCHBAUM K,PANTER S,et al.Sen⁃sitive detection of soy(Glycine max)by real⁃time polymerase chain reaction targeting the mitochondrial atpA gene[J].Journal of AOAC International,2011,94(6):1863-1873.
[7] CARRIER D,CUNNINGHAM J E,HOGGE L R,et al.Gas chromatographic⁃mass spectrometric character⁃ization of some fatty acids from white and interior spruce[J].Journal of Chromatography.A,1995,715(2):317-324.
[8] 张丽英,谯仕彦,李德发,等.大豆及其产品中大豆寡糖气相色谱分析测定方法的研究[J].动物营养学报,2004,16(1):20-22.
[9] BANSLEBEN D,SCHELLENBERG I,WOLFF A.Highly automated and fast determination of raffinose family oligosaccharides in Lupinus seeds using pres⁃surized liquid extraction and high⁃performance anion⁃exchange chromatography with pulsed amperometric detection[J].Journal of the Science of Food and Agri⁃culture,2008,88(11):1949-1953.
[10] ELLINGSON D,POTTS B,ANDERSON P,et al.Method for the direct determination of available carbo⁃hydrates in low⁃carbohydrate products using high⁃per⁃formance anion exchange chromatography[J].Journal of AOAC International,2010,93(6):1897-1904.
[11] 刘红玉,郑惠枚,郝国东.大豆分离蛋白的生产工艺[J].农机化研究.2002(2):122-122,126.
[12] HONG K J,LEE C H,KIM S W.Aspergillus oryzae GB⁃107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J].Journal of Medicinal Food,2004,7(4):430-435.
[13] 李素芬,杨丽杰,霍贵成.膨化处理对全脂大豆抗营养因子及营养价值的影响[J].畜牧兽医学报,2001,32(3):193-201.
[14] 毕万里.醇法大豆浓缩蛋白加工工艺对其理化性质的影响[D].硕士学位论文.无锡:江南大学,2008.
[15] 宋晓旻.膨胀加工方式及其对饲料营养价值的影响[J].饲料工业,2011,32(23):1-5.
(编辑 武海龙)
Detection and Analysis of Main Antinutritional Factors Content in Soybean Products
ZHOU Tianjiao QIAO Shiyan MA Xi HE Pingli∗
(State Key Laboratory of Animal Nutrition,College of Animal Science and Technology,China Agricultural University,Beijing 100193,China)
∗Corresponding author,professor,E⁃mail:hepingli@cau.edu.cn
Abstract:This experiment was conducted to determine the content of main soybean antinutritional factors(gly⁃cinin,β⁃conglycinin and trypsin inhibitor)and the content of sucrose,raffinose and stachyose in soybean used the competitive indirect enzyme linked immunosorbent assay(ELISA)method and chromatographic method.The contents of glycinin,β⁃conglycinin and trypsin inhibitor in 257 soybean products were detected and ana⁃lyzed by ELISA reagent kits.A high sensitivity and accurate detection system for the sucrose,raffinose and stachyose was established which used ion chromatography,and the content of oligosaccharide in 92 soybean products were detected and analyzed.The results showed that the contents of glycinin,β⁃conglycinin and tryp⁃sin inhibitor in fermented soybean meal,extruded soybean,soybean protein concentrate and soybean protein i⁃solate were lower than those in the others.The ion chromatography method which used for detected the su⁃crose,raffinose and stachyose had high sensitivity and accurate and good repeatability,and suiTable for detec⁃ted the oligosaccharide in soybean.The contents of sucrose,raffinose and stachyose in fermented soybean meal and soybean protein isolate were lower than those in the others.These data of main soybean antinutritional fac⁃tors in soybean products with different processing technology can be useful for the high efficient utilization of soybean in feeds for livestock.[Chinese Journal of Animal Nutrition,2015,27(1):221⁃229]
Key words:ELISA;ion chromatography;antinutritional factor;soybean products
通信作者:∗贺平丽,研究员,博士生导师,E⁃mail:hepingli@cau.edu.cn
作者简介:周天骄(1989—),男,河南三门峡人,博士研究生,从事动物营养与饲料安全研究。E⁃mail:ztj_cau0116@outlook.com
基金项目:国家自然科学基金青年项目(31101745)
收稿日期:2014-08-13
doi:10.3969/j.issn.1006⁃267x.2015.01.027
文章编号:1006⁃267X(2015)01⁃0221⁃09
文献标识码:A
中图分类号:S816.17

