β-羟丁酸对奶牛乳腺上皮细胞内乳脂肪合成及其相关基因相对表达量的影响
常晨城 齐利枝 闫素梅生 冉 赵艳丽(内蒙古农业大学动物科学学院,呼和浩特010018)
β-羟丁酸对奶牛乳腺上皮细胞内乳脂肪合成及其相关基因相对表达量的影响
常晨城 齐利枝 闫素梅∗生 冉 赵艳丽
(内蒙古农业大学动物科学学院,呼和浩特010018)
摘 要:本试验主要研究了不同浓度的β-羟丁酸(BHBA)对奶牛乳腺上皮细胞(BMECs)活力、甘油三酯(TAG)含量、脂滴形成以及乳脂肪合成相关基因转录水平的影响。将传至第3代的BMECs悬液(1×105个/孔)接种于细胞培养板上,每孔加入含10%胎牛血清(FBS)的DMEM/F12培养液,于37℃的5%二氧化碳(CO2)培养箱培养48 h。再将培养48 h的BMECs随机分配到6个组,各组向培养孔中加入含不同浓度BHBA的DMEM/F12培养液,培养液中的FBS用1 g/L无脂肪酸的牛血清白蛋白(BSA)代替,并使反应体系中BHBA的最终浓度分别为0(对照)、0.58、1.16、2.32、4.64和9.28 mmol/L。置于37℃的5%CO2培养箱继续培养48 h。试验结果显示:随着BHBA浓度的增加,BMECs活力[(相对增殖率(RGR)]呈显著的二次曲线增加(P=0.041),其中BMECs活力以0.58~4.64 mmol/L BHBA组较高,9.28 mmol/L BHBA组较低;低浓度(0.58~2.32 mmol/L)的BHBA可促进BMECs内脂滴的形成,而较高浓度(4.64~9.28 mmol/L)的BHBA对脂滴形成的促进作用减弱;BHBA与TAG含量及乳脂肪合成相关基因脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶α(ACACA)、硬脂酰辅酶A去饱和酶(SCD)、脂肪酸结合蛋白3(FABP3)、过氧化物酶体增殖物激活受体γ(PPARG)和分化抗原簇36(CD36)的相对表达量均无显著的一次线性或二次曲线关系(P>0.05)。综上,BHBA对BMECs活力的促进作用呈显著的二次曲线增加,即BHBA对BMECs活力呈显著浓度依赖关系;BHBA对细胞内乳脂肪的合成有提高的趋势。
关键词:β-羟丁酸;乳腺上皮细胞;乳脂肪合成相关基因;奶牛
乳脂肪是构成牛奶营养品质的主要基础物质之一,与牛奶的质量密切相关;促进乳腺内乳脂肪的合成、改进乳脂肪组成是改善牛奶品质的重要措施之一。因此,深入研究乳成分前体物(milk component precursor,MCP)对研究乳脂肪合成的调节机理、改进牛奶品质、保证优质牛奶生产具有重要的理论与指导意义。短链脂肪酸(short chain fatty acids,SCFA)乙酸和β-羟丁酸(β⁃hydroxybu⁃tyric acid,BHBA)是奶牛乳腺合成乳脂肪前体物(milk fat precursor,MFP),乳腺中约50%的脂肪酸来源于SCFA在奶牛乳腺上皮细胞(bovine mam⁃mary epithelial cells,BMECs)内的从头合成,主要包括中短链脂肪酸(short and medium chain fatty acids,SMCFA)(C4∶0~C14∶0)及C16∶0。许多研究均表明,乙酸作为MFP在提高乳脂率、促进乳脂肪合成方面起着重要作用。陈杰等[1]的研究报道,在奶牛饲粮中添加乙酸钠可使产奶量增加5.58%,乳脂率增加10.58%。乙酸钠也可称为“化学粗饲料”,在饲粮中添加乙酸钠,可增加瘤胃内乙酸比例、降低丙酸比例,从而提高乳脂率和产奶量。也有研究表明,通过阴外动脉或瘤胃灌注乙酸可提高乳脂肪和乳蛋白含量。Purdie等[2]研究表明,奶牛阴外动脉灌注乙酸可显著增加乳脂率。孙满吉等[3]在奶山羊阴外动脉灌注乙酸显著提高了乳脂率,并使乳腺摄取的MFP能转化为乳脂肪的效率提高了1.02%~2.04%。Maxin等[4]的研究表明,瘤胃灌注乙酸使得乳脂率增加了6.5%,而且改变了乳脂肪组成。齐利枝等[5]研究了不同浓度的乙酸对BMECs中乳脂肪合成的影响,结果指出乙酸对BMECs内脂滴形成及甘油三酯(triglyc⁃erides,TAG)的积累有显著的促进作用,同时指出在乙酸浓度为10~12 mmol/L时,能较好的促进过氧化物酶体增殖物激活受体γ(PPARG)基因的表达。BHBA作为重要的MPF之一,主要由瘤胃上皮细胞吸收的丁酸转化而来,然而,关于BHBA对乳脂肪合成方面的影响研究却十分有限,结果也不尽一致。白鸽等[6]在奶牛肝细胞的培养液中添加不同浓度的BHBA,结果表明,高浓度的BH⁃BA可以抑制肝脏脂肪氧化和合成,从而影响MFP的供应,进一步影响乳脂肪的合成。孔庆洋[7]利用体外法研究了不同浓度的丁酸钠对BMECs胞外TAG含量的影响,结果表明,随着丁酸钠浓度的增加,TAG含量显著增加,同时与乳脂肪合成相关基因的表达量也有升高的趋势。然而,Yoneza⁃wa等[8]的研究发现,丁酸(1~10 mmol/L)以剂量依赖模式影响BMECs的TAG积累和脂滴形成,丁酸可能抑制脂肪的合成,促进BMECs内的β氧化。鉴于此,本试验以BMECs为模型,研究不同浓度的BHBA对细胞活力、乳脂肪合成及乳脂肪合成相关基因的相对表达量的影响,进一步明确BHBA对乳脂肪合成的促进作用及其可能机理。
1 材料与方法
1.1 试验材料
DMEM/FA12培养液、胎牛血清(FBS)、催乳素、胰岛素转铁蛋白、表皮生长因子、胰蛋白酶和乙二胺四乙酸(EDTA)均购自美国的Gibco公司,氢化可的松、四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)和β-羟丁酸钠均购自美国的Sigma公司,磷酸盐缓冲溶液(PBS,HyClone,美国),无脂肪酸牛血清白蛋白(BSA,Equitech⁃Bio,美国),RNAprep pure Cell/Bacteria Kit[天根生化科技(北京)有限公司],PrimeScript RT Master Mix(TaKa⁃Ra,大连)和SYBR Premix Ex TaqTMⅡ(TaKaRa,大连)。
BMECs采用胶原酶消化法获得。取健康荷斯坦奶牛乳腺组织,分离去除组织外层于深处取约1 cm3的组织块若干,放入预冷的PBS中。带入超净台用PBS将组织块洗净后,再剪去组织块表层并将组织块剪成糊状。加入0.5%胶原酶Ⅱ(GIB⁃CO,美国)溶液于37℃的5%二氧化碳(CO2)条件下消化1 h,每隔20 min轻轻摇晃离心管。消化液用孔径80目的细胞滤网过滤,收集细胞滤液,800×g离心5 min,弃上清。加入BMECs培养液,吹打均匀,转入25 cm2培养瓶中,于37℃的5% CO2培养箱中培养。每日观察细胞的生长情况,待细胞生长至80%~90%融合度时,根据BMECs与成纤维细胞对胰蛋白酶消化敏感性不同,纯化BMECs并进行传代。本试验采用第3代传代细胞进行研究。将传至第3代的BMECs悬液接种于细胞培养板上,每孔加入含10%FBS的DMEM/F12培养液,于37℃的5%CO2培养箱培养48 h。
1.2 试验设计
将培养48 h的BMECs培养孔随机分为6个组,每个组4个重复。每孔加入含不同浓度BHBA 的DMEM/F12培养液,培养液中的FBS用1 g/L无脂肪酸的BSA代替,并使反应体系中BHBA(以β-羟丁酸钠的形式进行添加)的最终浓度分别为0(对照)、0.58、1.16、2.32、4.64和9.28 mmol/L,将细胞培养板置于37℃、5%CO2培养箱中继续培养48 h。
1.3 测试指标与方法
1.3.1 细胞活力
细胞活力的检测采用MTT比色法[9],以细胞相对增殖率(relative growth rate,RGR)表示。收集第3代的BMECs,用含10%FBS的DMEM/F12培养液悬浮细胞,将细胞悬浮液以1×104个/孔接种于96孔培养板(Corning,3599),置于37℃、5% CO2培养箱中,培养48 h后吸出各孔内培养液,添加含不同浓度BHBA的DMEM/F12诱导培养液,继续培养48 h;在培养结束前4 h,每孔加入20 μL MTT(5 mg/mL);4 h后弃上清液,每孔加入100 μL DMSO,振荡10 min后,用全自动酶标仪(Synergy H4 Bio Tek,美国)检测490 nm波长下各培养孔的吸光度(OD490 nm)值。
RGR(%)=(试验组OD490 nm/
对照组OD490 nm)×100。
1.3.2 脂滴的形成与TAG含量
BMECs内脂滴的形成与TAG含量采用油红O染色法,其中TAG含量的测定根据Ramírez⁃Zacarías等[10]的方法进行。将细胞悬浮液(1× 105个/孔)接种于24孔培养板,培养48 h后弃掉培养液,用PBS漂洗2次,每孔加入0.2 mL 4%多聚甲醛溶液固定细胞1 h;PBS漂洗2次,用0.5 mL油红O工作液浸染2 h,用PBS溶液漂洗直至干净,显微镜(Olympuse IX71,日本)下观察拍照;培养板置于32℃培养箱内将多余的水分蒸发,加入0.3 mL异丙醇萃取,然后将染液用移液枪吸出,用全自动酶标仪于510 nm波长处测吸光度(OD510 nm)值,以OD510 nm值代表TAG含量。每个组3个重复。
1.3.3 乳腺上皮细胞内乳脂肪合成相关基因的相对表达量
BMECs内乳脂肪合成的相关基因包括:脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶α(ACA⁃CA)、硬脂酰辅酶A去饱和酶(SCD)、分化抗原簇36(CD 3 6)、脂肪酸结合蛋白3(FABP 3)和PPARG,采用实时荧光定量聚合酶链式反应(RT⁃PCR)法检测。将每孔1×105个细胞悬浮液接种于6孔培养板,培养48 h后提取RNA。细胞总RNA的提取采用RNAprep Pure Cell/Bacteria Kit试剂盒,RNA的完整性和纯度用2%的凝胶电泳在电泳仪(Bio⁃Rad)上进行检测。反转录采用Pri⁃meScript RT Master Mix试剂盒,反应体系为10 μL。RNA反转录后用SYBR Premix Ex TaqTMⅡ试剂盒进行RT⁃PCR,反应体系为20 μL:SYBR Premix Ex TaqTMⅡ10 μL,上、下游引物各0.4 μL,cDNA模板2 μL和dH2O 7.2 μL。选用管家基因磷酸甘油醛脱氢酶(GAPDH)作为内参基因。引物列表见表1。RT⁃PCR的反应程序为:95.0℃30 s;95.0℃30 s,退火温度30 s,72.0℃20 s,共40个循环;72℃7 min。熔解曲线程序为:70~95℃,每6 s升高0.5℃,共51个循环。每个组6个重复。采用2-△△Ct法进行相对定量数据分析。
1.4 数据统计分析
试验数据采用SAS 9.0软件的回归统计程序,对各项测试指标的BHBA处理剂量效应进行一次线性和二次曲线回归分析,P<0.05表示差异显著。

表1 引物序列及参数Table 1 Primer sequences and parameters
2 结 果
2.1 BHBA对BMECs活力的影响
表2结果表明,0.58~4.64 mmol/L BHBA组RGR均高于对照组,而当BHBA浓度增加到9.28 mmol/L时,RGR降低,并低于对照组。回归分析结果表明,RGR随着BHBA浓度的增加呈显著的二次曲线变化(P=0.041,R2=0.881 4),二者呈显著的剂量依赖关系。

表2 BHBA对BMECs活力(相对增殖率)的影响Table 2 Effect of BHBA on viability(RGR)of BMECs %
2.2 BHBA对BMECs内TAG含量和脂滴形成的影响
表3结果表明,尽管从数值上看,低浓度的BHBA(0.58~2.32 mmol/L)组TAG含量较高,高浓度的BHBA(4.64~9.28 mmol/L)组呈降低趋势,但经回归分析检验,随着BHBA浓度增加,BMECs内TAG含量没有显著的一次线性或二次曲线变化(P>0.05)。由图1的脂滴形成结果可以直观地看出,低浓度(0.58~2.32 mmol/L)的BHBA对BMECs内脂滴的形成有一定的促进作用,而高浓度(4.64~9.28 mmol/L)的BHBA对脂滴的形成促进效果减弱。
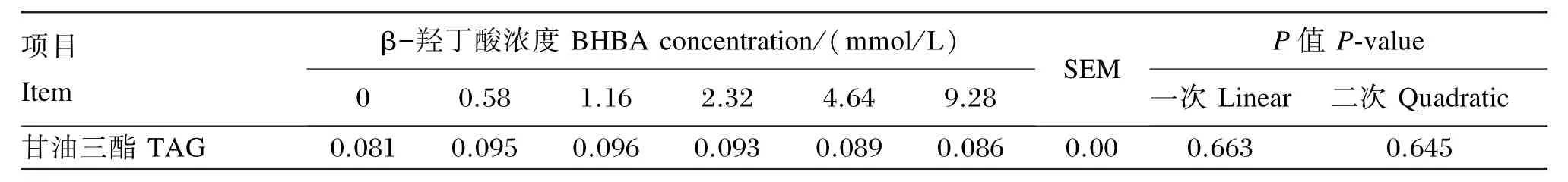
表3 BHBA对BMECs内TAG含量的影响Table 3 Effect of BHBA on TAG content in BMECs

图1 BHBA对BMECs内脂滴形成的影响Fig.1 Effect of BHBA on lipid droplet formation in BMECs(400×)
2.3 BHBA对BMECs乳脂肪相关基因相对表达量的影响
如表4所示,0.58~9.28 mmol/L BHBA组的FASN、ACACA、FABP3和PPARG基因相对表达量均在数值上高于对照组,其中FASN和FABP3基因相对表达量以1.16~2.32 mmol/L BHBA组的较高,ACACA和SCD基因相对表达量以0.58~ 1.16 mmol/L BHBA组的较高,PPARG基因相对表达量以4.64~9.28 mmol/L BHBA组的较高。所有BHBA组的CD36基因相对表达量均低于对照组。然而,经回归分析检验,FASN、ACACA、SCD、CD36、FABP3和PPARG的基因表达量随着BHBA浓度增加的均没有显著的一次线性或二次曲线变化(P>0.05)。

表4 BHBA对BMECs乳脂肪相关基因相对表达量的影响Table 4 Effects of BHBA on therelative expression of genes involved in milk fat synthesis in BMECs
3 讨 论
细胞活力是用来反映细胞存活和增殖的指标。本研究结果发现,BHBA作为乳脂肪酸内源合成的前体物对BMECs活力的调节作用呈显著的浓度依赖关系,RGR随着BHBA浓度的增加呈显著的二次曲线增加,即低浓度的BHBA(0.58~4.64 mmol/L)可促进BMECs活力,而高浓度(9.28 mmol/L)则表现出抑制作用。目前关于SCFA对BMECs活力的研究报道极少,其机理还需要进一步探讨。
乳脂肪的主要成分是TAG,它在粗面内质网膜的表面合成,在细胞质中以脂滴的形式积累,不同大小的脂滴被质膜包裹后从细胞分泌出去[14]。因此,BMECs内脂滴的形成和TAG含量直接反映了BMECs内乳脂肪的合成情况,与乳脂率密切相关。本研究结果表明,在BMECs培养液中添加不同浓度的BHBA,对细胞内脂滴的形成有一定促进效果,对TAG的积累尽管无显著的影响,但从总体趋势看,低浓度(0.58~2.32 mmol/L)的BH⁃BA对TAG的积累有一定的促进作用,而高浓度(4.64~9.28 mmol/L)的BHBA有一定抑制效果。目前,关于BHBA对乳脂肪合成的影响及其机理研究报道甚少,结果也不尽一致。本研究结果提示,BHBA对BMECs内乳脂肪的合成有一定促进作用,且促进效果与BHBA的浓度有关。
FASN和ACACA是奶牛乳腺中参与脂肪酸从头合成的关键酶[15]。孔庆洋[7]在BMECs培养液中添加丁酸(0~1.25 mmol/L),显著增加了细胞外TAG的含量,上调了FASN和ACACA的基因表达。然而,Yonezawa等[8]的研究发现,1~10 mmol/L的丁酸以剂量依赖模式影响BMECs的TAG积累和脂滴形成,10 mmol/L的丁酸促进了细胞内TAG的积累,降低了乙酰辅酶A羧化酶的活性,但没有形成脂滴;提示丁酸可能抑制脂肪的合成,促进BMECs内的β-氧化;结果也指出,细胞内TAG的积累可能直接或间接地与BMECs的分化有关。本试验的研究结果发现,BHBA对BMECs的FASN和ACACA基因相对表达量影响经回归分析差异不显著,即BHBA作为MFP,其浓度和与从头合成有关的FASN和ACACA基因相对表达量无显著的一次线性或二次曲线的关系。SCD是单不饱和脂肪酸合成的主要酶,由于瘤胃氢化作用,乳腺摄取的脂肪酸中只有少量是饱和脂肪酸。SCD位于内质网上,它能在14烷酰-、16烷酰-和18烷酰-辅酶A的C9位上形成双键,但其主要底物是棕榈酰辅酶A和硬脂酰辅酶A[16]。本试验的研究结果表明,经回归分析检验,BHBA浓度与SCD基因相对表达量无显著的一次线性或二次曲线的关系。目前关于BHBA对SCD基因相对表达量的影响尚未见报道,确切的结果还有待于进一步的探讨。
FABP3和CD36是奶牛乳腺中2种主要的长链脂肪酸(long chain fatty acids,LCFA)转运蛋白,在奶牛乳腺中FABP3和CD36基因的共表达提示这2种蛋白存在相近的功能关系[17]。FABP3参与细胞内LCFA的转运,CD36主要将脂肪酸转运进入乳腺细胞,二者与BMECs对LCFA的摄取与转运有关。PPAR在奶牛的乳脂肪合成方面起重要调节作用[15,18],对调节细胞的增殖与分化有一定作用[19]。已发现的PPAR有3种亚型:PPARα、PPARβ/δ和PPARγ,各亚型的组织分布不同[20]。然而,目前关于丁酸对FABP3、CD36和PPAR基因相对表达量的研究极少。Yonezawa等[8]研究表明,BMECs培养液中分别添加10 mmol/L乙酸、丁酸或辛酸,均可显著上调细胞中CD36 mRNA表达量,但对PPARγ的蛋白质表达的下调作用不显著。然而,本试验的研究结果发现,BHBA浓度对FABP3、CD36和PPARγ基因相对表达量的影响结果经回归分析检验差异均不显著。造成这些结果不一致的原因尚不清楚,目前相关的研究报道也很少,值得进一步探讨。
综上所述,本试验主要研究了BHBA对BMECs内乳脂肪合成的促进作用,结果得出低浓度(0.58~2.32 mmol/L)的BHBA可促进脂滴的形成,高浓度(4.64~9.28 mmol/L)的促进效果减弱。在此基础上又从乳脂肪合成相关基因表达的角度探讨了其可能的影响机理,结果显示,0.58~9.28 mmol/L BHBA的对FASN、ACACA、SCD、FABP3、PPARγ和CD36基因的相对表达量均无显著一次线性或二次曲线的调节作用。由此可见,BHBA对BMECs内乳脂肪合成的促进作用是否与乳脂肪合成相关基因的表达量发生改变有关,还需要进一步探讨。
神经内分泌因素对乳脂肪和乳蛋白含量具有重要的调控作用。生长激素和催乳素可以调控奶牛乳脂肪和乳蛋白前体物的生成、摄取和利用。而乳脂肪和乳蛋白前体物也可以通过直接或间接作用调控牛垂体组织泌乳相关激素的合成和分泌。王建发[21]的研究指出,BHBA不仅能作为能量物质直接参与机体能量代谢调控,还可作为中枢信号物质影响下丘脑能量稳态和激素分泌功能;BHBA可引起奶牛腺垂体细胞的生长激素和催乳素等内分泌激素的分泌量减少,进而影响乳蛋白与乳脂肪等乳成分的合成。因此,BHBA对乳脂肪合成的影响可能与神经内分泌有关,但确切的研究有待进一步探讨。
4 结 论
BHBA对BMECs活力的促进效果呈显著的二次曲线增加,即BHBA对BMECs活力呈浓度依赖关系;BHBA对细胞内乳脂肪的合成有提高的趋势。
参考文献:
[1] 陈杰,崔用侠,伍一军,等.日粮中添加乙酸钠对高温季节奶牛产乳性能的影响[J].中国奶牛,1986(2):21-24.
[2] PURDIE N G,TROUT D R,POPPI D P,et al.Milk synthetic response of the bovine mammary gland to an increase in the local concentration of amino acids and acetate[J].Journal of Dairy Science,2008,91(1):218-228.
[3] 孙满吉,卢德勋,王丽芳,等.基础日粮下关中奶山羊乳腺对营养物质摄取和利用的研究[J].动物营养学报,2009,21(6):859-864.
[4] MAXIN G,GLASSER F,HURTAUD C,et al.Com⁃bined effects of trans⁃10,cis⁃12 conjugated linoleic acid,propionate,and acetate on milk fat yield and composition in dairy cows[J].Journal of Dairy Sci⁃ence,2011,94(4):2051-2059.
[5] 齐利枝,生冉,闫素梅,等.乙酸浓度对奶牛乳腺上皮细胞甘油三酯含量及瘦素和过氧化物酶增殖物激活受体γ基因表达量的影响[J].动物营养学报,2013,25(7):1519-1525.
[6] 白鸽,许远靖,王冲,等.乙酸和β-羟丁酸对体外培养牛肝细胞脂代谢部分关键酶表达的影响[J].中国兽医学报,2012,32(1):69-72,88.
[7] 孔庆洋.乙酸钠和丁酸钠对奶牛乳腺上皮细胞及腺泡乳脂合成相关基因表达的影响[D].硕士学位论文.哈尔滨:东北农业大学,2012.
[8] YONEZAWA T,YONEKURA S,SANOSAKA M,et al.Octanoate stimulates cytosolic triacylglycerol accu⁃mulation and CD36 mRNA expression but inhibits ac⁃etyl coenzyme A carboxylase activity in primary cul⁃tured bovine mammary epithelial cells[J].Journal of Dairy Research,2004,71(4):398-404.
[9] 郑永唐,贲昆龙.测定细胞存活和增殖的MTT方法的建立[J].免疫学杂志,1992,8(4):266-269.
[10] RAMÍREZ⁃ZACARÍAS J L,CASTRO⁃MUÑOZLEDO F,KURI⁃HARCUCH W.Quantitation of adipose conver⁃sion and triglycerides by staining intracytoplasmic lipids with Oil red O[J].Histochemistry,1992,97(6):493-497.
[11] ZHOU Y,AKERS R M,JIANG H.Growth hormone can induce expression of four major milk protein genes in transfected MAC⁃T cells[J].Journal of Dairy Sci⁃ence,2008,91(1):100-108.
[12] BIONAZ M,LOOR J J.Gene networks driving bovine milk fat synthesis during the lactation cycle[J].BMC Genomics,2008,9:366.
[13] 胡菡.中国荷斯坦奶牛乳腺上皮细胞体外培养体系的建立与应用[D].博士学位论文.兰州:甘肃农业大学,2010.
[14] MATHER I H,KEENAN T W.Origin and secretion of milk lipids[J].Journal of Mammary Gland Biology and Neoplasia,1998,3(3):259-273.
[15] BIONAZ M,LOOR J J.ACSL1,AGPAT6,FABP3,LPIN1,and SLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is af⁃fected by stage of lactation[J].The Journal of Nutri⁃ tion,2008,138(6):1019-1024.
[16] BICKERSTAFFE R,ANNISON E F.The desaturase activity of goat and sow mammary tissue[J].Compar⁃ative Biochemistry and Physiology,1970,35(3):653-665.
[17] SPITSBERG V L,MATITASHVILI E,GOREWIT R C.Association and coexpression of fatty⁃acid⁃binding protein and glycoprotein CD36 in the bovine mamma⁃ry gland[J].European Journal of Biochemistry/FEBS,1995,230(3):872-878.
[18] KADEGOWDA A K G,BIONAZ M,PIPEROVA L S,et al.Peroxisome proliferator⁃activated receptor⁃γ activation and long⁃chain fatty acids alter lipogenic gene networks in bovine mammary epithelial cells to various extents[J].Journal of Dairy Science,2009,92 (9):4276-4289.
[19] ROSEN E D,SPIEGELMAN B M.PPARγ:a nuclear regulator of metabolism,differentiation,and cell growth[J].The Journal of Biological Chemistry,2001,276:37731-37734.
[20] BERNARD L,LEROUX C,CHILLIARD Y.Expres⁃sion and nutritional regulation of lipogenic genes in the ruminant lactating mammary gland[J].Advances in Experimental Medicine and Biology,2008,606:67-108.
[21] 王建发.乳脂肪和乳蛋白主要前体物对DCAPCs中GH和PRL的影响及机制研究[D].博士学位论文.长春:吉林大学,2013.
(编辑 陈 燕)
Effects of β⁃Hydroxybutyric Acid on Relative Expression Levels of Genes Related to Milk Fat Synthesis in Bovine Mammary Epithelial Cells
CHANG Chencheng QI Lizhi YAN Sumei∗SHENG Ran ZHAO Yanli
(College of Animal Science,Inner Mongolia Agricultural University,Huhhot 010018,China)
∗Corresponding author,professor,E⁃mail:yansmimau@163.com
Abstract:This study was conducted to determine the effects of β⁃hydroxybutyric acid(BHBA)on cell viabili⁃ty,triacylglycerol(TAG)content,lipid droplet formation and relative expression levels of genes related to milk fat synthesis in bovine mammary epithelial cells(BMECs).The 3th passage cells were plated 1×105cells/well in culture plates and DMEM/F12 medium containing 10%fetal bovine serum(FBS)was added to each well,then the plates were maintained in an incubator with 5%CO2at 37℃.After 48 h,cells were ran⁃domly divided into 6 groups and cultured in DMEM/F12 medium containing different concentrations of BH⁃BA,FBS in medium was replaced with 1 g/L fatty acid⁃free bovine serum albumin(BSA).The final concen⁃trations of BHBA in reaction systems were 0(control),0.58,1.16,2.32,4.64,9.28 mmol/L,respectively.Continuous incubation in an incubator with 5%CO2at 37℃for 48 h.The results showed that BMECs prolifer⁃ation[relative growth rate(RGR)]was significantly quadratic increased with BHBA concentration increasing (P=0.041),and BMECs proliferation of 0.58 to 4.64 mmol/L BHAB groups was high,but 9.28 mmol/L BHBA group was low.BHBA at low concentration(0.58 to 2.32 mmol/L)promoted lipid droplet formation,and the promoting effect of BHBA at high concentration(4.64 to 9.28 mmol/L)was weakened.No significant linear and quadratic relationships were found between BHBA concentration and TAG content(P>0.05).No significant linear and quadratic relationships were found between BHBA concentration and relative expression levels of genes related to milk fat synthesis(fatty acid synthetase,acetyl⁃CoA carboxylase α,stearyl coenzyme A desaturase,fatty acid binding protein 3,peroxisome proliferator⁃activated receptor γ and cluster of differenti⁃ation 36)(P>0.05).In conclusion,BMECs proliferation significantly quadratic increase with BHBA concen⁃tration increasing,namely BMECs proliferation has significant concentration⁃dependent relationship with BHBA concentration,and the milk fat synthesis has a improve trend by BHBA concentration.[Chinese Journal of An⁃imal Nutrition,2015,27(1):196⁃203]
Key words:β⁃hydroxybutyric acid;mammary epithelial cells;genes related to milk fat synthesis;dairy cows
作者简介:常晨城(1989—),男,内蒙古包头人,硕士研究生,从事反刍动物营养的研究。E⁃mail:changchencheng8112@163.com
基金项目:奶业“973计划”(2011CB100800)
收稿日期:2014-07-11
doi:10.3969/j.issn.1006⁃267x.2015.01.024
文章编号:1006⁃267X(2015)01⁃0196⁃08
文献标识码:A
中图分类号:S823.9+1;S852.2
通信作者:∗闫素梅,教授,博士生导师,E⁃mail:yansmimau@163.com

