新型甾体N,N-二甲基缩氨硫腙类化合物的合成及其抗肿瘤活性*
黄燕敏,郑嘉桦,赵丹丹,戚斌斌,杨春晖,盛海兵,甘春芳,崔建国(广西师范学院化学与材料科学学院,广西南宁 530001)
新型甾体N,N-二甲基缩氨硫腙类化合物的合成及其抗肿瘤活性*
黄燕敏,郑嘉桦,赵丹丹,戚斌斌,杨春晖,盛海兵,甘春芳,崔建国
(广西师范学院化学与材料科学学院,广西南宁530001)
摘要:以乙醇(或甲醇为溶剂),冰醋酸为催化剂,去氢表雄酮、孕烯醇酮、雌酮和3,5-二羟基-6-甲酰基-B-降胆甾烷分别与N,N-二甲基硫代氨基脲经缩合反应,合成了4个新型的具有不同甾核结构特征的甾体N,N-二甲基缩氨硫腙类化合物(1~4),其结构经1H NMR,13C NMR,IR和HR-EI-MS表征。采用MTT法测定了1~4对肝癌细胞(HepG)、人鼻咽癌细胞(CNE-2)和人肾上皮细胞(HEK-293T)的体外抑制细胞生长增殖活性。结果表明:1~3对HepG和CNE-2具有明显的抑制活性。
关键词:甾酮; 3,5-二羟基-6-甲酰基-B-降胆甾烷; N,N-二甲基甾体缩氨硫腙;合成;抗肿瘤活性
Tel.0771-3101180,E-mail:huangyanmin828@163.com
通信联系人:崔建国,教授,Tel.0771-5530019,E-mail:cuijg1954@126.com
近来,人们发现在甾体化合物中引入氮,硫原子或与含氮,硫等杂原子的药效基团拼合后,会产生独特的生物活性,用于治疗不同的疾病[1-6]。腙类化合物是有机化学家关注的焦点[7-8],许多结构独特的甾体腙类化合物已相继被合成,并且许多具有良好的抗肿瘤、抗菌及抗病毒活性[9-11]。其中,缩胺硫腙化合物因其良好的肿瘤细胞毒性、抗菌活性及抗病毒活性,日益受到药物学家关注。在甾体中引入缩胺硫腙药效团的化合物有很好的镇痛、抗菌、抗真菌及抗炎活性[12-16]。但至今为止,具有抗肿瘤活性的甾体缩胺硫腙化合物报道较少。
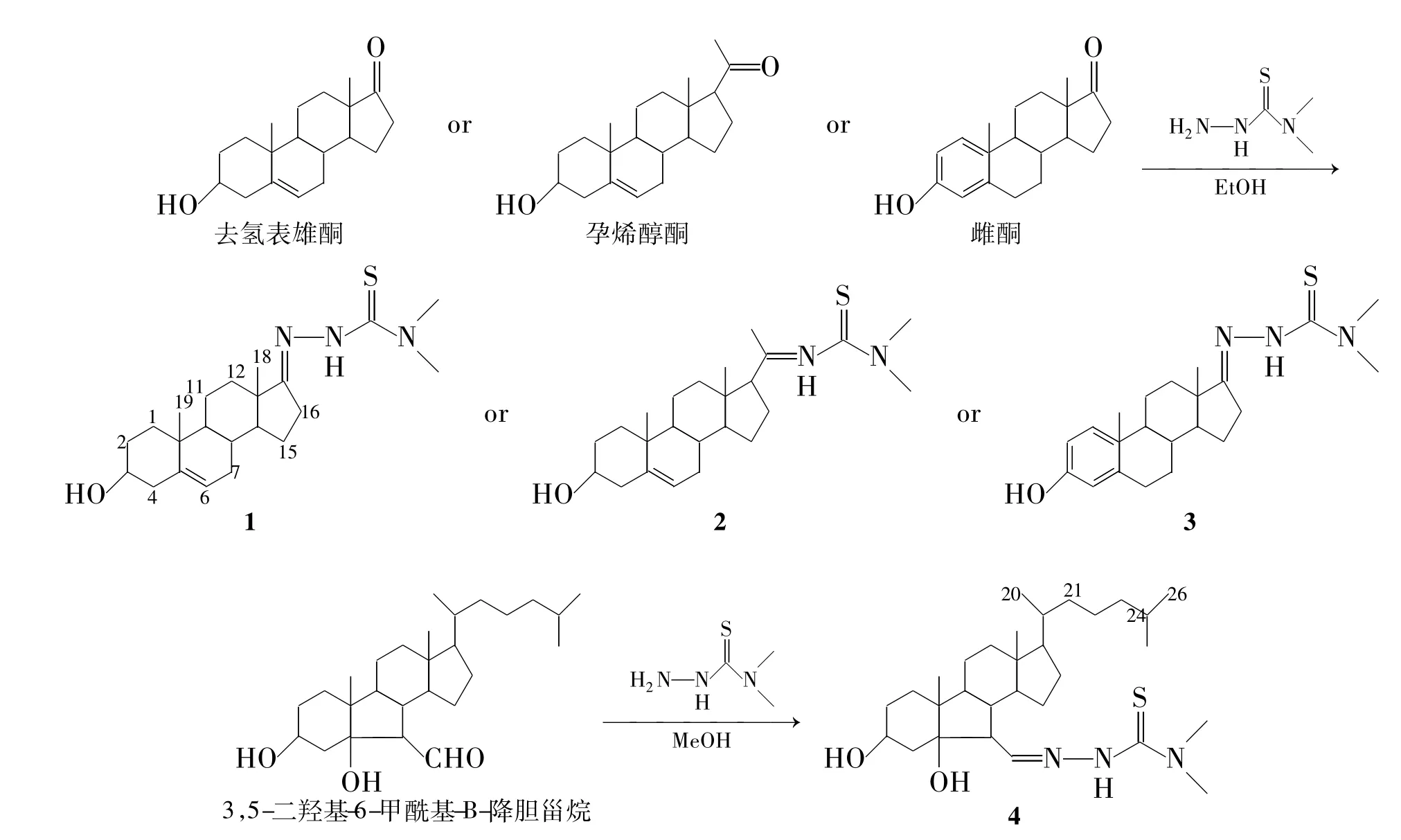
Scheme 1
本课题组曾分别以胆固醇、孕烯醇酮、豆甾醇等为原料,合成了一系列甾体肟类及缩氨硫腙类化合物。体外抗肿瘤活性研究发现其有较好的抑制肿瘤细胞生长增殖活性[17-20]。2010年,Huang H等[21]设计并合成了一系列结构新颖的稠环类缩胺硫腙化合物,并深入研究了其抗肿瘤活性和作用机制。其中部分化合物表现出显著抑制人肿瘤细胞生长增殖活性,特别是具有N,N-二甲基缩氨硫腙结构的化合物TSC24(Chart 1)活性最强,对不同肿瘤细胞株抑制活性的IC50值在2 μmol· L-1~830 μmol·L-1

Chart 1
受此启发,本文在文献[21]方法的基础上,以乙醇(或甲醇为溶剂),冰醋酸为催化剂,去氢表雄酮、孕烯醇酮、雌酮和3,5-二羟基-6-甲酰基-B-降胆甾烷分别与N,N-二甲基硫代氨基脲经缩合反应,合成了4个新型的具有不同甾核结构特征的甾体N,N-二甲基缩氨硫腙化合物(1~4,Scheme 1),其结构经1H NMR,13C NMR,IR和HR-EI-MS确证。测定了1~4对肿瘤细胞[肝癌细胞(HepG)、人鼻咽癌细胞(CNE-2)和人肾上皮细胞(HEK-293T)]的生长增殖活性,希望利用甾体化合物渗透细胞膜的功能,获得具有更好抗肿瘤活性的甾体缩氨硫腙化合物。
1 实验部分
1.1仪器与试剂
X6型显微熔点仪(温度未校正); Bruker AV-300型超导核磁共振仪(CDCl3为溶剂,TMS为内标); Thermo Scientific Nicolet IS-10型傅立叶红外光谱仪(KBr压片); Agilent 6210 TOFMS型质谱仪; MLLTISKAN MK3型分光光度仪。
3,5-二羟基-6-甲酰基-B-降胆甾烷参考文献[19]方法合成;去氢表雄酮、孕烯醇酮,雌酮和N,N-二甲基硫代氨基脲,百灵威科技有限公司;薄层层析板和硅胶,安徽良臣硅源材料有限公司;其余所用试剂均为分析纯,溶剂按常规方法干燥除水。
1.2 1~4的合成通法
在反应瓶中加入甾醇0.40 mmol,N,N-二甲基氨基硫脲0.41 mmol和无水乙醇25 mL,于75℃搅拌使其完全溶解;加入冰醋酸0.5 mL,反应4 h(TLC跟踪)。减压蒸除大部分溶剂后加入蒸馏水20 mL,用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用饱和碳酸氢钠溶液(30 mL)和饱和氯化钠溶液(30 mL)洗涤,无水硫酸钠干燥;减压蒸除溶剂后经柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=2∶1]纯化得白色固体1~3和棕色油状液体4。
N,N-二甲基-去氢表雄酮-17-缩氨硫腙(1):产率32%,m.p.200℃~202℃;1H NMR δ:0.92(s,3H,18-H),1.04(s,3H,19-H),3.33(s,6H,NCH3),3.48~3.59(m,1H,3-Hα),5.37(d,J=4.8 Hz,1H,6-H),7.87(br s,1H,NH);13C NMR δ:16.8(C18),19.4(C19),20.5(C11),23.5(C15),29.7(C16),31.2(C8),31.3(C7),31.6(C2),33.9(C12),34.0(C10),36.6(NCH3),37.2(C1),42.2(C4),44.5(C13),50.3(C9),53.8(C14),71.6(C3),121.0(C6),141.0(C5),165.8(C17),182.9(C=S); IR ν:3 424,2 925,1 644,1 539,1 464,1 364,1 260,1 118,1 053,908,734 cm-1; HR-EI-MS m/z:Calcd for C22H36N3OS{[M +H]+}390.257 9,found 390.258 6。
N,N-二甲基孕甾-20-缩氨硫腙(2):产率42%,m.p.217℃~218℃;1H NMR δ:0.67(s,3H,18-H),1.02(s,3H,19-H),1.26(s,3H,21-CH3),3.31(s,6H,NCH3)3.48~3.59(m,1H,3-Hα),5.36(d,J=4.8 Hz,1H,6-H);13C NMR δ:13.5(C18),19.4(C19),20.9(C21),21.0(C11),23.7(C15),24.2(C16),29.7(C2),31.6(C8),32.1(C7),36.5(C10),36.5(NCH3),37.3(C1),38.4(C12),42.2(C4),45.2(C13),50.0(C9),56.3(C17),58.0(C14),71.7(C3),121.2(C6),140.8(C5),152.1(C20),183.0(C=S); IR ν:3 424,2 925,1 726,1 504,1 384,1 314,1 254,1 122,1 050,908,726 cm-1; HR-EI-MS m/z:Calcd for C24H40N3OS{[M + H]+} 418.289 2,found 418.290 3。
N,N-二甲基雌酮-17-缩氨硫腙(3):产率37%,m.p.183℃~185℃;1H NMR δ:0.93(s,3H,18-H),2.84~2.89(m,2H,16-H),3.37(s,6H,NCH3),6.61(s,1H,4-H),6.69(d,J=8.4 Hz,1H,2-H),7.15(d,J=8.4 Hz,1H,1-H);13C NMR δ:17.1(C18),23.2(C11),26.1(C15),27.1(C16),29.5(C7),29.7(C6),34.1(C12),38.1(NCH3),40.0(C8),44.0(C9),45.0(C13),52.6(C14),112.9(C2),115.3(C4),126.4(C1),132.0(C10),138.0(C5),153.7(C3),166.0(C17),182.7(C=S); IR ν:3 411,2 925,1 731,1 606,1 539,1 499,1 372,1 257,1 095,921,816,724 cm-1; HR-EI-MS m/z:Calcd for C21H30N3OS{[M + H]+} 372.211 0,found 372.211 7。
3,5-二羟基-N,N-二甲基-B-降胆甾-6-缩氨硫腙(4):产率58%;1H NMR δ:0.67(s,3H,18-H),0.86(d,J=6.6 Hz,6H,26,27-H),0.91(d,J=6.0 Hz,3H,20-H),0.92(s,3H,19-H),2.02(m,2H,4,8-H),2.16(t,J=8.1 Hz,1H,7-H),3.33(s,6H,NCH3),4.10(br s,1H,3-H),7.21(d,J=6.8 Hz,1H,6-H);13C NMR δ:12.5(C18),18.6(C19),18.8(C21),21.6(C11),22.5(C27),22.8(C26),23.8(C23),24.6(C15),27.9(C25),28.0(C16),28.5(C2),35.6(C1),36.2(C20),39.5(C22),39.7(C4),43.0(C24),43.2(C12),43.0(NCH3),43.7(C10),44.7(C8),45.2(C13),51.3(C9),53.4(C7),55.6(C14),56.2(C17),67.1(C3),83.7(C5),150.7(C=N),181.0(C=S); IR ν:3 422,2 940,2 866,1 719,1 614,1 547,1 467,1 377,1 365,1 270,1 235,1 123,1 078,1 016 cm-1; HR-EIMS m/z:Calcd for C30H54N3O2S{[M + H]+},found 520.393 7。
1.3抗肿瘤活性测定
以顺铂为阳性对照,采用MTT法测定了1~4 对HepG,CNE-2和HEK-293T的体外生长增殖抑制活性。将对数生长期的细胞分别以(3~4)×104个/mL的密度接种于96孔板中,每孔接种200 μL,置CO2培养箱中培养24 h。按预设的浓度梯度分别加入待测样品,每一个浓度梯度设3个平行孔,同时设对照孔和空白孔。保持37℃在CO2培养箱中培养72 h。每孔加入20 μL的MTT(5 mg· mL-1)溶液,再于CO2培养箱中温育4 h。弃去上清液,加入DMSO 200 μL,混匀10 min,待沉淀完全溶解后,用酶标仪在490 nm处测定溶液的OD值,计算一定浓度下化合物对细胞的抑制率;以抑制率对药物浓度作图,分别求出每个样品的IC50值。
2 结果与讨论
2.1合成与表征
从去氢表雄酮、孕烯醇酮和雌酮出发,其17-位或20-位羰基与N,N-二甲基硫代氨基脲发生缩合反应,引入N,N-二甲基氨基硫腙基团,合成了1~3。
1的1H NMR分析表明,δ 3.33处单峰为6个氢[N(CH3)2,此处与氮原子相连的两甲基是等位的,故表现为一个单峰],δ 7.87处的宽单峰是与氮相连氢的吸收峰。13C NMR分析表明,δ 182.9处出现C=S吸收峰,δ 165.8处出现C=N吸收峰,去氢表雄酮17-位羰基碳在δ 220处的吸收峰消失,均表明去氢表雄酮中的17-羰基已与N,N-二甲基硫代氨基脲缩合合成了1。2和3的表征与1类似。
4的1H NMR分析表明,δ 7.21处的吸收峰是与氮相连6-位氢吸收峰,δ 4.10处的吸收峰是与羟基相连3-位氢吸收峰,δ 3.33处的单峰是与氮相连的两个甲基的6个氢吸收峰。13C NMR分析表明,δ 67.1和δ 83.6吸收峰分别是与羟基相连的C3和C5;δ 180.9处吸收峰归属C=S,δ 150.7处吸收峰则归属C=N,进一步结合质谱数据可确定4的结构。
2.2抗肿瘤活性
1~4的抗肿瘤活性见表1。由表1可见,1~4对所测试的肿瘤细胞株均具有一定的抑制生长增殖活性,其中1对CNE-2的IC50为15.4 μmol· L-1,优于阳性对照物顺铂; 2对HepG的IC50为
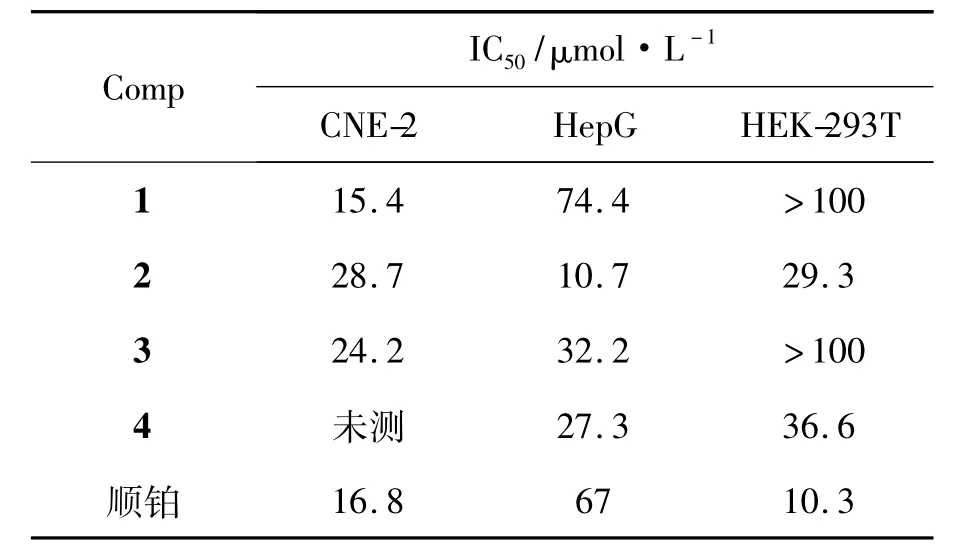
表1 化合物的抗肿瘤活性*Table 1 Anti-tumor activities of compounds
10.7 μmol·L-1。有趣的是具有17-缩氨硫腙结构的化合物1和3对HEK-293T没有明显的细胞毒性,值得进一步深入研究。
3 结论
以具有不同甾核结构特征的甾酮或甾醛作为原料,合成了4个具有不同结构特征的N,N-二甲基甾体缩氨硫腙类化合物。抗肿瘤活性研究结果表明:所有化合物对所测试的肿瘤细胞都表现出明显的生长增殖抑制活性。其中,具有17-缩氨硫腙结构的化合物对人肾上皮正常细胞HEK-293T没有表现出明显的抑制活性。以上结果为新的甾体抗肿瘤药物的设计合成提供参考。
参考文献
[1]Mohared R M,Elmegged G A,Abdel-Salam O M E,et al.Synthesis of modification as a novel class of nonulcerogenic,anti-inflammatory and anti-nociceptive agent[J].Steroid,2011,76:1190-1203.
[2]Natalija M,KrstiĉN M,Mira S,et al.New androst-4-en-17-spiro-1,3,2-oxathiaphospholanes.Synthesis,assignment of absolute configuration and in vitro cytotoxic and antimicrobial activities[J].Steroids.,2012,77:558-565.
[3]Festi D,Montagnani M,Azzaroli F,et al.Clinical efficacy and effectiveness of ursodeoxycholic acid in cholestatic liver diseases[J].Curr Clin Pharmacol,2007,2(2):155-177.
[4]Chen S J,Cui J G,Li Y,et al.Recent advance of steroidal hydrazone with biological activities[J].Chinese J Org Chem,2011,31:187-192.
[5]Traf D T P.Hydride aza-steroid-alkylators in the treatment of colon cancer[J].Cancer Lett,2006,243:202-210.
[6]范良华,崔建国,甘春芳,等.具有生物活性氮杂甾体化合物的研究进展[J].化学研究与应用,2012,24:8-15.
[7]Lebrecht D,Geist A,Ketelsen U P,et al.The 6-maleimidocaproyl hydrazone derivative of doxorubicin(DOXO-EMCH)is superior to free doxorubicin with respect to cardiotoxicity and mitochondrial damage [J].Inter J Cancer,2007,120(4):927-934.
[8]El-Hawash S A M,Wahab A E A.Synthesis and in vitro anticancer and antimicrobial evaluation of some novel quinoxalines derived from 3-phenylquinoxaline-2(1H)-thione[J].Archiv der Pharm,2006,339(8):437-447.
[9]Loncle C,Brunel J M,Vidal N,et al.Synthesis and antifungal activity of cholesterol-hydrazone derivatives [J].Euro Med Chem,2004,39:1067-1071.
[10]Kemertelidze E P,Papadopoulos K,Men'shova N I.Some derivatives of 5α-ketosteroid hydrazones:Synthesis from tigogenin and antituberculosis activity [J].Russ Bioorg Chem,2004,30(5):497-501.
[11]Khan S A,Asiria A M,Yusuf M.Synthesis and biological evaluation of some thiazolidinone derivatives of steroid as antibacterial agents[J].Eur Med Chem,2009,44:2597-2600.
[12]Khan S A,Kumar P,Joshi R,et al.Synthesis and in vitro antibacterial activity of new steroidal thiosemicarbazone derivatives[J].Eur Med Chem,2008,43:2029-2034.
[13]Khan S A.Synthesis,characterization and in vitro antibacterial activity of new steroidal 5-en-3-oxazolo and thiazoloquinoxaline[J].Eur Med Chem,2008,43:2040-2044.
[14]Khan S A,Saleem K,Khan Z.Synthesis,characterization and in vitro antibacterial activity of new steroidal thiazolo quinoxalines[J].Eur Med Chem,2007,42:103-108.
[15]Khan S A,Yusuf M.Synthesis,spectral studies and in vitro antibacterial activity of steroidal thiosemicarbazone and their palladium[Pd(II)]complexes[J].Eur Med Chem,2009,44:2270-2274.
[16]Khan S A,Saleem K,Khan Z.Synthesis,structure elucidation and antibacterial evaluation of new steroidal-5-en-7-thiazoloquinoxaline derivatives[J].Eur Med Chem,2008,43:2257-2261.
[17]Gan C F,Lin Q F,Cui J G,et al.Synthesis and in vitro antiproliferative evaluation of some novel B-norcholesterols[J].Steroids,2014,79:37-43.
[18]Gan C F,Cui J G,Su S Y,et al.Synthesis and antiproliferative activity of some steroidal thiosemicarbazones,semicarbazones and hydrozones[J].Steroids,2014,87:99-107.
[19]Gan C F,Fan L H,Cui J G,et al.Synthesis of novel ring B abeo-sterol derivatives and their antiproliferative activities[J].Steroids,2012,77:1061-1068.
[20]Gan C F,Fan L H,Huang Y M,et al.Synthesis of novel ring B abeo-sterol derivatives and their antiproliferative activities[J].Med Chem,2013,9:846-854.
[21]Huang H,Chen Q,Ku X,et al.A series of alphaheterocyclic carboxaldehyde thiosemicarbazones inhibit topoisomerase IIα catalytic activity[J].J Med Chem,2010,53(8):
Synthesis and Anti-tumor Activities of
Novel Steroidal N,N-dimethylthiosemicarbazone Compounds
HUANG Yan-min,ZHENG Jia-hua,ZHAO Dan-dan,QI Bin-bin,YANG Chun-hui,SHENG Hai-bing,GAN Chun-fang,CUI Jian-guo
(College of Chemistry and Materials Science,Guangxi Teachers Education University,Nanning 53001,China)
Abstract:Four novel N,N-dimethylthiosemicarbazone compounds(1~4)were synthesized by condensation reaction of dehydroepiandrosterone,pregnenolone,estrone,3,5-dihydroxy-6-formyl-B-norcholestane with N,N-dimethylthiosemicarbazide,respectively,using EtOH(or MeOH)as solvent and HAc as catalyst.The structures were characterized by1H NMR,13C NMR,IR and HR-EI-MS.The anti-tumor activities of 1~4 against human hepatoma cells(HepG),nasopharyngeal carcinoma cells(CNE-2)and normal kidney epithelial cells(HEK293T)were investigated by MTT method.The results showed that 1~3 had better antiproliferative activities against HepG and CNE-2.
Keywords:sterone; 3,5-dihydroxy-6-formyl-B-norcholestane; steroidal N,N-dimethylthiosemicarbazon; synthesis; anti-tumor activity
作者简介:黄燕敏(1973-),女,汉族,广西隆安人,博士,教授,硕士生导师,主要从事甾体化合物的制备和抗肿瘤活性研究。
基金项目:国家自然科学基金资助项目(21462009);南宁市科技开发项目(20145203)
收稿日期:2015-09-09
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.12.1106 *
文献标识码:A
中图分类号:O629.21; R914.5

