抗真菌肽Drosomycin在原核生物表达系统中的可溶性表达
吴文梅 李彩婷 杨婉莹*
(华南农业大学动物科学学院,广州 510642)
真菌是生物界中很大的一个类群,现已发现对人类有致病性的真菌约有300多个种类[1]。市面上所用抗真菌类药物,副作用大,易产生抗药性[2]。而抗真菌肽却有望解决这些弊端。
抗真菌肽Drosomycin来自于果蝇,属于天然蛋白质,相对分子质量小,热稳定性好,遇水易溶解,可作为抗生素的替代品,为我们解决抗生素耐药性提供新材料[3][4]。杨婉莹等从2002年开始对抗真菌肽及其家族蛋白的研究,结果表明Drosomycin对丝状病原真菌具有广谱的抑制活性,可以作为新的抗真菌药物的靶标[5][6][7]。但Drosomycin在果蝇体内含量极微,天然资源有限,提取步骤烦琐、成本高,得率低,不利于工业生产[8]。因此利用分子生物学技术进行体外表达成为研究热点。
Drosomycin成熟肽包括44个氨基酸,其中8个半胱氨酸形成4对二硫键,由于结构的复杂性,在利用原核系统表达该蛋白时往往形成包涵体,后续纯化复性步骤复杂,不利于实际利用。本实验利用大肠杆菌原核生物表达系统,通过对冷休克表达载体pcold TF进行改造,实现Drosomycin体外的可溶性表达,为下一步生产应用奠定基础,同时为探索富含二硫键的蛋白在体外的分离纯化提供一条线索。
1 材料与方法
1.1 材料,质粒
果蝇细胞sf9由本实验室保存,大肠杆菌E.coli(DH5α)感受态细胞,BL21(DE3)感受态细胞均购自北京天根生物公司;质粒pCold TF由崔玉宝教授赠送。
1.2 酶类及其他试剂
胰蛋白胨(Tryptone)、酵母抽提物(Yeast Extract)、氯化钠(NaCl)为上海生物生工有限公司产品;氨苄青霉素(Ampicillin,Amp)、异丙基硫代β-D半乳糖苷(IPTG)、X-gal、预染蛋白Marker购自广州翔博生物技术有限公司;蛋白质 Maker、RNA酶A,Western blot膜封闭液购自北京天根生物公司;Trizol Reagents总RNA抽提试剂盒,各规格DNA Marker、限制性内切酶(NdeⅠ、XhoⅠ)、PCR聚合酶、反转录用试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)、T4 DNA ligase、pMD19-T 载体、Primer-STAR DNA 聚合酶、dNTP Mixture(各 10 mmol/L)均购自TaKaRa宝生物工程(大连)有限公司;鼠抗Penta-His抗体购置碧云天生物技术有限公司;HRP-兔抗鼠结合物购自北京全式金生物技术有限公司;Ni-NTA亲和层析填料镍购自伯乐生物科技有限公司。其他化学试剂均是国产分析纯。
1.3 方法
1.3.1 果蝇细胞sf9的DNA提取
取实验室培养的果蝇细胞sf9,待平板长到80%-90%时,加入Trizol裂解细胞,随后将平板中的细胞转入1.5 ml的EP管中,按照常规方法氯仿/异丙醇步骤变性蛋白质,抽提其RNA[9],最后利用试剂盒将其反转录成DNA,于-20℃保存。
1.3.2 抗真菌肽Drosomycin基因的PCR扩增
根据 NCBI上已登录 (NM079177)的Drosomycin(Drs)基因序列设计了一对引物,上游引物 Drs-F:5’-CGCCATATGGACTGCCTGTCCGG-3’(横线所示为NdeⅠ酶切位点),下游引物 Drs-R:5’-CCGCTCGAGTTAGCATCCTTCGCA-3’(横线所示为 XhoⅠ酶切位点),引物由上海生物生工有限公司合成。
以抽提果蝇的DNA为模板,用上述引物扩增Drs编码基因,PCR反应体系包括TaKaRa Taq (5 U/μl) 0.25 μl;10×PCR Buffer(Mg2+Plus)5 μl;dNTP Mixture(各2.5 mM) 4 μl;上游引物(20 μM)1 μl;下游引物(20 μM) 1 μl;cDNA First-strand 1μl,添加灭菌ddH2O至总体积为50 μl。PCR反应:预变性98℃ 5 min,变性98℃30 s,退火 55 ℃ 30 s,延伸 72 ℃ 30 s,32个循环,延伸72℃ 10 min。扩增产物经1.2%琼脂糖凝胶电泳后,用天根胶回收试剂盒切胶回收目的基因。
1.3.3 重组载体pCold TF-Drs的构建
质粒pCold TF和体外扩增的目的基因Drs用限制性内切酶Nde I和XhoI进行双酶切,50 μl酶切体系为:质粒DNA/Drs 30 μl,10xH bueffr 5 μl,XhoI 2.5 μl,NdeI 2.5 μl,加 ddH2O 10 μl补足 50 μl酶切体系,37℃酶切8 h。1.2%琼脂糖凝胶电泳鉴定酶切产物,在紫外灯下用无菌手术刀片切下线状载体DNA和PCR产物的条带,按胶回收试剂盒说明书操作,回收目的载体片段和PCR产物。将Drs的酶切纯化产物和表达载体pCold TF的酶切纯化产物于16℃连接8 h,反应体系10 μl:PCR纯化产物5 μl,pCold TF 酶切产物 3 μl,T4 ligase 1 μl,T4 ligase buffer 1 μl. 然后转化进大肠杆菌DH 5α感受态细胞。将通过菌液PCR鉴定成功的重组质粒送上海生工测序。
1.3.4 重组载体pCold TF-Drs的诱导表达及SDS-PAGE鉴定
将测序正确的pCold TF-Drs转化到大肠杆菌BL21(DE3)感受态细胞中,利用含有Amp(氨苄青霉素)抗性的平板筛选阳性重组子。将筛选成功的含有pCold TF-Drs重组菌BL21(DE3)单菌落,接种到LB培养基中,37℃培养箱过夜振荡培养,然后取菌液按1:100体积比转接LB培养基,37℃振荡培养3 h至 OD600nm=0.4-0.5左右,添加IPTG 0.5 mM进行诱导表达,15℃培养24 h。收集细菌,用适量PBS重悬后进行超声破碎,超声6 s,间隔10 s,超声90次,菌体破碎液用低温离心机进行收集,10 000 r/min,4℃,离心30 min,分别取全蛋白、超声破碎上清、超声破碎沉淀各16 μl,加入4 μl 5X SDS loading buffer,100℃加热10 min变性蛋白,用12%聚丙烯酰胺凝胶进行SDS-PAGE电泳,结束后用考马斯亮蓝G250染色。
1.3.5 Western blot鉴定
按上述方法进行SDS-PAGE,然后将蛋白转至PVDF膜,电泳仪参数设置为电压100 V,70 min,将PVDF膜置于含5%脱脂奶粉中,至摇床上室温封闭30 min;倒出封闭液,加入4 ml脱脂奶粉稀释的一抗(抗His标签鼠单抗),稀释比例为1:1 000,尽可能排除气泡,于摇床4℃杂交过夜。使用后回收一抗;去除一抗后将膜用20 ml TBST清洗3次,每次置于摇床清洗10 min;将膜置于新的平皿中,加入4 ml脱脂奶粉稀释的二抗(HRP标记山羊抗小鼠IgG),稀释比例为1:1 000,至摇床上室温孵育2 h以上;去除一抗后将膜用20 ml TBST清洗3次,每次置于摇床清洗10 min;将洗好的PVDF膜置暗房中,滴加发光液进行化学发光显色,X光胶片曝光显影定影后保存胶片。
1.3.6 融合蛋白的分离纯化
重组融合蛋白的纯化是通过Ni-NTA亲和层析柱完成,具体过程主要包括以下步骤:先取一定量的Ni-NTA填料,加到柱子里,用10个柱体积的PBS对柱子进行洗涤与平衡;盖紧下面的帽子,取超声破碎的上清加入到柱子中,盖紧上面的帽子,4℃,旋转混匀30 min;固定柱子,摘掉两个帽子,让溶液全部自然流下,收集样品,用于检验;用含有25 mM咪唑的PBS清洗柱子,直到OD280没有变化时,停止洗涤;分别用含有25 mM,50 mM,100 mM,150 mM,300 mM 咪唑 Tris洗脱柱子上的目的蛋白,收集蛋白,通过SDS-PAGE进行染色检测是否干净;用含有1 M咪唑的Tris,清洗柱子,使柱子上的蛋白完全洗下来;用0.5 M NaOH清洗柱子;用20%酒精保存柱子。分别检验不同浓度的咪唑洗脱液中的蛋白,取收集的各管蛋白制样,进行SDS-PAGE检测,检测洗脱目的蛋白的最适咪唑浓度。
2 结果与分析
2.1 重组载体pCold TF-Drs的构建
以果蝇的DNA为模板,PCR扩增目的基因Drosomycin,电泳检测目的条带符合预期大小(图1)。切胶回收目的条带,酶切后连接到pCold TF载体上,转化大肠杆菌DH5α感受态细胞(图2),将构建成功的重组载体pCold TF-Drs送上海生物生工公司测序,结果与预期的一致。
2.2 质粒pCold TF-Drs原核表达及鉴定
取测序成功的重组质粒pCold TF-Drs转化BL21(DE3)感受态细胞中,挑取单菌落培养至OD600为0.4用IPTG进行诱导,15℃培养24 h,离心收集菌体超声破碎,收集样品进行SDS-PAGE电泳,并进行Western-blotting检测,结果如图3、图4所示。从图中可以看出融合蛋白TF-Drs表达的蛋白质相对分子质量大小为60 ku(所含Drs为5 ku),与预期结果一致。Western blot结果也显示携带His标签的融合蛋白可以与鼠抗Penta-His抗体识别。
2.3 融合蛋白pCold TF-Drs的分离纯化
将15℃表达的细菌裂解液上清,通过Ni-NTA柱亲和层析纯化,洗脱咪唑浓度梯度依次为20 mM、40 mM、60 mM、300 mM。分别取每个浓度梯度的洗脱液,进行12%SDS-PAGE检测,检测结果如图5所示,可见:细菌裂解液上清中呈可溶性表达,融合蛋白pCold TF-Drs在Ni-NTA柱洗脱咪唑浓度为300 mM时,洗脱纯化效果最好。经Ni-NTA柱亲和层析纯化,获得300 mM咪唑的洗脱液,进一步使用分子筛SephadexP-10层析柱去除咪唑和脱盐。脱盐后的融合蛋白再使用10 KDa的超滤管进行超滤浓缩,获得的融合蛋白pCold TF-Drs经SDS-PAGE检测,表明融合蛋白得到很好的纯化(图6)。

图1 目的基因Drs扩增电泳图

图2 pCold TF与Drs双酶切回收电泳图
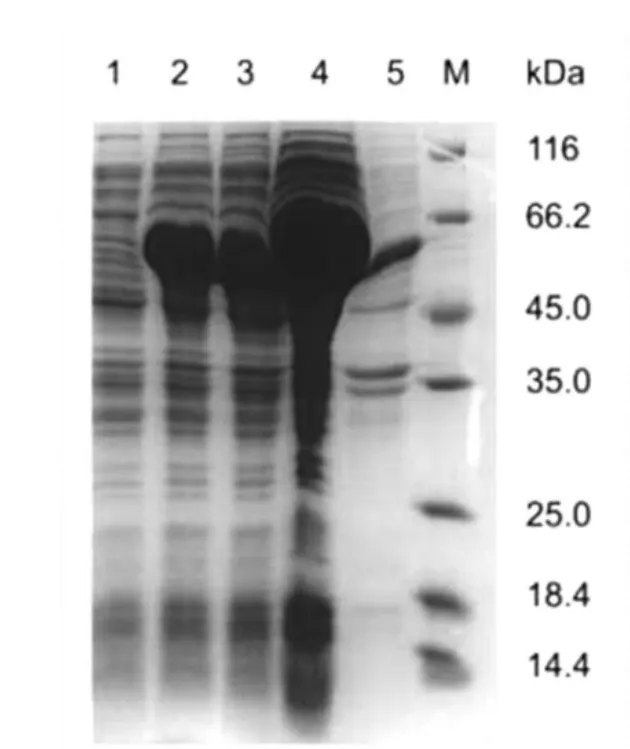
图3 融合蛋白TF-Drs的SDS-PAGE检测
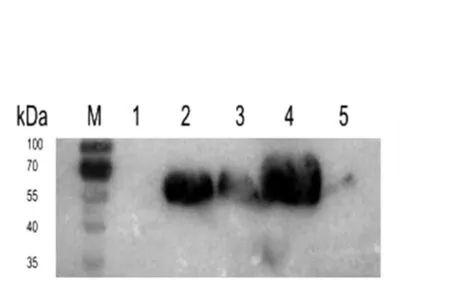
图4 融合蛋白TF-Drswestern blot检测

图5 融合蛋白TF-Drs的Ni-NTA纯化

图6 融合蛋白TF-Drs的脱盐纯化
3 讨论与结论
大肠杆菌原核生物表达系统由于其生长周期短,生长速度快,转化外源DNA操作简单,可以大规模发酵培养,被认为是一种体外合成重组蛋白最简单的外源表达系统,但是多数情况下外源表达产物形成非活性的包涵体蛋白,不利于后续实验[10]。本实验室前期构建过pET 3C-Drs表达质粒,转化进大肠杆菌BL21(DE3)后,目的蛋白主要以包涵体的形式表达,需要变性,复性,不利于生产操作[11]。pCold TF-Drs作为表达载体与pET系列载体对比而言,它具有TF标签可以促进目的蛋白的可溶性表达,纯化简单,标签容易移除。同时,它还是是一个低温冷休克表达载体,表达目的蛋白稳定[12]。
通过本次实验,确定了将目的基因抗真菌肽Drosomycin定向克隆到原核生物表达载体pCold TF后,将构建正确的重组载体pCold TF-Drs转化大肠杆菌 BL21(DE3),IPTG诱导外源蛋白表达,SDS-PAGE电泳检测发现获得的目的蛋白相对分子质量单位为60 kDa,与预期值(55 kDa+5 kDa=60 kDa)相一致。Western Blot结果也表明,该蛋白可被鼠抗His抗体识别,表明在大肠杆菌BL21(DE3)中的表达的蛋白是目的蛋白。通过超声破碎 pCold TF-Drs转化菌(BL21),用SDS-PAGE显示其大部分在上清中,表明是可溶性表达。
本实验成功构建了重组质粒pCold TF-Drs,实现了目的蛋白在原核生物表达系统中的可溶性表达,为下一步酶切纯化出抗真菌肽Drosomycin实现生产上的利用,对植物类病原真菌的抑菌活性检测,药理药效的研究以及开发抗真菌药物奠定了基础。
[1]Liao W Q,Wu S X.Fungi Disease Research Progress[J].Shanghai Publis hing House of Second Military Medical U-niversity,1998.
[2]郝飞,叶庆佾.抗真菌药物作用靶位的研究进展[J].中国皮肤性病学杂志,2001,15(2):123-124.
[3]张学敏,金莉莉,王铮,等.抗菌肽在大肠杆菌中的融合表达[J].生物工程学报,2014(08):117.
[4]Meister M,Lemaitre B,Hoffmann J A,et al.Drosophila responds to a septic injury by the rapid synthesis of antimicrobial[J].Bioessays,1997,19(11):10-19.
[5]Yang W Y,Wen S Y,Huang Y D,et al.Functional divergence of six isoforms of antifungal peptide Drosomycin in Drosophila melanogaster[J].Gene,2006,379:26-32.
[6]钟仰进,肖业臣,魏剑波,等.果蝇 Drosomycin 基因(drs)的克隆鉴定[J].蚕业科学,2004,30(1):85-89.
[7]肖业臣,温硕洋,黄亚东,等.昆虫抗菌肽和抗真菌肽结构与功能的关系及分子设计[J].昆虫学报,2004(05):659-669.
[8]Lemaitre B,Reichhart J,JμLes A,et al.Drosophila host defense:Differentialinduction ofantimicrobialpeptide genes after infection by various classes of microorganisms[J].Proc.Natl.Acad.Sci.1997,94:14614-14619.
[9]Sambrook.J.MolecμLar Cloning[M].科学出版社,2008:1949.
[10]Rosano G L,Ceccarelli E A.Recombinant protein expression in Escherichia coli:advances and challenges[J].Frontiers in microbiology,2014,5:172-189.
[11]桑延霞,邓小娟,杨婉莹,等.昆虫抗真菌肽基因的分泌型表达及活性鉴定[J].中国农业科学,2007,40(4):842-849.
[12]Saini P,Wani S I,Kumar R,et al.Trigger factor assisted folding of the recombinant epoxide hydrolases identified from C.pelagibacter and S.nassauensis[J].Protein Expression and Purification,2014,104:71-84.

