养殖曼氏无针乌贼(Sepiella japonica)的两性异形及判别模式的建立*
史会来 平洪领 张 涛 吕振明 孟 浩 余方平①
(1. 浙江省海洋水产研究所 浙江省海水增养殖重点实验室 舟山 316021; 2. 浙江海洋大学 国家海洋设施养殖工程技术研究中心 舟山 316004)
曼氏无针乌贼(Sepiella japonica)隶属软体动物门(Mollusca)、头足纲(Cephalopode)、乌贼目(Sepioidea)、乌贼科(Sepiidae)、无针乌贼属(Sepiella),是我国重要的海洋渔业经济种类之一, 曾是东海“四大海产”之一, 历史最高年产量仅浙江就达 6万吨以上(董正之, 1988)。但20世纪70年代末以来, 由于过度捕捞和水域条件的破坏, 其资源量衰退严重; 80年代中后期, 浙江沿海渔场曼氏无针乌贼已经无法形成渔汛(吴常文等, 2010)。国内外学者对曼氏无针乌贼主要在资源状况(唐逸民等, 1986)、生物学(蒋霞敏等, 2007; 蒋霞敏等, 2008; 常抗美等, 2008; 张建设等, 2011)、繁殖习性(Wada et al, 2006; 吴常文等,2010)及增养殖技术(Wu et al, 2010; 平洪领等, 2015)等领域开展了研究。自 2006年以来, 浙江省开展了曼氏无针乌贼受精卵和幼体的大规模增殖放流(李继姬等, 2011)。统计数据表明, 增殖放流工作行之有效,在大规模放流之后取得了一定的增殖效果。随着增殖放流任务的开展, 对曼氏无针乌贼优质亲体的培育工作提出了更高的要求。但有关曼氏无针乌贼优质亲体选择途径的研究尚未见报道。
对曼氏无针乌贼进行形态学分析是养殖及育种研究的重要内容, 也是开展性别差异分析与性别鉴定的基础。通过识别亲体的雌雄性别, 不仅可以降低亲体培育的饲养成本, 也能减少亲体采捕的数量和费用, 是人工育苗的重要前提之一(Okamura et al,2008)。另外, 在鱼类养殖中性别二态性显示出明显的生长速率差异, 可通过性别调控实现单性化养殖(李明辉, 2014), 单性养殖也是解决性早熟、繁殖快、密度大、生长缓慢、规格不均匀等一系列阻碍规模化生产问题的理想方法(Dunham, 1990; 高泽霞, 2010)。在曼氏无针乌贼养殖生产过程中存在残食现象, 特别是在性成熟交配期, 雄性为争夺交配权, 而发生打斗现象(吴常文等, 2010), 导致雄性在繁殖期的死亡率较高(Correia et al, 2005)。因此这些问题都制约着曼氏无针乌贼人工规模化养殖业的发展。
目前对头足类形态学的研究主要集中在不同群体比较: 陈新军等(2002)、李思亮等(2010)、陈峰等(2011)通过形态学的方法对太平洋不同地理位置的柔鱼进行了比较研究; 郑小东等(2002)对华南沿海的曼氏无针乌贼(Sepiella maindroni)进行了表型变异分析;Kassahn等(2003)采用分子标记和形态学的方法对澳大利亚巨型乌贼(Sepia apama)群体结构和物种地位进行了研究; Tehranifard等(2011)采用形态学方法对虎斑乌贼(Sepia pharaonis)进行群体划分。而对于曼氏无针乌贼雌雄个体间主要形态指标差异却未见详细报道, 因此, 本文借助聚类分析、主成分分析和判别分析方法, 较系统地对 80对曼氏无针乌贼养殖群体的 19项计量性状和 11项标准化性状进行了分析,旨在从外形特征上为雌雄性别的鉴定提供一套简易便捷的判别方法。
1 材料与方法
1.1 材料
2015年 6月在浙江省海洋水产研究所试验场曼氏无针乌贼养殖车间, 随机选取 80对正在交配的曼氏无针乌贼, 所取样本来自本试验场的 F1代同生养殖群体; 2015年12月又从F2代中随机抽取55只曼氏无针乌贼成体, 用于Fisher判别函数式对养殖群体的识别正确率的验证。
1.2 生物学指标测定及形质评价指标计算
本文参照陈新军等(2002)对西北太平洋柔鱼(Ommastrephes bartramii)及 Tehranifard 等(2011)对虎斑乌贼(Sepia pharaonis)形态指标的测定方法, 用数显游标卡尺测量曼氏无针乌贼的全长(从最长腕的最前端至胴部的最末端, TL)、胴长(自胴部背面中线最前端至最末端, ML)、胴宽(胴部背面最大宽度, MW)、体高(胴部的背面至腹面最大的垂直距离, BD)、眼间距(左右上眼睑内侧缘间的水平距离, IS)、眼径(眼睛的上下最大距离, VED)、头长(自头的最末端至腕的最末端, HL)、头宽(头部的最大宽度, HW)、头高(头部背面至腹面的最大高度, HH)、腕长(自腕的最末端至最前端的距离。以头部背面中线为基准, 由中间至左边的腕长依次为: 左 1腕长, LTL1; 左 2腕长,LTL2; 左3腕长, LTL3; 左4腕长, LTL4)、左触腕长(自触腕的最末端至最前端, LTL)等14个形态指标(如图1A, B), 测量数据结果精确到0.01mm。重量性状指标依次为: 总体重(TBW)、净体重(NBW)、海螵蛸重(CW)、肝脏重(LW)、性腺重(GW)等5项重量指标,所用电子天平精确到0.01g。
1.3 数据处理与分析
为消除个体大小差异对参数值的影响, 将采集到的 80对样本的躯干部量度性状除以胴长, 头部量度值除以头长, 脏器重量除以体重, 以及肥满度(K),共计14个标准化性状。对所得数据进行主成分分析,根据 R-聚类分析和逐步判别分析筛选出雌雄群体间具有显著性差异的性状, 建立曼氏无针乌贼的雌雄判别方程。根据所建立的判别方程, 对重新采集的样品数据进行检验, 对照实际解剖的性别信息, 检验方程的可靠性。以上测量值及标准化指标参数均用平均值±标准差(X±SD)的形式表示, 使用 Excel 2010和SPSS 19.0统计分析软件进行分析, 采用 t检验,P<0.05为显著水平。
其中, 脏器系数的表达式为:
肥满度K=(TBW/ML3)×100; TBW为总体重, ML为胴长。
性腺指数GSI=GW/TBW×100%; GW为性腺重,TBW为总体重。
肝体指数HIS=LW/TBW×100%; LW为肝脏重量,TBW为总体重。
出肉率MR=NBW/TBW×100%; NBW为净体重,TBW为总体重。
2 结果与分析
2.1 曼氏无针乌贼求偶和抱对行为观察
通过观察录像记录可以发现, 雄性曼氏无针乌贼具有明显的求偶行为, 可以分为三个阶段: (1) 自我展示和追逐行为, 发育成熟的雄性背部体色较雌性更为鲜艳, 背部白色斑纹以及鳍基部的白色连续纹路更加明显。同时, 高举第一对腕逐渐接近雌性以吸引注意力。在求偶的过程中, 雄性处于主动选择和追求的位置, 而雌乌贼具有接受和逃避配对的行为。一旦成熟的雄性个体选定了雌性, 便会对雌性展开穷追不舍的追逐过程, 如果雌乌贼接受了雄性的求偶行为, 便会出现伴游行为, 即雄性会伴随雌性一起游动, 当有其它雄性乌贼靠近时, 雄性会伸展开长长的4对腕, 驱赶其它雄乌贼靠近。这种伴游行为可以有效防止其它雄性抢夺雌性。(2) 争斗行为, 在雄性之间会为争夺同一只雌性, 而发生同性间的争斗。雄性伸展开的4对腕, 不仅可以用来吸引雌性, 同时还具有威慑其它雄性的作用。(3) 交配行为, 在雄性跟随雌性伴游一段时间后, 如果雌性没有过激反应, 反而表现出很温和的状态。表明雌性已接受求偶行为。雌雄便可以进行交配, 曼氏无针乌贼采用头对头式的交配方式(如图 1b): 雌雄乌贼头部相对, 雄性用第一对、第二对腕固定雌性的头部, 然后利用茎化腕将精荚输送到雌性乌贼的纳精囊中, 一般交配时间为5—15s交配后的雄性仍伴随在雌性周围, 阻扰其它雄性与之交配。

图1 曼氏无针乌贼的形态测量指标示意图及交配方式Fig.1 The morphological metric traits and mating mode of S. japonica
2.2 两性形态指标间的差异比较
本实验共抽取了抱对的曼氏无针乌贼 80对, 测量形态指标的描述性统计表见表1。雌雄亲体间在生物学测量指标方面存在差异, 主要表现在: (1) 从测量长度指标来分析, 雄性在全长、眼径、左1腕长、左2腕长、左3腕长及左4腕长共计6项形态指标的测量值显著大于雌性(P<0.05), 其余 8项指标的测量值与雌性均无显著性差别(P>0.05)。除体宽、体高及眼间距的测量值的变异系数小于雌性外, 其余 11项指标的测量值的变异系数均大于雌性。表明雄性在外观上大于雌性个体, 并且依靠腕长捕获食物的能力强于雌性性, 而雌性的体型性状的稳定性则强于雄性。(2) 由质量性状的指标测量值来看, 雄性的总体重及净体重的测量值都显著大于雌性(P<0.05), 而在海螵鞘及性腺重方面显著小于雌性(P<0.05)。雌雄个体的质量性状的变异系数均较大。
2.3 两性亲体标准化性状间的差异比较
由表2可知, 经标准化处理后的雌雄两性亲体的相对性状间存在一定异同。主要表现在: (1) 从长度方面的标准化性状看, 雄性的腕长/胴长、头宽/头长及眼径/头长的比值显著高于雌性(P<0.05)。(2) 从脏器与体重的比值方面来看, 雄性的出肉率显著大于雌性(P<0.05), 而性腺指数和肝体指数却显著小于雌性(P<0.05)。综上所述, 雄性的 4对腕长与胴长的比值均大于雌性, 这与曼氏无针乌贼交配时采取4对腕相抱的方式相关。说明曼氏无针乌贼在繁殖期选择配偶时, 雄性具有优先选择的主动权, 同时与雄性为争夺配偶时的打斗行为相适应。雌性在性成熟时期主要将能量分配在繁殖后代, 而雄性主要用于生长。
2.4 形态特征的主成分分析
由表3可知, 通过80对抱对曼氏无针乌贼亲体的 11个标准化性状进行主成分分析后, 得到前 4个主成分贡献率, 以及各指标相应的负荷量。由于所列4个主成分的特征值均大于 1, 且前4个主成分的累积贡献率已达86.494%, 故可以认定它们能代表本研究的公共因子, 可以舍去其余部分的主成分结果。其中, 主成分 I的贡献率最大, 为 39.191%。负荷量较大的主要是左1腕长/胴长、左2腕长/胴长、左3腕长/胴长及左 4腕长/胴长等 4个标化性状, 主要反映的是辅助交配的器官特征。主成分 II的贡献率为20.986%, 负荷量较大的主要是眼间距/头长和眼径/头长2个标化性状, 反映的主要是头部特征。主成分III的贡献率为16.763%, 负荷量较大的主要是左触腕长/胴长、肥满度及头宽/头长等 3个标化性状, 反映的主要是捕食和肥瘦特征。主成分Ⅳ的贡献率为9.553%, 负荷量最大的是体高/胴长标化性状, 反映的是体型特征。
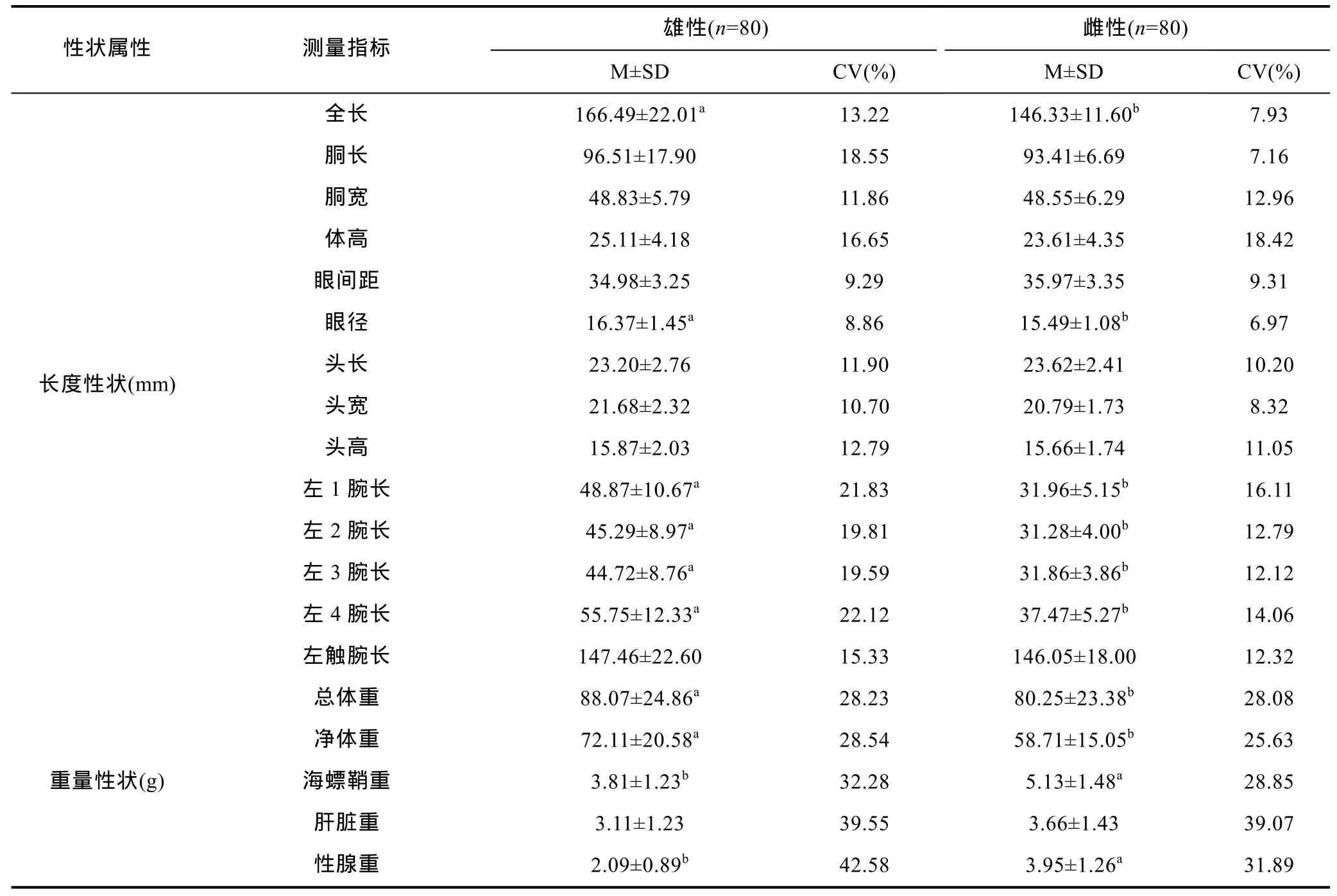
表1 曼氏无针乌贼两性测量性状参数统计Tab.1 Parametric statistics of bisexual parent of S. japonica

表2 曼氏无针乌贼两性亲体的标准化性状参数统计Tab.2 Parametric statistics of morphological evaluation indexes for bisexual parent of S. japonica

表3 前4个主成分的贡献率和各指标的负荷量Tab.3 Contribution of the first four principal components and the load of each factor
2.5 标准化性状的R-聚类分析
由R-聚类分析的结果如图2所示, 经标准化的相对性状可以分为两大类: 第I类为左1腕长/胴长、左2腕长/胴长、左3腕长/胴长、左4腕长/胴长、头宽/头长、眼径/头长及眼间距/头长, 反映了体型特征和头部特征。这一大类可以细化为2小类, 即体现交配功能的性状(左1腕长/胴长、左2腕长/胴长、左3腕长/胴长、左4腕长/胴长)为第一小类; 反映头部特征参数(头宽/头长、眼径/头长及眼间距/头长)为第二小类。第II类为体宽/胴长、左触腕长/胴长、体高/胴长及肥满度, 即主要反映乌贼体型肥瘦的特征参数。同样, 这一大类也可以细化为2小类, 即体宽/胴长、左触腕长/胴长和肥满度为第三小类; 体高/胴长独自归为第四小类。通过比较 R-聚类分析和主成分析的结果, 可以看出R-聚类划分的第I类标准化性状的两小类分别与主成分析所得的第I主成分和第II主成分的分组相对应, 分别反映体型特征和头部特征; 第II类标准化性状的两小类也分别与第III主成分和第Ⅳ主成分的分组相吻合, 都是反映乌贼肥瘦的参数。
2.6 曼氏无针乌贼雌雄个体的判别分析
使用SPSS 19.0软件对80对曼氏无针乌贼的11项标准化性状进行逐步判别分析, 根据各变量对模型的贡献大小, 逐步剔除不相关变量, 最终筛选出三个变量, 即X3(左 3 腕长/胴长)、X4(左 4 腕长/胴长)和X5(左触腕长/胴长), F检验表明各变量均达到极显著水平(P<0.05)。这三个标准化性状都是反映雌雄乌贼在腕长和胴长比例关系方面的差异。
根据上述 3个变量建立曼氏无针乌贼雌雄两性亲体的Fisher判别函数方程式:
雄性:F1= 223.42X3+ 165.85X4+ 7.951X5-108.06
雌性:F2= 151.48X3+ 92.71X4+ 19.19X5- 60.38
判别函数的显著性检验显示P<0.01, 表明判别函数式已达到极显著水平。直接计算每尾个体的判别分数值, 得到的频布图 3, 可见该模型可有效区分曼氏无针乌贼的性别。利用所建立的判别函数式, 对建方程所用的80对个体进行性别回判。将每尾个体的3个标准化性状数值分别带入函数式, 分别计算得到F1和F2的值。如F1>F2, 则为雄性个体, 反之为雌性。由表4 可知, 仅有8尾乌贼的性别被判断错误, 判误率为5%, 即判断成功率达到95.00%。
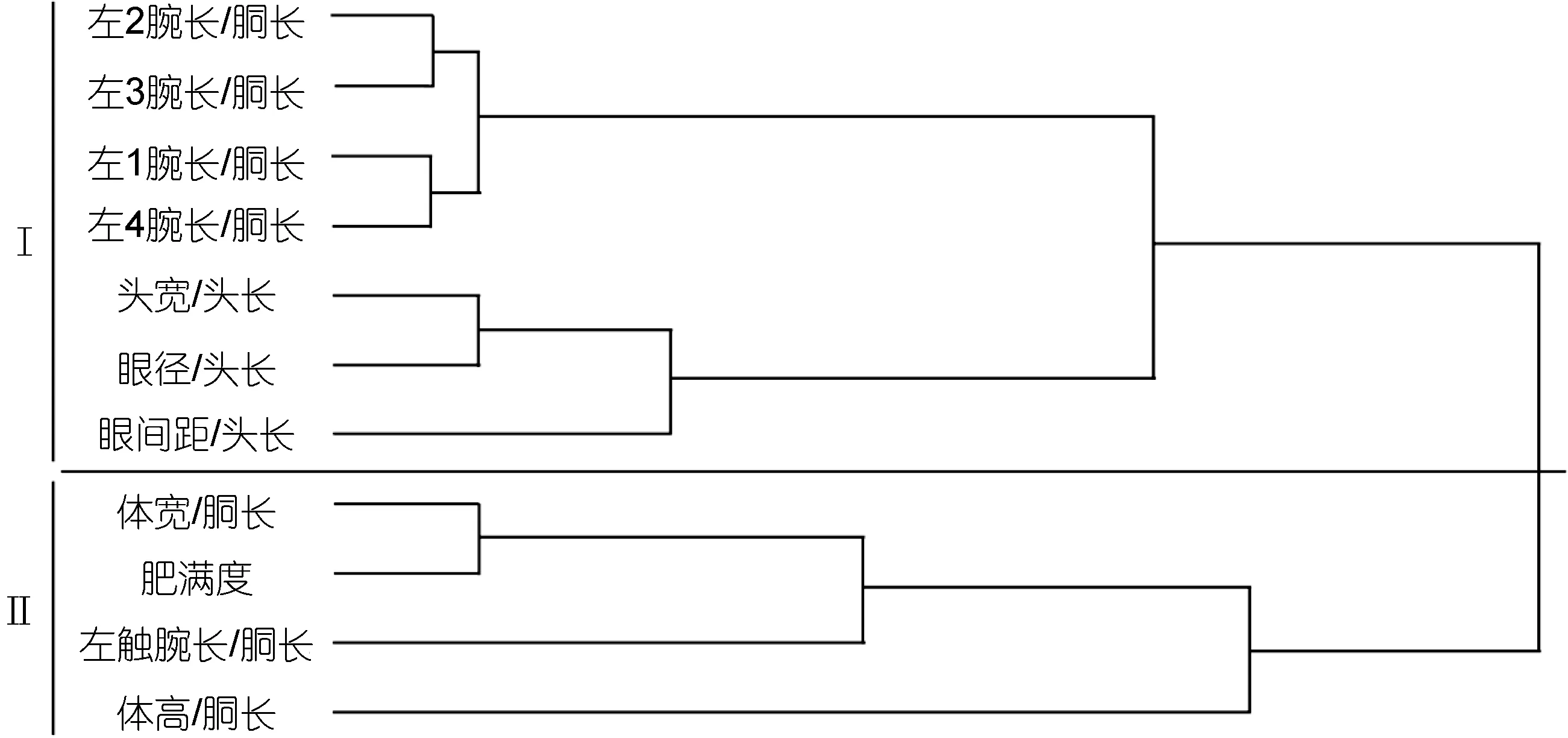
图2 曼氏无针乌贼标准化性状指标R-聚类分析图Fig.2 R-Cluster dendrogram of normalized morphological indexes for S. japonica
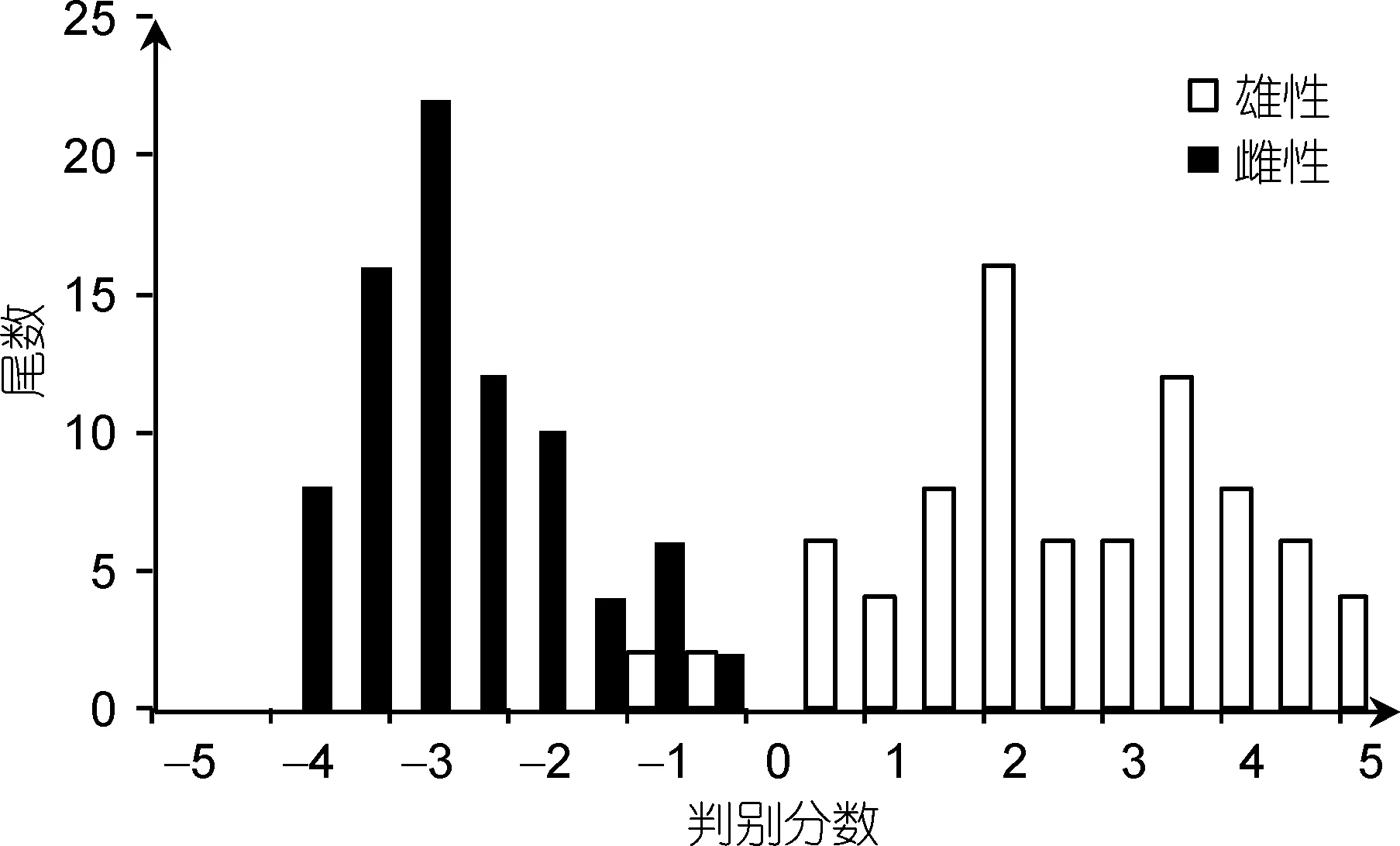
图3 曼氏无针乌贼雌雄判别分数的频布图Fig.3 Distribution of frequency for discriminant scores obtained from male and female S. japonica

表4 判别函数对曼氏无针乌贼雌雄群体识别的准确率Tab.4 Predicted result by discriminant functions and the accuracy
用上述Fisher判别函数式对2015年10月培育的F2代亲体进行雌雄识别。通过对比解剖鉴定性别结果,得到上述 Fisher判别函数式对养殖群体的识别正确率为85.34%, 其中雌性为84.00%, 雄性为86.67%(如表5所示)。
3 讨论
3.1 曼氏无针乌贼两性间性状指标差异的原因分析
动物个体大小的两性异形一般解释为自然选择和性选择等共同作用的结果(Shine, 1989; Pyron, 1996;Hensonet al, 1997; Székelyet al, 2000)。已有资料表明, 水产动物个体大小的两性异形可以分为以下3种类型: (1) 雌性成体大于雄性成体(Mori, 1998; Yatsuet al, 1998; 周伟等, 2006; 郭弘艺等, 2011; 吴波等,2014); (2) 雌性成体小于雄性成体(Snelsonet al, 1972;杨程等, 2015); (3) 雌雄成体大小相近(Pyron, 1996;林植华等, 2007)。如果自然选择对雌性繁殖力的选择作用弱于性选择, 则雄性为了在精子竞争中战胜其它雄性, 就要在体型上大于雌性, 以赢得与雌性的交配权。在性选择中, 雄性应该是进攻的, 雌性则应该是挑剔的(孙儒泳, 2002), 雌性与体形较大的雄性交配获得的后代具更高的适合度(Sullivanet al, 1992)。第1种类型有利于雌体提高繁殖力。第2种和第3种个体大小与雄性个体的交配行为有关。Snelson等(1972)和 Parker等(1992)都认为一个种群的雄性为争夺雌性而格斗和护巢行为, 雄性个体往往会较大。曼氏无针乌贼具有显著的求偶现象, 具有争偶、护卫行为(张炯等, 1965; 吴常文等, 2010), 是一种典型的保证受精率和孵化率的交配策略(Hanlonet al, 1998)。从表1可以看出, 雄性的总体重和全长均显著高于雌性(P<0.05)。曼氏无针乌贼在繁殖过程中性别角色的分化对两性个体大小进化的强烈推动作用。促使雄性变得更加强大以获得交配权, 并担任提高后代成活率的职责。

表5 判别函数式对F2代个体的性别判别结果Tab.5 Results by discrimination for S. japonica of F2
两栖动物在繁殖投入上雄性远低于雌性,较大的雌性个体具较高的生育力和繁殖成功率(杨程等,2015; Angillettaet al, 2000)。在本研究中雌性的性腺指数及肝体指数均显著大于雄性(P<0.05), 而总体重及出肉率却显著小于雄性(P<0.05)。很显然, 雄性曼氏无针乌贼在性选择的压力下, 采取了以增加体重来获得交配权的策略, 但是能量分配策略上却与雌性存在巨大差异。即: 雄性在肌肉建造的能量投入上显著大于雌性, 因此其可以通过增强体能来提高获取食物和交配权的能力, 从而达到顺应性选择压力与提高繁殖适合度的目的。水生动物在不同的生活史阶段采取不同的能量分配方式, 雌性性腺发育成熟期, 为繁殖下一代将组织结构中的能量调配到性腺中。在降海洄游期, 河蟹就采用这种能量分配策略:雌蟹将 34%的能量分配到性腺肝胰腺中, 远高于雄蟹的 23%(刘丹, 2015); 本文中雌性的性腺指数显著大于雄性(P<0.05), 说明成熟期的雌性曼氏无针乌贼的能量分配策略也是将能量用于生殖相关器官的生长。同时, 卵巢中卵母细胞的生长发育与肝脏能量供应间可能存在紧密的应答和传递关系(Redshaw, 1972;王义强等, 1990; 成永旭等, 1998; 平洪领, 2015), 说明曼氏无针乌贼的肝脏所储存的能量与雌性的繁殖功能有关。动物在生活史对策中必然存在着繁殖与生存之间的权衡(Trade-off)问题, 繁殖的耗能即性腺的发育必然影响着生存和生长(Normant et al, 2012)。故雌性曼氏无针乌贼为顺应生育选择压力和提高繁殖适合度必然在繁殖器官方面较雄性投入更多的能量,从而也限制了自身的生长。
头足类为雌雄异体的软体动物, 在雄性向雌体传递精荚的生殖过程中具有对抗、求爱及交配等生殖行为(陈新军等, 2009)。曼氏无针乌贼有较高等复杂的性行为(吴常文等, 2010), 交配方式采用头对头式,交配过程与虎斑乌贼相似, 都是采用第1和第2对腕将雌性的头部包住, 再利用左4的茎化腕将精荚送入雌性的纳精囊(陈道海等, 2013)。在本研究中, 刚好说明了雄性的腕长在交配行为中的进化地位: 雄性的左1腕长、左2腕长、左3腕长及左4腕长均显著大于雌性(P<0.05)。同时, 在排除个体大小差异的情况下, 经过标准化的上述4项腕长指标也同样显著大于雌性(P<0.05)。而且, 在雌雄乌贼的判别方程式的变量中也得以体现, 曼氏无针乌贼在成熟阶段, 在腕长大小上存在明显的两性异形现象, 因此可以通过Fisher判别函数依据左3腕长、左4腕长及左触腕长与胴长之比的标准化指标来判别性别。
3.2 判别模式的建立及应用
雌雄鉴别是鱼类生物学研究的重要内容也是珍稀鱼类保护、人工繁育和增殖等的关键技术之一(吴波等, 2014)。可以通过详细的形态测量方法, 结合生物统计学分析手段, 找到一些形态特征来鉴别雌雄个体的方法(倪海儿等, 2003), 在某些由于发育成熟而造成身体不同程度的外形改变的两性异形水产动物中得到成功应用(Han et al, 2003; 郭弘艺等, 2011;杨程等, 2015)。本研究通过对所取80对曼氏无针乌贼的外观指标测量, 经标准化处理后, 经主成分分析和聚类分析显示, 两者所得的结果基本一致, 因此曼氏无针乌贼雌雄个体差异主要集中在头部形态和体型特征等方面。运用逐步判别法所建立的雌雄判别方程综合识别率达到 95.00%, 表明判别方程所筛选出来的 3个腕长特征可以较好地判别处于交配期的曼氏无针乌贼个体的性别, 而处于未成熟的曼氏无针乌贼是否适合此判别方程有待进一步研究。曼氏无针乌贼雌雄异型为其早期的雌雄鉴定提供了理论依据。虽然, 本实验所建立的判别方程仅需测量3个形态学指标, 即可有效区分交配期的雌雄曼氏无针乌贼, 准确率高达95%。但是已有研究也表明水产动物形态学特征受遗传和环境因子的共同作用(高保全等, 2007;Ihssen et al, 2011), 因此, 建立的判别方程是否适用于其它水域的曼氏无针乌贼种群, 有待进一步研究。
王义强, 黄世蕉, 赵维信, 1990. 鱼类生理学. 上海: 上海科学技术出版社, 192—260
平洪领, 2015. 温度和光照对曼氏无针乌贼繁殖性能的影响.舟山: 浙江海洋学院硕士学位论文, 14—15
平洪领, 王天明, 刘立芹等, 2015. 光照周期对曼氏无针乌贼(Sepiella japonica)繁殖、性类固醇激素系统及生长性能的调控作用. 海洋与湖沼, 46(3): 577—584
成永旭, 堵南山, 赖 伟, 1998. 不同阶段中华绒螯蟹肝胰腺的脂类及脂肪酸组成. 动物学报, 9(4): 420—429
刘 丹, 2015. 中华绒螯蟹的能量分配研究. 上海: 上海海洋大学硕士学位论文, 16—18
孙儒泳, 2002. 基础生态学. 北京: 高等教育出版社, 114
李明辉, 2014. 罗非鱼基因敲除技术的建立及其在性别决定与分化研究中的应用. 重庆: 西南大学博士学位论文,12—14
李思亮, 陈新军, 刘必林等, 2010. 基于形态法的西北太平洋柔鱼种群结构研究. 中国海洋大学学报, 40(3): 43—48
李继姬, 郭宝英, 吴常文, 2011. 浙江海域曼氏无针乌贼资源演变及修复路径探讨. 浙江海洋学院学报(自然科学版),30(5): 381—385
杨 程, 富 裕, 朱卫东等, 2015. 四明山脉溪流区水产经济动物棘胸蛙(Paa spinosa)同生群两性亲体间的形质差异.海洋与湖沼, 46(4): 853—861
吴 波, 张敏智, 邓思平等, 2014. 金钱鱼雌雄个体的形态差异分析. 上海海洋大学学报, 23(1): 64—69
吴常文, 董智勇, 迟长凤等, 2010. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究. 海洋与湖沼,41(1): 39—46
张 炯, 卢伟成, 1965. 曼氏无针乌贼 Sepiella maindroni de Rochebrune繁殖习性的初步观察. 水产学报, 2(2): 35—44
张建设, 夏灵敏, 迟长凤等, 2011. 人工养殖曼氏无针乌贼(Sepiella maindroni)繁殖生物学特性研究. 海洋与湖沼,42(1): 55—59
陈 峰, 陈新军, 陆化杰等, 2011. 北太平洋中东部 2个海区柔鱼生物学特性比较研究. 上海海洋大学学报, 20(5):759—764
陈道海, 郑亚龙, 2013. 虎斑乌贼(Sepia pharaonis)繁殖行为谱分析. 海洋与湖沼, 44(4): 931—936
陈新军, 田思泉, 叶旭昌, 2002. 西北太平洋柔鱼种群的聚类分析. 上海水产大学学报, 11(4): 335—341
陈新军, 刘必林, 王尧耕, 2009. 世界头足类. 北京: 海洋出版社, 60—64
林植华, 雷焕宗, 陈利丽等, 2007. 棒花鱼形态特征的两性异形和雌性个体生育力. 四川动物, 26(4): 910—913
周 伟, 贺佳飞, 李明会等, 2006. 多疣狭口蛙昆明种群雌雄配对行为及形态适应选择. 动物学研究, 27(2): 169—174
郑小东, 王如才, 刘维青, 2002. 华南沿海曼氏无针乌贼Sepiella maindroni表型变异研究. 青岛海洋大学学报,32(5): 713—719
倪海儿, 陈 欣, 2003. 鳓形态指标体系分析及雌雄鉴别模型.生物数学学报, 18(2): 224—228
高泽霞, 2010. 蓝鳃太阳鱼性控和性决定机制以及性别相关分子标记的研究. 武汉: 华中农业大学博士学位论文,23—25
高保全, 刘 萍, 李 健等, 2007. 三疣梭子蟹 4个野生群体形态差异分析. 中国水产科学, 14(2): 223—228
郭弘艺, 魏 凯, 谢正丽等, 2011. 长江口银色鳗的形态指标体系及其雌雄鉴别. 水产学报, 35(1): 1—9
唐逸民, 吴常文, 1986. 曼氏无针乌贼生物学特性及渔场分布变化. 浙江水产学院学报, 5(2): 165—170
常抗美, 吴常文, 吕振明等, 2008. 曼氏无针乌贼(Sepiella maindroni)野生及养殖群体的生化特征及其形成机制的研究. 海洋与湖沼, 39(2): 145—151
董正之, 1988. 中国动物志—软体动物门, 头足纲. 北京: 科学出版社, 1—43
蒋霞敏, 符方尧, 李 正等, 2007. 曼氏无针乌贼的卵子发生及卵巢发育. 水产学报, 31(5): 607—617
蒋霞敏, 符方尧, 李 正等, 2008. 人工养殖曼氏无针乌贼生殖系统的解剖学与组织学研究. 中国水产科学, 15(1):63—72
Angilletta M J Jr, Sears M W, 2000. The metabolic cost of reproduction in an oviparous lizard. Functional Ecology,14(1): 39—45
Correia M, Domingues P M, Sykes A et al, 2005. Effects of culture density on growth and broodstock management of the cuttlefish, Sepia officinalis (Linnaeus, 1758).Aquaculture, 245(1—4): 163—173
Dunham R A, 1990. Production and use of monosex or sterile fishes in aquaculture. Reviews in Aquatic Sciences, 2(1):1—17
Han Y S, Liao I C, Huang Y S et al, 2003. Synchronous changes of morphology and gonadal development of silvering Japanese eel Anguilla japonica. Aquaculture, 219(1—4):783—796
Hanlon R T, Messenger J B, 1998. Cephalopod Behaviour.Cambridge: Cambridge University Press, 91—97, 101—110
Henson S A, Warner R R, 1997. Male and female alternative reproductive behaviors in fishes: a new approach using intersexual dynamics. Annual Review of Ecology and Systematics, 28: 571—592
Ihssen P E, Booke H E, Casselman J M et al, 2011. Stock identification: materials and methods. Canadian Journal of Fisheries and Aquatic Sciences, 38(12): 1838—1855
Kassahn K S, Donnellan S C, Fowler A J et al, 2003. Molecular and morphological analyses of the cuttlefish Sepia apama indicate a complex population structure. Marine Biology,143(5): 947—962
Mori J, 1998. Neon flying squid (Ommastrephes bartrami)occurred in subtropical Japanese waters in winter. Shimizu:National Research Institute of Far Seas Fisheries, 81—91
Normant M, Król M, Jakubowska M, 2012. Effect of salinity on the physiology and bioenergetics of adult Chinese mitten crabs Eriocheir sinensis. Journal of Experimental Marine Biology & Ecology, 416—417(1): 215—220
Okamura A, Zhang H, Mikawa N et al, 2008. Decline in non-native freshwater eels in Japan: ecology and future perspectives. Environmental Biology of Fishes, 81(3):347—358
Parker G A, 1992. The evolution of sexual size dimorphism in fish. Journal of Fish Biology, 41(sB): 1—20
Pyron M, 1996. Sexual size dimorphism and phylogeny in North American minnows. Biological Journal of the Linnean Society, 57(4): 327—341
Redshaw M R, 1972. The hormonal control of the amphibian ovary. Integrative & Comparative Biology, 12(2): 289—306 Shine R, 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence. The Quarterly Review of Biology, 64(4): 419—461
Snelson Jr F F, 1972. Systematics of the subgenus Lythrurus,genus Notropis (Pisces: Cyprinidae). Bulletin of the Florida State Museum, Biological Science, 17(1): 1—92
Sullivan B K, Hinshaw S H, 1992. Female choice and selection on male calling behaviour in the grey treefrog Hyla versicolor. Animal Behaviour, 44(4): 733—744
Székely T, Reynolds J D, Figuerola J, 2000. Sexual size dimorphism in shorebirds, gulls, and alcids: the influence of sexual and natural selection. Evolution, 54(4): 1404—1413
Tehranifard A, Dastan K, 2011. General morphological characteristics of the Sepia pharaonis (cephalopoda) from Persian Gulf, Bushehr region. In: Proceedings of International Conference on Biomedical Engineering and Technology. Singapore: ACSIT Press, 11: 120—126
Wada T, Takegaki T, Mori T et al, 2006. Reproductive behavior of the Japanese spineless cuttlefish Sepiella japonica. Venus:Journal of the Malacological Society of Japan, 65(3):221—228
Wu C W, Chi C F, He G Y et al, 2010. Isolation via enrichment and characterization of ten polymorphic microsatellite loci in the cuttlefish, Sepiella maindroni de Rochebruns. Acta Oceanologica Sinica, 29(6): 121—124
Yatsu A, Tanaka H, Mori J, 1998. Population structure of the neon flying squid, Ommastrephes bartramii, in the North Pacific Ocean. In: Okutani T ed. Contributed Papers to International Symposium on Large Pelagic Squids. Tokyo:Japan Marine Fishery Resources Research Center, 31—48

