南黄海夏季软体动物群落结构特征*
张鹏弛 徐 勇 李新正① 王洪法 安建梅 张宝琳 帅莲梅
(1. 山西师范大学 生命科学学院 临汾 041000; 2. 中国科学院海洋研究所 海洋生物分类与系统演化实验室 青岛 266071)
黄海位于中国大陆与朝鲜半岛之间, 西北部与渤海相连, 北部与陆地接壤, 南部直达长江口, 通常以长江口北岸的启东嘴与济州岛西南角连线为界与东海相分离, 具有特殊的生态环境条件和复杂的动物区系(刘瑞玉等, 1963)。黄海又以胶东半岛成山头和朝鲜半岛之间的连线为界分为北黄海和南黄海(范士亮等, 2011)。在南黄海深海区域, 40—50m深的等深线上存在持续低温的黄海冷水团, 底温一般维持在8—12°C。南黄海东南角受台湾暖流的分支——黄海暖流影响较大(王金宝等, 2007)。南黄海面积广阔,约 30.9万平方公里, 其 中包含有 呂 泗和烟威等几大渔场, 是重要的渔业养殖场所(李荣冠, 2003; 刘录三等, 2003; 徐勤增等, 2009)。
大型底栖软体动物以有机碎屑和其它底栖生物等作为营养来源, 不仅是生态系统中生物群落的重要组成部分, 还是底食性鱼类和虾蟹等经济水生动物的天然饵料(刘月英, 1979; 李德亮等, 2011), 在物质循环和能量流动中具有不可或缺的作用(胡成业等,2015), 同时在水环境监测及水生态系统修复方面具有很大的应用前景(陈玉霞等, 2010)。因此, 对大型底栖软体动物的研究显得尤为重要。
1 材料与方法
1.1 调查海域及站位
本研究所用实验材料来源于2011年8月12日至8月30日搭载“科学三号”考察船航次, 2012年8月9日至8月21日和2013年8月13日至9月2日期间搭载“北斗”考察船航次所采集的样品。站位分布在32°—37°N, 120°—125°E 之间。站位设置范围广阔,基本覆盖南黄海, 可以代表南黄海生物分布。站位分布见图1。
1.2 采样方法
每个站位使用山东省海洋仪器仪表研究所生产的 0.1m2Gray-O′Hara箱式采泥器 (Warwick et al,1994)成功采样两次合并为一个样本。样本用底层网孔径为 0.5mm 的套筛过滤和淘洗, 将得到的生物样本用75%酒精浸泡保存。在实验室中将生物样本分为多毛类(Polychaeta)、甲壳类(Crustacea)、软体类(Mollusca)、棘皮类(Echinodermata)和其它等五大类,鉴定到种后计数和称重(湿重, 带壳)。称重使用精确度为 0.001g的分析天平(HAGPING—A2003, 上海天平仪器厂)完成, 称重的同时进行人工计数。

图1 2011—2013年夏季南黄海大型底栖软体动物采样站位分布示意图(灰色线条表示50和100m等深线)Fig.1 Localities of sampling stations of mollusc species in the South Yellow Sea during 2011—2013 in summer(The gray lines represent 50 and 100m contours)
1.3 数据分析
1.3.1 优势种 优势种优势度的计算使用以下公式
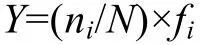
式中ni为第i种物种的个体数, N为物种总个体数, fi为第i种物种出现的站位数与总站位数之比。当某物种优势度Y≥0.02时, 即认为该物种为优势种(徐兆礼等, 1989)。
1.3.2 物种多样性 群落物种多样性采用Shannon-Wiener多样性指数(H')、Pielou均匀度指数(J')和Margalef丰富度指数(D)进行分析计算。其计算公式分别为
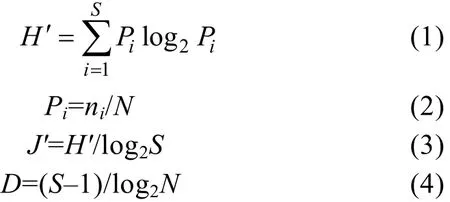
公式(1)—(4)中, S为采泥样品中物种的总数, N为所有物种的总个体数, Pi为第i个物种在站位中出现的总个体数ni与所有物种的总个体数N的比值(Shannon et al, 1963; Pielou, 1966; Margalef, 1968; 于海燕等,2006)。
1.3.3 群落结构分析 群落结构分析通过PRIMER6.0将分组站位之间群落结构进行 Bray-Curtis相似性矩阵聚类分析(clustering analysis)和非度量多维度排序分析(nonmetric multidimensional scaling,MDS), 以列表和图形的方式直观展示分组数量(周红等, 2003; 甘志彬等, 2012)。同时PRIMER软件中的ANOSIM分析和SIMPER分析可以用于验证Cluster群落间分组的可靠性。
2 结果
2.1 大型底栖软体动物种类组成
三个航次调查共鉴定出南黄海大型底栖软体动物23科, 27属, 36种。其中, 2011年夏季航次获得大型底栖软体动物15科, 20属, 22种; 2012年夏季航次获得13科, 17属, 19种; 2013年夏季航次获得15科, 15属, 18种。表1是各个物种在2011—2013年夏季的丰度情况。
日本胡桃蛤(Nucula nipponica)、日本梯形蛤(Portlandia japonica)、薄索足蛤(Thyasira tokunagai)和橄榄胡桃蛤(Nucula tenuis)这四个种在2011—2013各年份的丰度均较大。
2.2 主要优势种
日本胡桃蛤、日本梯形蛤和薄索足蛤在2011年夏季占据优势种地位, 它们的优势度分别为 0.033、0.080和0.165。橄榄胡桃蛤、日本梯形蛤和薄索足蛤在 2012年夏季占据优势种的地位, 它们的优势度分别为0.031、0.099和0.037。日本梯形蛤、秀丽波纹蛤(Raetellops pulchella)和薄索足蛤在2013年夏季占据优势种地位, 它们的优势度分别为0.039、0.049和0.134。这些优势种在各年份的丰度之和占各调查年份总丰度的50%以上。日本梯形蛤与薄索足蛤三年优势度变化范围分别为 0.039—0.099和 0.037—0.165,在优势种地位中比较稳定。
2.3 物种多样性
图2a是2011年夏季南黄海各站位大型底栖软体动物的 D、J'和H'指数, 其中A3、C2、C3、E2和E3各站位仅有一种物种。结果显示, G3站位物种多样性指数最高, GE站位最低。A1和I3的均匀度最好, GE的均匀度最差。G3的丰度最高而GE和C5的丰度最低。GE站位是2011年度各指标最低的站位, 其次是E4。
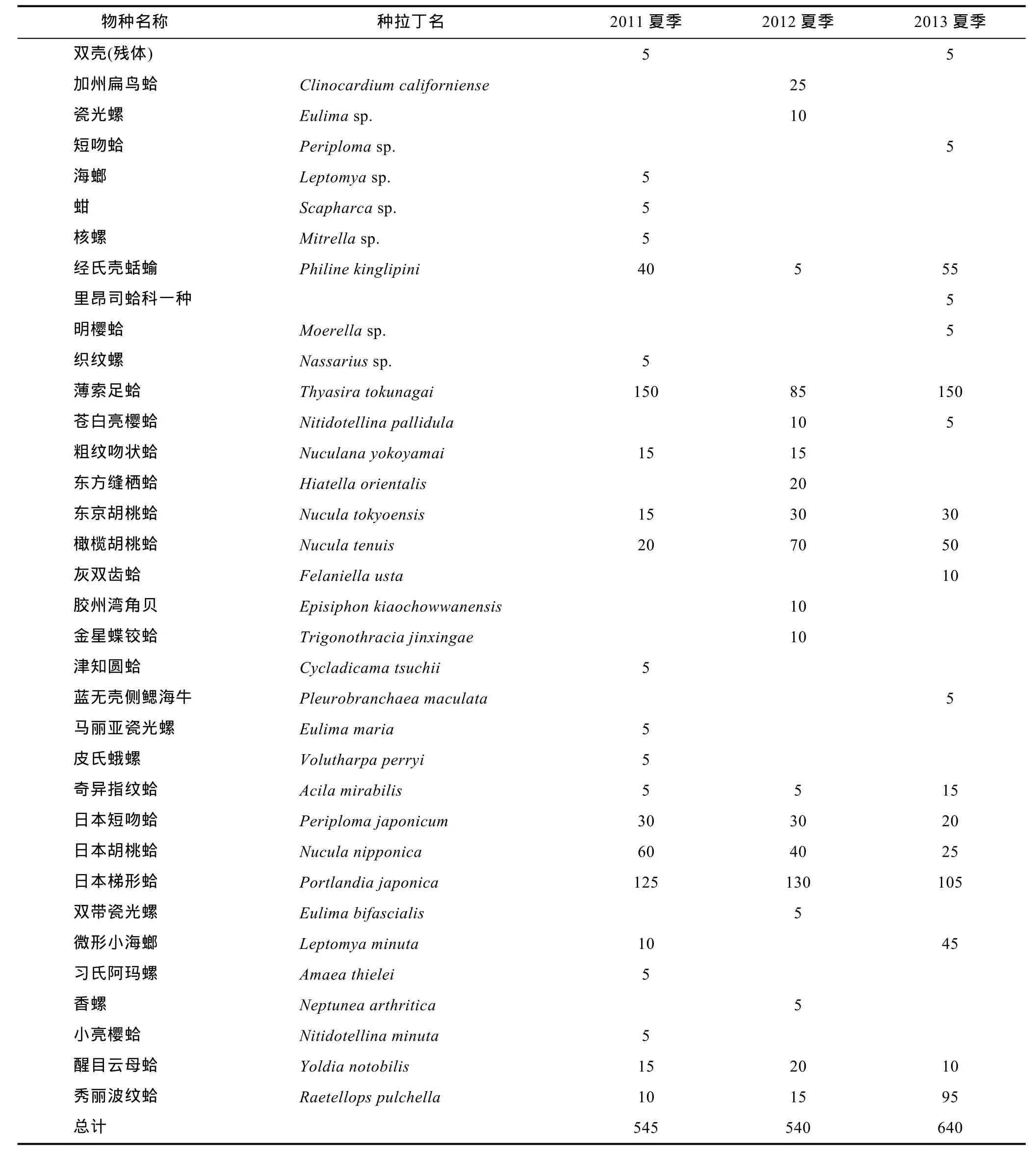
表1 2011—2013年夏季南黄海大型底栖软体动物的丰度(单位: ind./m2)Tab.1 Abundance of mollusc species in South Yellow Sea during 2011—2013 in summer (unit: ind./m2)
图2b是2012年夏季南黄海各站位大型底栖软体动物的D、J'和H'指数, 其中E4、E8和I5仅有一种物种。结果显示, A2的生物多样性最高, 其次是E5,C5最低。2012年夏季各站位大型底栖软体动物的均匀度都较好, C5相对最低。丰度值A2最高, C5最低。C5是本年度各项指标都较低的站位。
图2c是2013年夏季南黄海各站位大型底栖软体动物的D、J'和H'指数, 其中 A3、C1、C3、E2、E5、G2和I5仅有一种物种。分析表明, C5和G3站位生物多样性指数都较高, I4最低。A1和I4均匀度最好,A2最差。丰度值G3最高, I4最低。

图2 2011—2013年夏季南黄海各站位大型底栖软体动物的D、J'、H'指数(H': Shannon-Wiener多样性指数; J': Pielou均匀度指数; D: Margalef丰富度指数)Fig. 2 D, J', H' indices of mollusc species in each station in South Yellow Sea during 2011—2013 in summer
2011年夏季、2012年夏季和 2013年夏季的H'值变化范围分别为0—1.748, 0—1.55和0—1.689。J'值变化范围分别在0.5917—1, 0.6194—1和0.6388—1。D值变化范围为0—0.979, 0—0.780和0—0.997。它们的年平均值见表2。
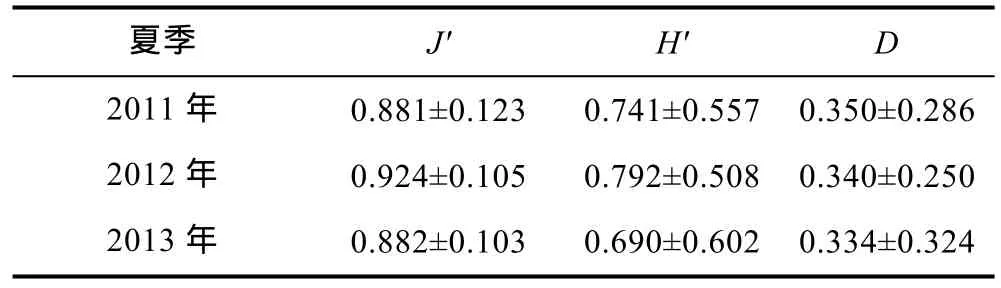
表2 2011—2013年夏季南黄海大型底栖大型底栖软体动物多样性指数(平均值±标准差)Tab. 2 Biodiversity indices of mollusc in South Yellow Sea during 2011—2013 in summer (mean±S.D.)
分析所得的各项指数(H'、J'和D)值使用SPSS17.0进行单因素方差分析, 所得结果如表3所示。
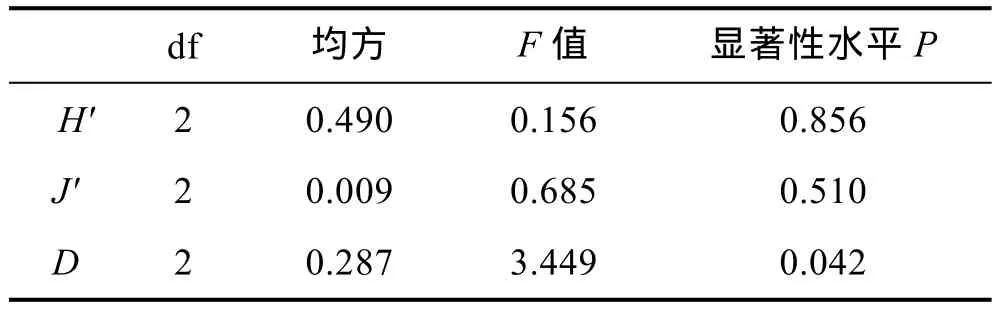
表3 2011—2013年夏季南黄海大型底栖软体动物多样性指数单因素(ANOVA)分析Tab. 3 ANOVA on biodiversity of mollusc species in South Yellow Sea during 2011—2013 in summer
经单因素方差分析显示, Shannon-Wiener指数(H',P=0.856)和 Pielou指数(J',P=0.510)差异不显著, 但Margalef指数(D,P=0.042)差异显著。2013年总丰度较2011年和2012年都有较高的增长。造成这一增长的原因是由于微形小海螂(Leptomya minuta)和秀丽波纹蛤这两个物种的丰度在 2013年夏季分别达到了45ind./m2和 95ind./m2, 而2011年夏季这两个物种的丰度仅为 10ind./m2和 0ind./m2, 在 2012年夏季仅为10ind./m2和 15ind./m2。
2.4 丰度及生物量的分布
2.4.1 丰度分布 2011—2013年夏季大型底栖软体动物的总丰度分别为 545ind./m2, 540ind./m2和640ind./m2。从图 2中可以看出, 三年中各年份丰度最高的站位分别为 E6(75ind./m2)、G5(110ind./m2)和G3 站(130ind./m2)。
2012年E2站位的丰度较2011年和2013年出现了大的增长。2013年丰度较大的原因是由于经氏壳蛞蝓(Philine kinglipini)的丰度比前两年的丰度有所增加, 为 55ind./m2(见表1)。
日本梯形蛤的丰度在 2012年G5站达到了最大值(50ind./m2)。薄索足蛤的分布相对均匀, 其最大丰度(55ind./m2)出现在2012年C5站位。日本梯形蛤与薄索足蛤三年占总丰度百分比的变化范围分别为16.41%—24.07%和15.74%—27.52%。
从图3中可以看出, 50米等深线两侧站位的大型底栖软体动物丰度有较大的区别, 各年份 50米等深线以深站位的大型底栖软体动物丰度普遍大于50米等深线以浅站位的丰度。
2.4.2 生物量分布 2011—2013年夏季南黄海大型底栖软体动物总生物量分别为163.275、118.015和106.495g/m2, 呈现出逐年降低的趋势。2011年夏季最高生物量出现在E4站位(37.485g/m2), 2012年夏季在E6站位(21.065g/m2), 2013年夏季在 C6站位(41.170g/m2)。各年份生物量分布如图4所示, 2011年与2012年各站位生物量分布较一致; 2013年与2011年各站位相比生物量差异较大, 其中 C6站位生物量有明显变化。
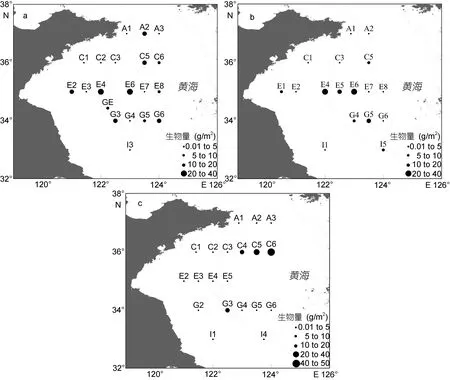
图4 2011—2013年南黄海大型底栖大型底栖软体动物生物量分布(灰色线条表示50和100m等深线)Fig. 4 The biomass distribution of mollusc species in South Yellow Sea during 2011—2013 (gray lines represent 50 and 100m contour)
2011年与 2012年各站位生物量分布较一致。2013年与2011年各站位相比生物量差异较大, C6站位生物量有明显变化。
2.4.3 丰度与生物量的均值 将2011—2013年三年间的各站位丰度和生物量进行加和后平均发现,由图5可看出, 冷水团(于非等, 2006)内站位C5、C6、E5、E6、E7、E8、A2、A3、G4、G5 和 G6 的平均丰度与平均生物量均较高(A3站位除外)。冷水团外站位C1、C2、I1、I3、I4、I5、G2、E2和E3的平均丰度和平均生物量值相对较低(I4站位除外)。单因素方差分析丰度数据显示, 冷水团内站位与冷水团外站位差异显著(P=0.021, <0.05)。生物量分析结果与丰度结果相同, 冷水团内外站位差异显著(P=0.012,<0.05)。
2.5 群落结构分析
应用Cluster聚类分析将2011年航次站位分为两大类, 将2012年和2013年航次站位分为三大类。其中, 南黄海冷水团内外站位分布各年基本一致, 故可将其分为两大部分(见图6—8)。
图6是2011年夏季各站位物种群落聚类分析结果, 按照树状图显示, 在20%的相似性上分为两组(1,2组)。A1、C1、E2和I3等四个站位, 平均相似性为0%, 这几个站位在 Cluster聚类相似性分析图上各占一支, 因此不归为一组; 组1(C5、C6、E6、E7、E8、G5、G6)各站位平均相似性为37.18%, 表征种为薄索足蛤(贡献率 94.87%); 组 2(A2、A3、C2、C3、E3、E4、G3、G4、GE)各站位平均相似性为 38.60%, 表征种为日本梯形蛤(贡献率 76.83%)、日本胡桃蛤(贡献率 12.47%)和薄索足蛤(贡献率 5.28%)。ANOSIM(global R=0.722, P=0.1%)分析显示三个分组之间的差异性显著。图6b是MDS分析结果, 同样是在20%相似性上进行划分。

图5 2011—2013年各站位大型底栖软体动物丰度及生物量均值直方图Fig. 5 Histograms of the mollusc abundance and biomass during 2011—2013
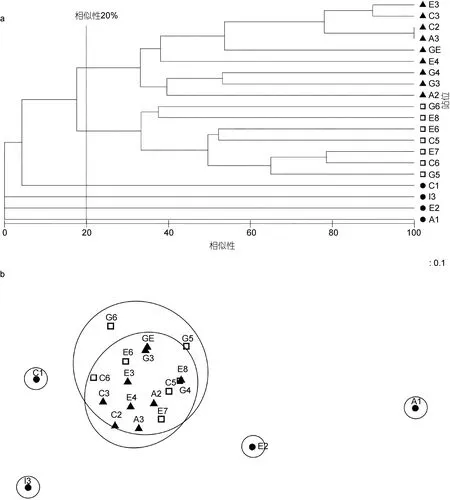
图6 2011年夏季南黄海大型底栖软体动物群落结构相似性和MDS排序Fig.6 Cladogram of Bray-Curtis similarity and MDS ordination of Mollusca in macrobenthic community in summer 2011
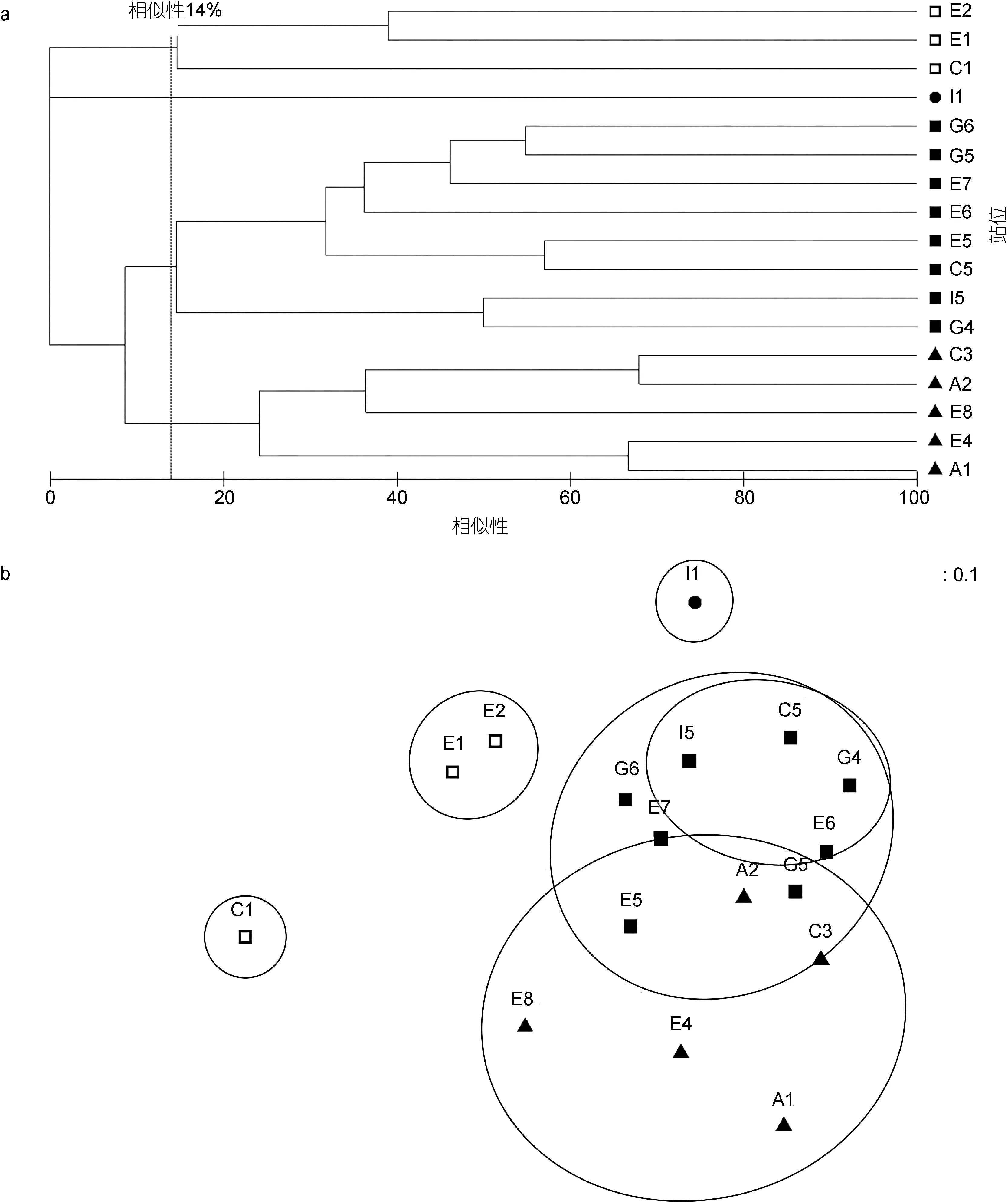
图7 2012年夏季南黄海大型底栖软体动物群落结构相似性和MDS排序Fig.7 Cladogram of Bray-Curtis similarity and MDS ordination of Mollusca in macrobenthic community in summer 2012
图7是2012年夏季南黄海大型底栖软体动物群落结构的Cluster与MDS分析结果。与2011年夏季不同的是在 14%的相似性上将站位分为三组。组1(C1、E1和E2)各站位平均相似性为36.36%, 表征种为东方缝栖蛤(Hiatella orientalis)(贡献率64.52%)和加州扁鸟蛤(Clinocardium californiense)(贡献率35.48%); 组 2(A1、A2、C3、E4和 E8)各站位平均相似性 32.61%, 表征种为日本短吻蛤(Periploma japonicum) (贡献率 68.65%)和醒目云母蛤(Yoldia notobilis) (贡献率 25.21%); 组 3(C5、E5、E6、E7、G4、G5、G6和I5)平均相似性为22.47%, 表征种为日本梯形蛤(贡献率 64.95%)、橄榄胡桃蛤(贡献率10.94%)、苍白亮樱蛤(Nitidotellina pallidula)(贡献率7.95%)和日本胡桃蛤(贡献率 6.20%)。ANOSIM(global R=0.698, P=0.1%)分析显示各分组之间的差异显著。
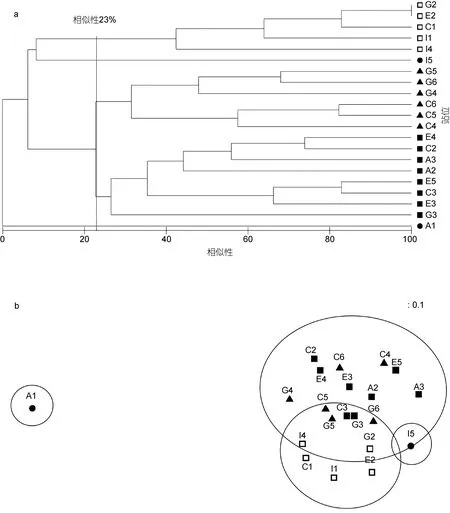
图8 2013年夏季夏季南黄海大型底栖软体动物群落结构相似性和MDS排序Fig.8 Cladogram of Bray-Curtis similarity and MDS ordination of mollusc species in macrobenthic community in summer 2013
2013年夏季的分析结果显示可将站位分为三组(图 8)。三个分组依次为: 组 1(C1、E2、G2、I1和 I4)各站位平均相似性 52.11%, 表征种为经氏壳蛞蝓(贡献率 100%); 组 2(C4、C5、C6、G4、G5和 G6)各站位平均相似性 37.08%, 表征种为日本梯形蛤(贡献率43.32%)、薄索足蛤(贡献率21.53%)、橄榄胡桃蛤(贡献率16.93%)、东京胡桃蛤(Nucula tokyoensis)(贡献率6.81%)和日本胡桃蛤(贡献率4.50%); 组3(A2、A3、C2、C3、E3、E4、E5 和 G3)各站位平均相似性 33.04%,表征种为薄索足蛤(贡献率 76.66%)和秀丽波纹蛤(贡献率 22.59%)。ANOSIM(global R=0.769, P=0.1%)分析显示各分组之间差异显著。
从图9中可以看出, 三年各年份的生物量曲线均位于丰度曲线之上。当 W值趋近于-1时, 表示群落中生活周期长的物种占据主要优势, 群落状况稳定;当W值趋近于-1时, 说明群落中生活周期短的物种占据主要优势, 群落状况不稳定(Chainh et al, 2007)。2011年(W=0.131)夏季南黄海海域的群落曲线在左侧交叉, 表明群落中生活周期短的物种丰度增加, 群落受到扰动。
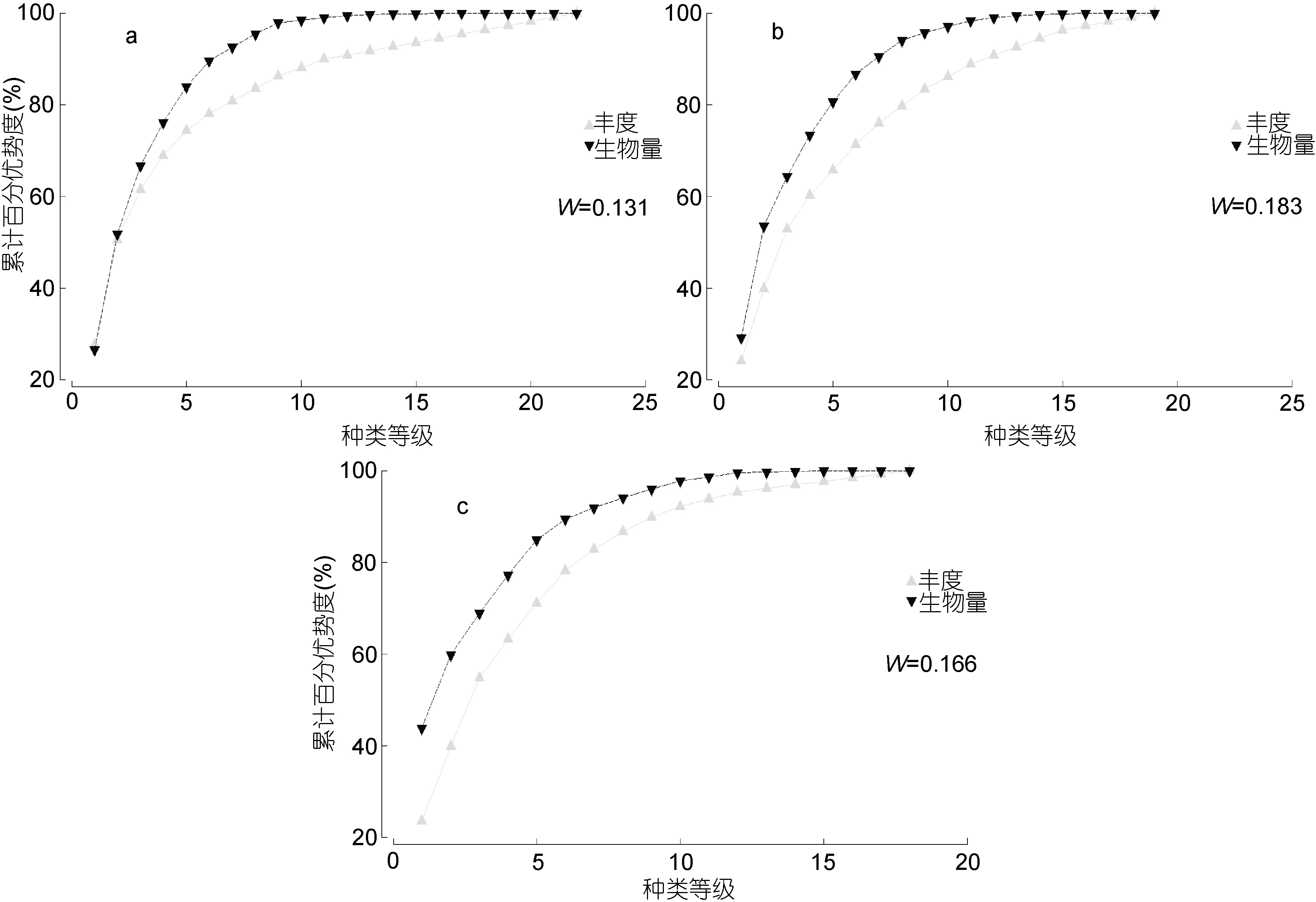
图9 2011—2013年夏季南黄海大型底栖软体动物ABC曲线Fig. 9 The ABC curves of mollusc species in South Yellow Sea during 2011—2013
3 讨论
3.1 生物量与丰度变化特征
南黄海深水区是重要的渔业养殖基地, 物种数量繁多(刘录三等, 2003), 大型底栖生物作为经济鱼类的饵料有着重要的价值。因此, 对这一区域的生态系统进行研究有着重要的意义。大型底栖软体动物在大型底栖生物群落丰度中比例较大(刘录三等, 2003;徐勤增等, 2009; 贾海波等, 2010; 廖一波等,2011),其重要性不言而喻。物种群落结构的稳定发展, 是生态可持续发展的一个重要指标。作为底栖生物群落中的主要物种, 大型底栖软体动物在生态系统稳定中具有着重要的作用。本研究表明南黄海大型底栖软体动物夏季的生物量自 2011—2013年逐年降低, 其中各年份50m等深线以深站位的丰度均大于50m等深线以浅站位。在此三年夏季, 日本梯形蛤与薄索足蛤均占据着优势种的地位, 丰度的变化范围分别为16.41%—24.07%和 15.74%—27.52%, 在优势种中的地位稳定。
黄海冷水团是黄海夏季的特殊水团, 其水文条件与冷水团外差异较大, 夏季时冷水团内的大型底栖生物依旧生活在温度相对较低水域。图3和图4中的丰度分布与生物量分布较大的区域均位于 35°—36.5°N 和 122°—124.5°E之间, 这一位置恰好位于黄海冷水团内部(于非等, 2006)。底栖生物与环境之间存在相互作用, 群落受环境改变的影响严重, 研究表明水深、温度、盐度、沉积物以及溶解性无机氮等对底栖生物影响明显(Dippner et al, 2001; Ganesh et al,2007; Mutlu et al, 2010)。本文研究中发现, 冷水团内的大型底栖软体动物生物量要高于冷水团外, 这与韦晟(1966)对大型底栖动物的调查结果相符。韦晟(1966)在文章中指出“软体动物冬季生物量最高, 其它季节都较低”。并且, 本次研究发现大型底栖软体动物的丰度分布也出现冷水团内部高于外部的现象。
3.2 年际群落状况及现状
2011年至 2013年夏季, 各年份的Shannon-Wiener指数和 Pielou指数的平均值都相差不大, 且H'(P=0.856, >0.05)和 J'(P=0.510, >0.05)的单因素方差分析均显示差异不显著。各指数单因素(ANOVA)分析显示南黄海区域的物种数量在三年间变化不明显,物种在各站位的分布也没有较大的变动。但微形小海螂和秀丽波纹蛤这两个物种的个体数在2013年时数量的增加导致物种个体数变化明显, 使得Margalef指数(P=0.042, <0.05)各年份间差异显著。调查期间, 秀丽波纹蛤仅在 2013年作为优势种出现, 按照其数量的增长趋势是否会持续成为南黄海优势种还需要进一步调查研究。
2013年总丰度较 2011年和2012年都有较高的增长。造成这一增长的原因是由于微形小海螂和秀丽波纹蛤这两个物种的丰度在2013年夏季分别达到了45和95ind./m2, 而2011年夏季和2012年夏季的微形小海螂和秀丽波纹蛤的采样丰度仅分别为 10、0和10、15ind./m2。
Warwick等(1994)提出的丰度生物量比较法(abundance biomass comparison, ABC)可用于海洋环境污染检测。ABC曲线法将底栖生物群落受到污染时会出现的状况分为三类(曲方圆等, 2009): ①群落受污染不严重时, 生物量曲线位于丰度曲线之上; ②群落受到中度污染时, 生物量曲线与丰度曲线交错分布; ③群落受到严重污染时, 丰度曲线整条位于生物量曲线上方。Chainh等(2007)认为 ABC曲线法可以依据 W 值分为三类: 好(0.1—1.0)、中(-0.1—0.1)和差(-1.0— -0.1)。本研究三年中, 2011年 W 值为0.131、2012年W值为0.183、2013年W值为0.166。结合ABC曲线与W值(Chainh et al, 2007)可知2012年和2013年夏季的群落健康状况较2011年好, 三年间南黄海大型底栖软体动物群落的健康状况均处于中度偏好。
3.3 冷水团内外群落差异
将 Cluster和 MDS聚类分析结果(图 6—8)进行ANOSIM分析, 结果显示各个分组之间差异显著。从分组结果可以看出, C5、C6、E5、E6、E7、G4、G5和G6站位在三年的分组当中均被分在同一个组。这一结果与于非等(2006)对于黄海冷水团7月份的研究结果在位置上存在一致性, 即这八个站位均位于黄海冷水团之中。将聚类分析结果与生物量和丰度分布情况及丰度生物量总平均值(图 5)相结合发现, 三个航次中生物量和丰度均较高的站位, 空间分布均匀,大多位于黄海冷水团内部。
2011年到2013年夏季的南黄海大型底栖软体动物群落结构稳定。呈现出冷水团内大型底栖软体动物群落的多样性要高于冷水团外大型底栖软体动物群落的多样性, 丰度由北到南逐渐增加, 冷水团内大于冷水团外的现象。单因素ANOVA分析也支持南黄海大型底栖软体动物群落结构稳定的结果。2011年夏季G3站位物种多样性指数最高; 2012年夏季A2站位的生物多样性指数最高; 2013年夏季C5和G3站位生物多样性指数最高。这些多样性较高的站位分布在35°—36.5°N和122°—124.5°E之间, 此处夏季为黄海冷水团范围, 在春秋季黄海冷水团会有所移动(于非等, 2006)。这些站位的多样性较高可能与此处温度变化较大有关。
2011—2013年各年份平均丰度为27.250±22.152、31.765±27.948和30.476±30.818 ind./m2, 与徐勤增等(2009)对于 2006年南黄海夏季大型底栖软体动物丰度的研究结果 24ind./m2相比, 平均丰度更大, 呈逐年递增的趋势; 丰度分布结果表明中部和东部的局部丰度较高, 其它大部分海域丰度较小, 与徐勤增等(2009)研究结果相一致。生物量分布调查结果显示,本研究中2011—2013年的生物量范围均小于2006年的值(0—120.6g/m2), 各年度生物量均未超过 50g/m2,且呈现出逐年降低的趋势。使用ABC曲线法分析得知, 虽然三年间南黄海大型底栖软体生物的丰度呈现增长, 生物量呈现下降趋势, 但生物量曲线均位于丰度曲线之上, 说明群落结构较稳定(图 9)。生物量的逐年降低, 可能与冷水团水温变化有关, 需要进一步研究。本研究中各年份冷水团内外站位的生物多样性指数(H')结果显示, 2011年南黄海冷水团中站位C5(0.562)、E6(1.402)和 E7(0.637)要高于冷水团外站位 C2(0)、C3(0)和 E3(0)。2012年冷水团内站位C5(0.429)、E6(1.352)和 E7(0.598)与冷水团外站位C1(0.693)、E1(0.637)和 E2(1.04)相比除 E6 较高外, 其它两站的生物多样性指数(H')低, 但相差不大。2013年冷水团内站位C4(0.888)、C5(1.673)和C6(1.234)高于冷水团外站位C1(0)、E2(0)和G2(0)。虽然2012年冷水团内外站位的生物多样性指数持平, 但 2011年和 2013年冷水团外站位的生物多样性指数均为 0。结合ABC曲线(图9)分析可知黄海冷水团的环境好于邻近海域, 更适合大型底栖软体动物的繁衍(其中 H'为 0的站位是由于该站位仅有一种大型底栖软体动物导致的)。
4 结论
对 2011—2013年夏季的南黄海生物群落研究发现, 存在于南黄海的冷水团的环境要好于邻近海域,且南黄海冷水团中的大型底栖软体动物丰度和生物量要高于临近海域。南黄海的大型底栖软体动物群落结构较稳定。通过ABC曲线法对南黄海大型底栖软体动物的生物量与丰度进行分析得知, 南黄海在此三年间的环境并没有较明显的改变。黄海冷水团对于大型底栖软体动物的繁衍具有重要的意义。
于 非, 张志欣, 刁新源等, 2006. 黄海冷水团演变过程及其与邻近水团关系的分析. 海洋学报, 28(5): 26—34
于海燕, 李新正, 李宝泉等, 2006. 胶州湾大型底栖动物生物多样性现状. 生态学报, 26(2): 416—422
王金宝, 李新正, 王洪法等, 2007. 黄海特定断面夏秋季大型底栖动物生态学特征. 生态学报, 27(10): 4349—4358
韦 晟, 1966. 黄海北部主要大型底栖动物的种类组成、数量分布及季节变动的特点. 水产学报, 3(1): 52—61
甘志彬, 李新正, 王洪法等, 2012. 宁津近岸海域大型底栖动物生态学特征和季节变化. 应用生态学报, 23(11):3123—3132
曲方圆, 于子山, 隋吉星等, 2009. 丰度生物量比较法应用局限性. 海洋科学, 33(6): 118—121
刘月英, 张文珍, 王跃先等, 1979. 中国经济动物志—淡水软体动物. 北京: 科学出版社, 1—3
刘录三, 李新正, 2003. 南黄海春秋季大型底栖动物分布现状.海洋与湖沼, 34(1): 26—32
刘瑞玉, 徐鳳山, 1963. 黃、东海底栖动物区系的特点. 海洋与湖沼, 5(4): 306—321
李荣冠, 2003. 中国海陆架及邻近海域大型底栖生物. 北京:海洋出版社, 21—127
李德亮, 张 婷, 余建波等, 2011. 典型养殖湖泊大通湖软体动物的时空分布格局. 水生生物学报, 35(6): 946—954
陈玉霞, 卢晓明, 何 岩等, 2010. 底栖软体动物水环境生态修复研究进展. 净水技术, 29(1): 5—8
范士亮, 王宗兴, 徐宗军等, 2011. 南黄海冬季小型底栖生物分布特征. 海洋环境科学, 30(2): 185—188
周 红, 张志南, 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报,33(1): 58—64
胡成业, 徐 衡, 邹 莉等, 2015. 浙江沿岸岛礁区潮间带软体动物群落结构研究. 水产学报, 39(8): 1144—1154
贾海波, 胡颢琰, 唐静亮等, 2010. 南黄海大型底栖生物生态调查与研究. 海洋与湖沼, 41(6): 842—849
徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐 鲹 渔场的关系. 生态学杂志, 8(4): 13—15, 19
徐勤增, 李瑞香, 王宗灵等, 2009. 南黄海夏季大型底栖动物分布现状. 海洋科学进展, 27(3): 393—399
廖一波, 寿 鹿, 曾江宁等, 2011. 三门湾大型底栖动物时空分布及其与环境因子的关系. 应用生态学报, 22(9): 2424—2430
Chainho P, Costa J L, Chaves M L et al, 2007. Influence of seasonal variability in benthic invertebrate community structure on the use of biotic indices to assess the ecological status of a Portuguese estuary. Marine Pollution Bulletin,54(10): 1586—1597
Dippner J W, Ikauniece A, 2001. Long-term zoobenthos variability in the Gulf of Riga in relation to climate variability. Journal of Marine Systems, 30(3—4): 155—164
Ganesh T, Raman A V, 2007. Macrobenthic community structure of the northeast Indian shelf, Bay of Bengal. Marine Ecology Progress Series, 341: 59—73
Margalef R, 1968. Perspectives in Ecological Theory. Chicago,USA: University of Chicago Press, 111
Mutlu E, Çinar M E, Ergev M B, 2010. Distribution of soft-bottom polychaetes of the Levantine coast of Turkey,eastern Mediterranean Sea. Journal of Marine Systems,79(1—2): 23—35
Pielou E C, 1966. The use of information theory in the study of ecological succession. Journal of Theoretical Biology, 10:370—383
Shannon C E, Weaver W, 1963. The Mathematical Theory of Communication. Urbana: University of Illinois Press, 117
Warwick R M, Clarke K R, 1994. Relearning the ABC:taxonomic changes and abundance/biomass relationships in disturbed benthic communities. Marine Biology, 118(4):739—744

