培养法和PCR法用于实验大、小鼠细菌检测的比较分析
冯 洁,谢建云,冯丽萍,魏晓锋,高 诚
(上海实验动物研究中心,上海市实验动物质量监督检验站,上海 201203)
培养法和PCR法用于实验大、小鼠细菌检测的比较分析
冯洁,谢建云,冯丽萍,魏晓锋,高诚
(上海实验动物研究中心,上海市实验动物质量监督检验站,上海201203)
【摘要】目的比较培养法和PCR法对实验大、小鼠的细菌检测效果。方法分别采用传统细菌分离培养结合生化鉴定方法和PCR方法,对78只SPF级大鼠和422只SPF级小鼠进行检测,对两种方法的检测结果进行比较分析。结果78只SPF级大鼠均未检测出阳性。422只SPF级小鼠,培养法检测阳性率7.11%(30/422),其中金黄色葡萄球菌10只,绿脓杆菌22只,肺炎克雷伯杆菌2只。PCR法检测阳性率7.58%(32/422),其中金黄色葡萄球菌10只,绿脓杆菌25只,肺炎克雷伯杆菌2只。结论PCR法的敏感性高于培养法,操作简便、快捷,适用于实验动物细菌的快速诊断和大规模的质量筛查。
【关键词】培养法;PCR法;实验动物;细菌
金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌这3种细菌均属于条件性致病菌,广泛分布于自然界,正常情况下不会导致人和动物的临床症状和疾病发生,但在免疫功能低下、定居部位改变或失调等特定情况下可引起机体的感染。这类细菌主要通过接触和空气传播,以潜伏感染为主,对于免疫系统受损的宿主,常表现为感染、炎症甚至死亡[1-3],对实验动物质量以及实验结果均造成影响。我国实验动物微生物等级及监测标准GB/T14922.2-2011明确规定,无特定病原体级(specific pathogen free,SPF)实验大、小鼠必须检测和排除上述3个项目。近年来文献报道关于实验动物金黄色葡萄球菌、绿脓杆菌等条件性致病菌的阳性率屡见不鲜[4-6]。国标推荐的检测方法为经典的分离培养法,也是微生物诊断的金标准。但鉴于培养法存在耗时费力、操作繁琐、结果受检测人员主观判定干扰较大等多方面原因,本实验室尝试建立金黄色葡萄球菌、绿脓杆菌和肺炎克雷伯杆菌3重PCR检测方法,并与国标推荐的分离培养法进行比对,以探索PCR方法作为实验动物细菌快速检测方法的可行性。
1材料和方法
1.1材料
1.1.1动物:所有检测的实验大鼠、小鼠均为SPF级,来自上海10家实验动物生产单位。
1.1.2菌株:金黄色葡萄球菌ATCC 6538、绿脓杆菌ATCC 27853购自美国标准生物品收藏中心,肺炎克雷伯杆菌CMCC 46117购自中国医学微生物菌种保藏管理中心。
1.1.3主要试剂:血琼脂平皿、营养肉汤、NAC培养基、革兰氏染液、细菌生化鉴定管、琼脂粉均购自上海伊华医学科技有限公司,高盐甘露醇平皿、DHL平皿均购自上海科玛嘉微生物技术有限公司。
细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,Taq DNA聚合酶、PCR buffer、Mg2+、2× Taq Plus Master Mix(Dye Plus)、DL2000 plus DNA marker均购自南京诺唯赞生物科技有限公司,琼脂糖购自西班牙Bio-West公司,GoldViewTM核酸染料购自上海赛百盛(SBS)基因技术有限公司。
1.2方法
1.2.1培养法检测:按国家标准GB/T14926-2001《实验动物 微生物学检测方法(1)(2)》进行金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌的常规分离培养、鉴定。无菌采集动物回盲部内容物,分别接种至高盐甘露醇平皿、NAC增菌液和DHL平皿,36℃培养(24~48)h,观察培养结果。若有可疑样品则按国标实验步骤继续进行下一步纯化和鉴定工作。
1.2.2DNA提取:取上述回盲部内容物0.2 g,悬浮于1 mL的PBS(pH 7.4)中,850 r/min离心5 min后取上清液,按照细菌基因组DNA提取试剂盒说明书严格操作,提取DNA模板,用于PCR检测。获得DNA样品于-20℃ 保存。
1.2.3PCR法检测:采用本单位已建立好的金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌3重PCR方法对样品进行检测[7-9]。引物序列见表1。
PCR反应体系50 μL,包括2× Taq Plus Master Mix (Dye Plus) 25 μL,其中Mg2+终浓度为2.5 mmol/L,dNTP终浓度为200 μmol/L,引物各0.2 μmol/L。
PCR反应程序:95℃预变性5 min后,按95℃ 变性30 s,57℃ 退火30 s,72℃ 延伸30 s的程序循环34次,最后72℃ 延伸10 min。
PCR扩增产物经1%琼脂糖凝胶电泳检测分析。PCR阳性产物送至生工生物工程(上海)股份有限公司,经凝胶电泳纯化回收后进行测序,测序结果与GenBank中已知核酸序列进行BLAST。
2结果
2.1培养法检测结果
采用培养法对422只SPF级小鼠、78只SPF级大鼠进行检测,共检出30只阳性动物(7.11%),均为小鼠。其中检出金黄色葡萄球菌10只,绿脓杆菌22只,肺炎克雷伯杆菌2只。 其中有4只动物检测结果显示金黄色葡萄球菌和绿脓杆菌均为阳性。
2.2PCR法检测结果
对上述动物同时进行金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌3重PCR检测,共检出32只阳性动物(7.58%),均为小鼠。其中检出金黄色葡萄球菌10只,绿脓杆菌25只,肺炎克雷伯杆菌2只。对阳性样品进行测序后,与GenBank发表的序列进行比对,同源性均可达98%以上。其中有5只动物金黄色葡萄球菌和绿脓杆菌均为阳性。
2.3培养法与PCR法检测结果比较
被检动物的品系和检测结果详情见表2。培养法检测出阳性样品30只,PCR法检测出阳性样品32只。培养法分别检测金黄色葡萄球菌10只、绿脓杆菌22只、肺炎克雷伯杆菌2只;PCR方法分别检测金黄色葡萄球菌10只、绿脓杆菌25只、肺炎克雷伯杆菌2只。其中有1例金黄色葡萄球菌和3例绿脓杆菌经培养法检测为阴性,但PCR检测为阳性。有1例经培养法检测金黄色葡萄球菌为阳性,但PCR法未能检出。
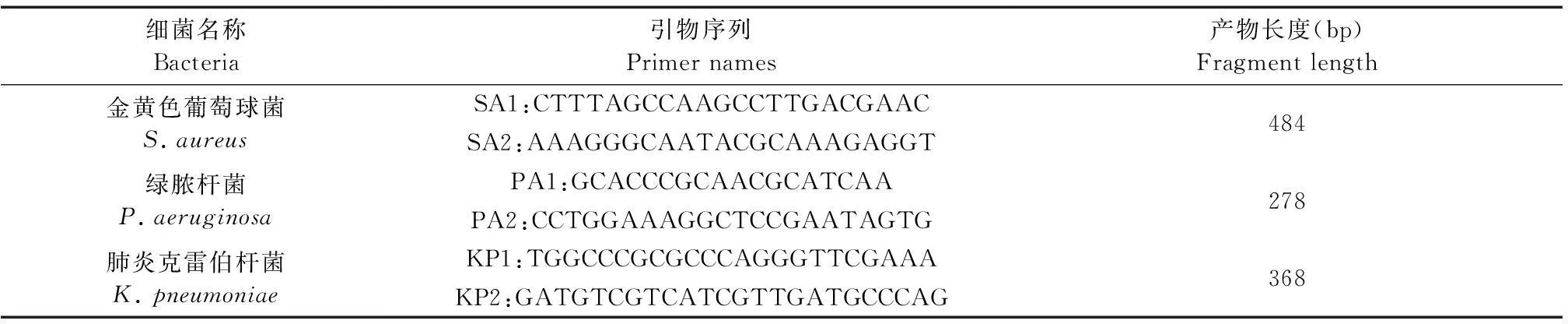
表1 PCR引物列表
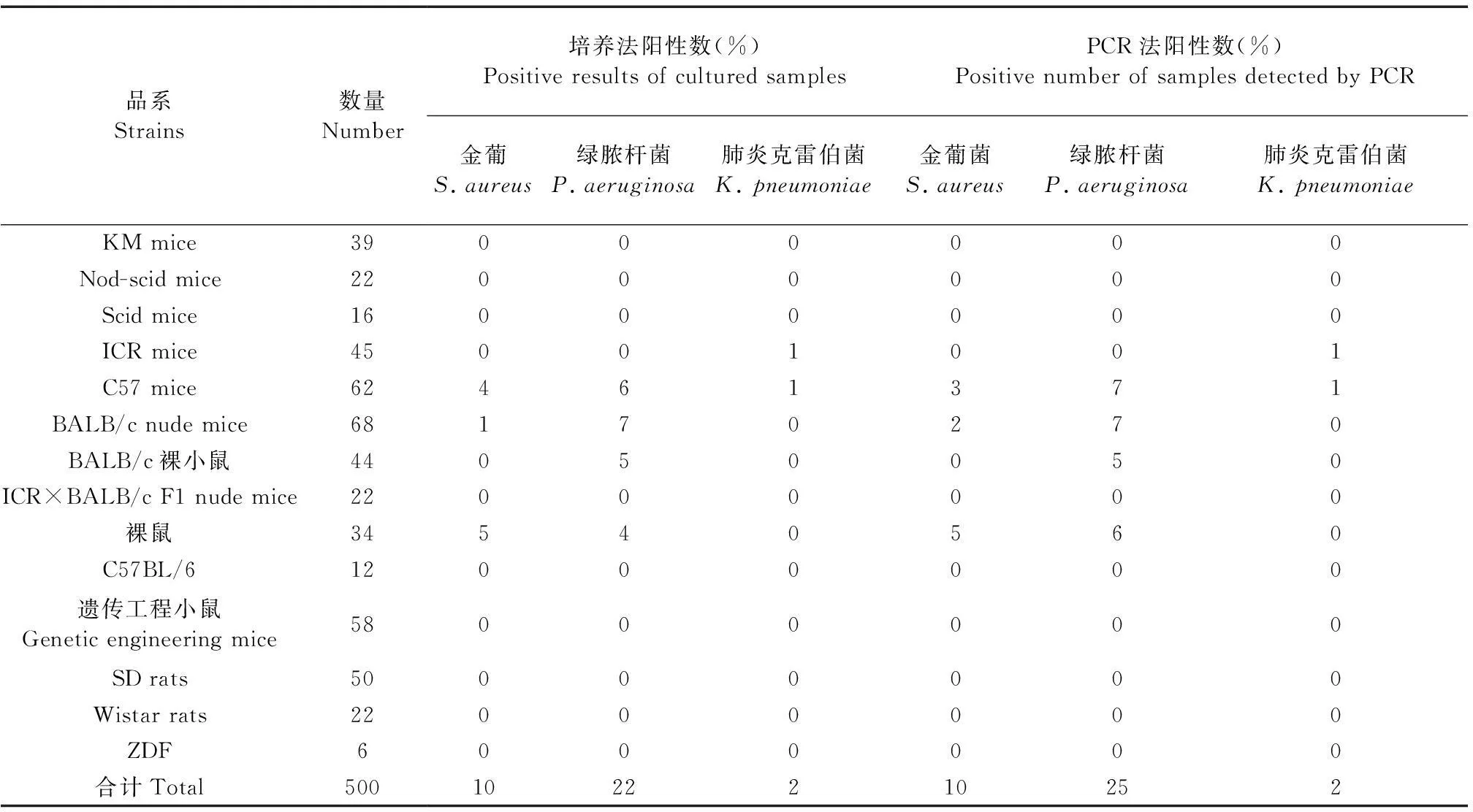
表2 被检动物品系及检测结果统计
3讨论
实验动物细菌质量控制是评价动物质量好坏的重要指标之一。细菌感染对实验动物本身的生长发育、实验动物的生产使用、科学研究的结果以及从业人员和环境均能造成不同程度的影响。因此,开发新型检测手段无论从实验动物质量控制还是从生物安全的角度都显得尤为必要。
目前细菌检测的方法一般包括分离培养、血清学检测抗体、抗原以及核酸检测方法等[10,11]。细菌分离培养被认为是金标准,也是最为常用的方法。我国实验动物国标推荐的金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌检测,采用的就是分离培养法。该方法根据细菌生物学特性、表型特征进行鉴定,经典、准确,但存在操作繁琐、实验周期长、效率较低等缺陷,受检测试剂、检测程序、软硬件等多因素限制,易造成检测结果的偏离。分子生物学技术则是针对细菌的特异性DNA进行检测,因具有敏感、快速、简便等优点已被广泛应用,我国实验动物科研工作者已陆续开发了多种病原体的分子生物学检测技术[12,13]。多重PCR是以普通PCR为基础,同时加入多对引物,同时扩增多个目的基因,从而达到快速高效的一种新型手段[14-16]。但PCR方法也存在易污染、易出现假阳性、产物需经测序验证等缺点,实际应用中应加以规避。
本研究针对金黄色葡萄球菌、绿脓杆菌和肺炎克雷伯杆菌同时开展了培养法和PCR法检测。通过比较发现,PCR法检出率略高于培养法,在实际操作过程中采用国标推荐的分离培养法,全程至少需要3~7 d时间,而PCR法仅需1 d时间即可完成。因此PCR方法在效率和敏感性上都具有较大优势,适合用于实验动物细菌感染的快速诊断和大规模的质量筛查。但值得注意的是,PCR产物易造成对实验环境的污染,导致假阳性的出现,因此在操作过程中应尽量避免。
理论上讲培养法检测呈阳性的样品,PCR法检测应均能检出。但本研究中有1例样品经培养法检测金黄色葡萄球菌为阳性,但PCR法检测为阴性。这一现象在其他类似文献报道中也出现过[17],我们认为原因可能是样品DNA提取失败,以后的PCR检测过程中可考虑加入质控引物,以评估被检样品的DNA模板质量是否合格。
综上,分离培养法和PCR法均能用于实验动物的金黄色葡萄球菌、绿脓杆菌和肺炎克雷伯杆菌检测,应将两者结合,以达到准确、高效的目的。对少量样品进行感染诊断,采用分离培养法较为合适。当出现动物疫情爆发需要快速诊断或进行流行病学调查时可采用PCR结合测序法进行筛查。
参考文献:
[1]金宁一,胡仲明,冯书章.人兽共患病学[M].北京:科学出版社.2007:552-697
[2]王惠川,白广星,刘文军,等.实验小鼠疾病[M].北京:北京农业大学出版社.1988: 111-112,153-175,540-548.
[3]Bteieh A,Kimeh P,Sahly H,et al.Klebsiella oxytoca:opportunistic infections in laboratory rodents[J].LabAnim,2008,42(3):369-375.
[4]葛文平,张旭,高翔,等.中国商业化SPF级小鼠病原体污染分析[J].中国比较医学杂志,2012,22(3):65-68.
[5]邢进,高正琴,冯育芳,等.北京地区2008-2011年实验动物绿脓杆菌检测结果与分析[J].实验动物科学,2012,29(3):24-26.
[6]隋丽华,范薇,杨敬,等.实验动物微生物、寄生虫抽样调查及分析[J],实验动物与比较医学,2008,28(4):259-262.
[7]冯洁,谢建云,胡建华,等.3种条件性致病菌三重PCR检测方法的建立及初步应用[J].中国畜牧兽医,2015,42(6):1384-1395.
[8]Brakstad O G, Aasbakk K, Maeland J A.Detection ofStaphylococcusaureusby polymerae chain reaction amplification of thenucgene[J].JClinMicrobiol,1992,7:1654-1660.
[9]谭燕玲,朱瑞良,王慧,等.鸡胚胎性病原菌多重PCR检测方法的建立[J].中国预防兽医学报,2011,33(5):374-377.
[10]王瑶,徐英春.临床细菌和真菌快速诊断技术[J].中华检验医学杂志,2009,32:257-259.
[11]张卓然,高鹏,李琳,等.微生物非培养鉴定技术在临床标本检测中的临床应用研究[J].微生物学杂志,2009,29:18-24.
[12]张小飞,张召军,张广州,等.产肠毒素大肠杆菌快速检测方法的建立和评价[J].中国实验动物学报,2013,21(5):31-35.
[13]韦莉,魏立雯,赖国旗,等.金黄色葡萄球菌反向线性杂交探针检测方法的建立[J].中国实验动物学报,2012,20(6):78-81.
[14]许一平,成炜,邵彦春,等.沙门菌、大肠杆菌和金黄色葡萄球菌的多重PCR检测[J].微生物学通报,2006,33(6):89-94.
[15]杨明柳,吴斌,汤细彪,等.致猪水肿病大肠杆菌毒力因子二重PCR检测方法的建立及应用[J].中国兽医学报,2008,28(9):996-999.
[16]李伟杰,赵耘,魏财文,等.致猪水肿病大肠埃希菌多重PCR检测方法的建立及应用[J].中国畜牧兽医,2015,42(3):537-543.
[17]薛冠华,徐文建,马晓红,等. PCR法与培养法检测儿童肺炎易感细菌结果比较 [J].北京医学,2012,34(6):466-469.
〔修回日期〕2015-06-17
研究报告
Comparison of culture and PCR assays for detection of
bacteria in laboratory rats and mice
FENG Jie, XIE Jian-yun, FENG Li-ping, WEI Xiao-feng, GAO Cheng
(Shanghai Laboratory Animal Research Center, Shanghai Quality Monitoring Center of
Laboratory Animals, Shanghai 201203, China)
【Abstract】ObjectiveTo compare the efficiency of bacteria culture and PCR assays for detection of Staphylococcusaureus (S. aureus), Pseudomonas aeruginosa (P. aeruginosa) and Klebsiella pneumoniae (K. pneumoniae) in laboratory rats and mice. Methods Bacteria culture combined with biochemical identification and PCR assay were used to detect 78 SPF rats and 422 SPF mice and the results of the two methods were compared. Results All the 78 rats were negative. Of the 422 mice, the positive rate by culture was 7.11% (30/422), of which, 10 were S. aureus, 22 were P. aeruginosa, and 2 were K. pneumoniae. The positive rate by PCR was 7.58% (32/422), of which, 10 were S. aureus, 25 were P. aeruginosa, and 2 were K. pneumoniae.ConclusionsThe high sensitivity, rapid procedure and easy to operate of PCR assay makes it valuable for rapid bacteria diagnosis and large-scale screening in laboratory animals.
【Key words】Culture; PCR; Laboratory animals; Bacteria; Staphylococcus aureus (S. aureus), Pseudomonas aeruginosa (P. aeruginosa) and Klebsiella pneumoniae (K. pneumoniae) Rats; Mice
doi:10.3969.j.issn.1671.7856. 2015.008.005
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 08-0023-04
[作者简介]冯洁(1981-),女,硕士,副研究员,研究方向:实验动物质量控制,E-mail: moyifj@163.com。
[基金项目]上海市科委基金项目(12140900500、14140900600)。

