氨与氯化氢反应的定量实验设计
王发应

摘要:针对教材中氨与氯化氢反应实验现象不明显、易造成环境污染等不足,利用医用注射器进行创新设计,不仅解决了教材实验方法存在的不足,还将原来的定性实验从定量的角度进行了研究。同时,将实验的功能进行了拓展,使其具有验证“分子运动”、“阿伏伽德罗定律”和“气体扩散定律”等多种功能,扩大了学生的视野,降低了实验成本,增强了实验教学效果。
关键词:氨与氯化氢反应;分子运动气体扩散定律;阿伏伽德罗定律;测定空气中氧气含量
文章编号:1005-6629(2016)1-0069-03 中图分类号:G633.8 文献标识码:B
人教版高中化学1(必修)第98页图4-28的氨与氯化氢的反应,实验装置简单、操作方便,但因实验是在敞开的体系中进行的,实验中浓氨水和浓盐酸挥发出的氨和氯化氢气体分散到空气中,不仅污染环境,而且只有少部分接触生成微小的NH4Cl固体,分散在空气中而形成白烟。由于空气的流动,形成的白烟很快消散到空中,实验现象很不明显,近处的学生只能在短时间内看到现象,稍远的学生就会观察不到任何现象,教学效果不理想。为此,笔者查阅了有关该实验改进的众多文献,发现这些文献只是从定性的角度进行分析和探讨,于是笔者利用医用注射器从定量的角度对该实验进行了研究。通过多次尝试和改进,取得了较好的实验教学效果。不仅使氨与氯化氢的反应在一密闭装置中进行,避免了环境污染,增强了实验现象,从定性的角度说明分子运动和气体扩散定律,而且由于注射器上带有刻度,还能从定量的角度测量两种气体间反应的体积关系,从而验证阿伏伽德罗定律。现介绍如下,供同行参考。
1.实验原理
(1)无色的氨气和氯化氢气体反应,生成白色的氯化铵固体,细小的氯化铵固体颗粒分散在空气中形成白烟:
NH3(无色气体)+HCl(无色气体)=NH4Cl(白色固体)。
(2)分子总是在不断运动(分子运动论之一)。
(3)同温同压下,相同体积的任何气体含有相同的分子数(阿伏伽德罗定律)。
(4)同温同压下各种不同气体扩散速度与气体密度的平方根成反比(气体扩散定律)。
2.研究思路
(1)实验中所用的浓氨水和浓盐酸挥发出的氨气和氯化氢气体均为有毒有害气体,如按教材方法进行操作,两种气体分散到空气中,会污染环境,危害师生健康。如要解决实验的污染问题,就必须让两种气体在一密闭容器中反应。
(2)我们研究的最终目的是该实验的定量反应设计,实验过程要能显示气体体积的变化情况,那就需要能比较准确地量取两种气体的装置或仪器。而这种装置或仪器还要具有操作简单方便、气密性好等特点。而玻璃注射器不仅带有刻度,而且其活塞与筒壁间能根据装置内外的压强大小自动移动,从而自动显示反应过程中气体总体积的变化情况,因此是该实验的最佳仪器。
(3)针对教材实验现象不明显的问题,所改进的实验须使得参加反应的气体的量足够多,从而产生较多的白烟,以增加实验的可见度,最终达到增强实验现象的目的。因此我们选择两支20mL玻璃注射器来分别抽取氨气和氯化氢气体。
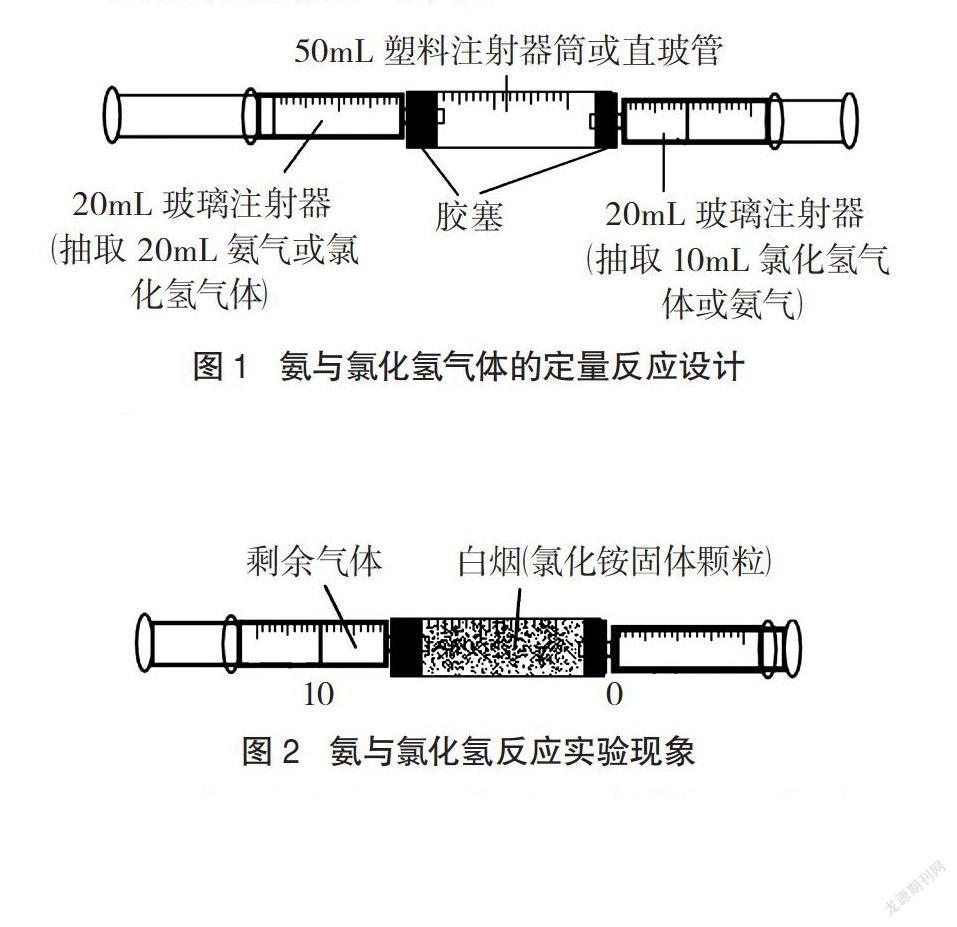
(4)在试验的过程中我们发现,如果用一根细管将两支注射器直接连接,则反应中产生的氯化铵固体有时会堵塞注射器出口和中间的细管,或者附着在注射器筒壁,影响活塞的移动,影响实验效果。为此我们用一容积较大的直玻管(或50mL注射器筒截去前端部分制成的透明塑料筒)在两端配一单孔塞(其孔径比注射器针头柱外径稍小)来连接并固定两支注射器(筒内空气对实验无影响),不仅避免了氯化铵固体堵塞注射器出口和影响活塞移动的问题,而且反应产生的白烟主要停留在中间的直管中,能长时间保存和观察,实验现象非常明显。
3.实验装置
实验装置如图l所示。
4.实验方法、现象及解释
如图2所示。
(1)用两支20mL玻璃注射器,一支抽取10mL干燥的氨气(或氯化氢气体),另一支抽取20mL干燥的氯化氢气体(或氨气),然后按图1所示组装好反应装置,并静置在桌面上。
(2)开始时,塑料注射器筒内靠近盛有氯化氢气体的玻璃注射器一端的直管内先出现白烟,这一现象说明了两个问题:①分子在不停地运动;②氨气的密度较小,气体扩散速率大。
(3)随后,白烟逐渐充满中间的直管,并逐渐向盛有氯化氢气体的玻璃注射器内蔓延,两支玻璃注射器的活塞迅速向内移动。产生这一现象的原因是,两种气体快速发生反应,生成氯化铵固体,导致装置内气体压强迅速减小,在大气压的作用下,注射器的活塞迅速向内移动。
(4)约2分钟后反应结束,装置内压强不再减小,当装置内、外压强相等时两支注射器活塞移动停止。将其中—支玻璃注射器的活塞归零,发现另一支注射器中剩余气体的体积恰好为10mL。而且无论推动哪支注射器活塞,最终另一支注射器中剩余气体的体积都恰好为10mL,这一现象说明:在常温常压下氯化氢气体和氨气是等体积反应的,从而验证了阿伏伽德罗定律,“常温常压下,相同体积的任何气体含有相同数目的分子”。
(5)取下活塞归零后的注射器,将中间的连接管插入盛有紫色石蕊(或无色酚酞)试液的烧杯中,推动收集有剩余气体的注射器活塞,将剩余气体推人紫色石蕊(或无色酚酞)试液中,溶液变红。说明剩余气体为所抽取的20mL的那种气体(氯化氢气体或氨气)。
(6)反复推拉注射器活塞,进行抽取和推出液体的操作,使剩余气体和反应产生的氯化铵固体充分溶解,以消除污染。由于氯化铵是一种常用化肥,实验结束后可将废液倒入花园中,不仅能避免环境污染,还能给花草施肥,起到了废物利用的作用。
5.改进后实验的特点
5.1有利于环保
改进后的实验在密闭装置中进行,无气体泄漏,又对尾气进行了水处理,无环境污染。
5.2现象明显,可视性好
改进后的实验在密闭装置中进行,两种气体比较集中,产生的白烟多,且不受空气流动的影响,能够长时间观察。两端的气体为无色,而中间反应的产物为白烟,现象对比明显,可视性好。还可在教室内让学生互相传看,使每个学生都能清楚地观察实验现象,提高学生课堂教学的参与度,从而提高教学效果。
5.3操作简单
由于玻璃注射器活塞与筒壁间摩擦小,其活塞能根据装置内外的压强大小自动移动,保持装置内外的压强大小一致。所以只需将装置组装好后静置在桌面上,直到反应结束,最后进行剩余气体的体积读取和性质检验即可,中间反应过程不需要进行任何操作。
5.4多功能
一套简单的装置,却能用来证实①氨气与氯化氢气体极易发生反应;②分子运动;③气体扩散定律;④阿伏伽德罗定律这四个基本化学原理或定律,起到了一器多用的作用。
6.拓展应用
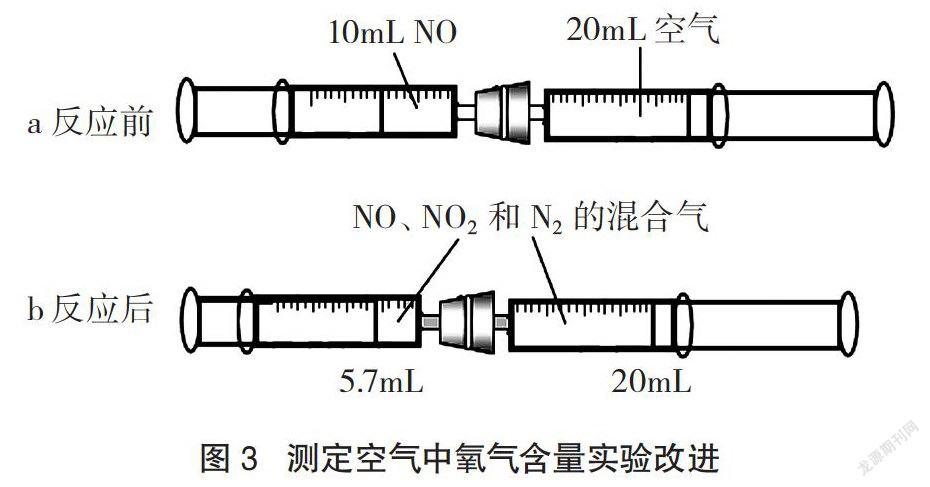
该实验设计除了能用于改进氨与氯化氢反应的实验外,去掉中间的连接管,用一个单孔塞(孔径比针头柱外径稍小,便于固定和密封两支注射器)将两支注射器连接后,还能用来改进测定空气中氧气含量的实验,操作方法如下。
6.1实验方法
将其中一支注射器取下,连接在NO气体发生器上收集10mL NO气体后,将其与另一支吸有20mL空气的注射器分别插在单孔塞两端的孔中(如图3a所示),反复推拉其中一支注射器活塞,使NO气体与空气中的氧气充分反应(装置中的气体变为红棕色),约2分钟后将装置平放在桌面上,静置,当注射器活塞停止不动后,一只手捏住其中一支注射器筒,另一只手轻轻推动该注射器活塞,慢慢调整使其活塞停留在20mL刻度处,而另一支注射器活塞会自动移动到另一刻度处。读取两支注射器中气体的体积后相加,即得反应后气体的总体积(如图3b所示)。重复实验2~3次,结果测得反应后剩余气体的平均体积约为25.7mL。实验结束,将剩余气体注入浓氢氧化钠溶液中吸收,以避免污染环境(实验条件:98.3kPa,23℃)。

