燃烧条件“3+1”
王程杰




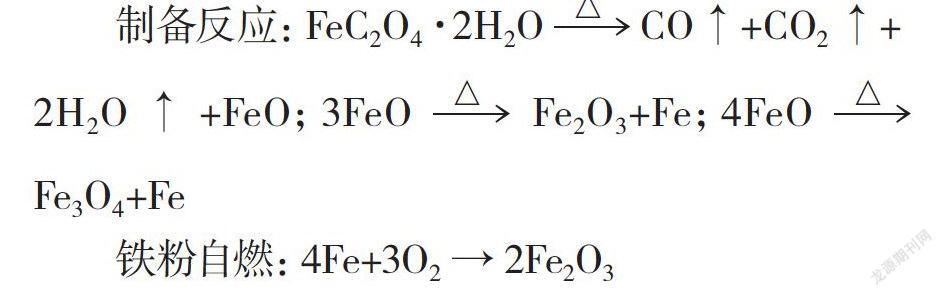

摘要:中学化学教材讲的燃烧条件就3条:可燃物、助燃物、着火点,但为何蜡烛抽掉烛芯就无法正常点燃,工业酒精中要加入甲醇、方糖要沾上点香烟灰才能引燃;铁钉烧红后伸入氧气瓶中为何不见火星四射;民间“打铁花”表演为何一定要把通红的铁水打成碎末才能见到满天火星飞舞的壮观景象;粉尘爆炸实验又点火又喷粉为何常常失败;锅内大豆油起火时在火上浇油为何把火给浇灭了;为何教材上只安排氢气而不安排甲烷的爆鸣实验;氢氯爆鸣实验中氢、氯两气的体积比为何要选1:2等等。解答这些问题仅凭上述3条很难自圆其说,很多燃烧“异象”和燃烧实验背后隐含着燃烧的第4项条件,这第4项燃烧条件又因燃烧类型的不同而变化多端。对这些中学化学教师应该知其所以然。
关键词:蒸发燃烧;闪燃;表面燃烧;分解燃烧;比表面积
文章编号:1005-6629(2016)1-0049-07 中图分类号:G633.8 文献标识码:B
我国义务教育化学教科书中的“燃烧条件实验”一直是初中化学中的一个重要探究实验,也是学生建构燃烧条件概念的经典实验。初三化学讲到燃烧条件时为突出重点,书上及课堂上都只提及“燃烧三因素”(即可燃物、助燃物、着火点),教师多会引用燃烧条件的三角图(见图1)反复强调“三因素说”。作为燃烧学基础知识的入门,这样安排无可厚非。问题是之后的高中化学甚至师范类本科化学课程竞不再就此问题作进一步学习了。于是“燃烧三因素说”在不少成年人(包括一些化学教师)身上成了晃动有响声、用途却有限的“半瓶子水”,用该“半瓶子水”来研究形式多样、机理复杂的种种燃烧问题就难免会误入歧途,闹出笑话。
例如早在8年前就有一位化学老师发表了一篇实验改进文章,文中设计了这样一个实验:取一铝质小容器(如可选小铝盒或饮水瓶铝质的瓶盖等),注入几毫升酒精,用火柴点燃容器内的酒精,可见酒精正常燃烧,然后用镊子将该容器转移到装有冰水的烧杯的液面上(见图2)。铝盒接触冰水后酒精火焰慢慢变小,最后火焰熄灭(酒精没烧完)。即作者设计了一个通过用冰水来降低铝盒内正在燃烧的酒精的温度,从而导致火焰熄灭的实验。该实验可以做成功且成功率很高,文章对此现象的解释是“冰水使温度降低至酒精的着火点以下,导致燃烧终止”。笔者读后认为该解释在科学性上是欠缺、不妥的。当时就此发表了题为“降低温度为什么会导致酒精火焰熄灭”一文,指出作为燃料的液态酒精的温度肯定不会高于酒精的沸点,也肯定远远低于酒精的着火点,冰水只是略降低了铝盒内酒精的温度。此处,室温下的酒精—点火就着,而接近0℃的酒精点不着火是不能用“高于或低于着火点”来解释的,而且这类情况至今仍常在中学课堂上或其他场所遇见。例如2015年5月笔者看到上海电视台播放的一个“火上浇油”的科普趣味实验,表演者、讲解员是消防官兵,其间的解释也出了同样的问题。
“火上浇油”是条成语,意思是浇油法灭火不但灭不了火反而会令火势扩大,让情况变得更加严重。如着了火再去浇汽油,火势肯定越浇越旺!电视上的实验过程是:在灶上放一口铁锅,锅内加些食用油(如大豆油、调和油等)再用燃气灶加热至锅内油起火燃烧,锅内产生熊熊大火后再浇上常温食用油,结果浇着浇着就把大火焰给浇弱、浇灭了,即火上浇油竞能灭火!这个实验是真实的,读者上网打入“火上浇油能灭火”的关键词就能查看到该表演录像。问题是消防官兵的解释中两次提到:“浇上油后就降低了油锅内的燃点”,颇令人费解。首先,某种油在—定条件下的燃点是个定数,怎么降低?浇油降低的只是锅中油的温度!如果该话仅是词不达意,实质是指“浇油降低油温至燃点以下”,其科学性同上例一样也是欠缺、不妥的。上述两例中,教师和消防官兵都用着火点(燃点)来作解释。而实际上真正的原因是与酒精和食用油的挥发(蒸发)速度有关,即和酒精和食用油各自的“闪点”大小有关。显然,由于中学化学里燃烧学入门知识的“半瓶子水”的设置,造成了这些张冠李戴的解释。下面我们先讨论一下蒸发燃烧其及闪点问题。
1.蒸发燃烧其及闪燃和闪点
燃烧学将燃烧分成蒸发燃烧、表面燃烧、分解燃烧、预混(混合)燃烧、扩散燃烧及阴燃等几种类型。上述汽油、酒精和食用油的燃烧都属于蒸发燃烧。蒸发燃烧是液体(或低熔点固体)受热时蒸发出来的气体(蒸气)被分解、氧化达到燃点而发生的燃烧,故蒸发燃烧时有火焰。汽油的燃点为416~530℃,无水乙醇的燃点为363℃,而压榨精制大豆油的燃点为351℃左右,即大豆油的燃点还低于无水乙醇和汽油的燃点。常识告诉我们:与大豆油相比,无水乙醇是很容易引燃的,汽油更易引燃,无水乙醇和汽油都属易燃物,而食用油仅仅是可燃物。很明显,蒸发燃烧中物质易燃不易燃和其燃点大小往往是矛盾的。其原因是蒸发燃烧中还有一项因素显著影响着燃烧的发生和持续,它就是“闪点”。在图2实验中铝质小容器中装的乙醇在室温时(如20℃)其表面遇到火苗即可被引燃,当外侧冰水使无水乙醇降温至12~13℃时,会发现在其表面引入一火苗后会出现瞬间闪火的现象,这种只出现瞬间闪火而不能持续燃烧的现象叫闪燃。发生闪燃时液体上方的蒸气浓度恰好等于其爆炸极限的下限引起闪燃时液体的最低温度称为闪点。工业上根据闪点的高低对可燃性物质进行分类,闪点低于或等于45℃的液体为易燃液体,如乙醇(闪点为12℃),闪点大于45℃的称为可燃液体,如食用油(闪点通常大于140℃)。闪点是衡量可燃液体火灾危险性的重要参数,闪点越低的可燃液体越易被小火苗甚至小火星引燃,其火灾危险性越大。
可燃性液体发生一闪即灭的闪燃现象,是因为在闪点的温度下,该可燃液体蒸发速度较慢,蒸发出来的蒸气仅能维持短时间的燃烧而来不及连续补充足够的蒸气以维持稳定的燃烧,所以闪燃一下就灭了。但闪燃通常是持续燃烧的先兆,当可燃性液体的温度高于闪点时,随时有被点燃的危险。一旦可燃性液体的温度被加热到超过闪点,蒸发速度就会迅速加快。当液体蒸发速度大于或等于燃烧消耗速度时,液体蒸发出的蒸气在点燃后就能维持继续燃烧。对于蒸发燃烧的着火点(燃点),可定义为引发可燃性蒸气燃烧的最低温度。显然蒸发燃烧中可燃性液体的着火点通常都高于闪点。查表可知汽油的闪点(-45℃左右)<甲醇的闪点(-0.5℃)<乙醇的闪点(12℃)<压榨精制大豆油的闪点(220℃左右)。知道了这些,就可给出上面“火上浇油”、“冰水降温”实验中导致熄火的真实原因了.在蒸发燃烧中,燃烧物酒精、大豆油要维持燃烧,其自身温度就要高于各自的闪点,如果降温至其闪点以下'燃烧就无法维持下去了,即蒸发燃烧中除了“燃烧三因素”之外还要加上满足闪点这一条。知道了闪点,还可解释不少与蒸发燃烧有关的问题,如为何蜡烛抽掉烛芯就无法正常点燃?为何工业酒精中要加入少量甲醇?等等。
今天的蜡烛主要由油矿中获得的石蜡制成。石蜡是几种高级烷烃的混合物,其熔点较低,通常在50-60℃,闪点在190℃左右。即一块固体石蜡的温度远远低于其闪点值。给固体石蜡一个远高于其着火点的火苗,闪点之下的石蜡不会被引燃,此处“燃烧三因素”齐了,但仍无法引起燃烧!生活中点蜡烛,首先要点燃蜡烛的烛芯,烛芯由棉线制成,棉线易引燃(棉线属分解燃烧,无闪点),棉的烛芯燃烧时产生的高温肯定超过石蜡的闪点、燃点,烛芯燃烧时使其周边的石蜡熔化、升温、气化。所以点燃蜡烛后只有烛芯附近的石蜡才会被引燃,烛芯附近还会产生“流泪”现象,而我们看到的烛焰就是石蜡蒸气在烛芯附近的空气中燃烧。
工业酒精中含有甲醇,工业酒精的主要用途是作燃料。工业酒精作为燃料明显优于纯乙醇!其一是价廉,其二是闪点较低,易被引燃,其三是在空气中它的燃烧较完全。有文章认为在酒精灯中选用无水乙醇会有更好的加热效果,笔者用三个相同的酒精灯分别加入工业酒精、无水乙醇、异丙醇,同时点燃(见图3)。左边工业酒精燃烧的火焰最不明亮,笔者请上海师大化学系实验员用DIS技术的特长温度传感器(型号:TPL-BTA)分别测三灯外焰的温度,结论是三灯外焰温度无显著差异(720℃左右,仅供参考)。再用三支盛冷水的大试管在三灯焰上加热1.5分钟,结果无水乙醇加热的试管底部留下了少许黑色烟炱,丙醇加热的试管底部留下的黑色烟炱更明显,而工业酒精加热的试管底部仍干干净净。这说明此处工业酒精的燃烧最为充分。故建议实验中酒精灯应选用工业酒精作燃料,节约且效果好!
2.表面燃烧和比表面积
中学化学有铁丝、木炭在氧气中燃烧的实验。铁丝、木炭等的燃烧属于表面燃烧。表面燃烧属于非均相燃烧,是指有些固体可燃物的蒸气压非常小或难于发生热分解,不能发生蒸发燃烧或分解燃烧,当空气或氧气包围物质的表层时,发生呈炽热状态的无火焰燃烧,如木炭、焦炭、铁、镍、钨等的燃烧。众所周知铁丝在氧气中燃烧的现象是火星四射,无火焰。
有人曾问:把铁钉烧红后伸人氧气瓶中时,“燃烧三因素”全满足了,但为何不见其火星四射?还有民间绚丽多彩的“打铁花”表演为何一定要把通红的铁水用杆打成碎末才能见到满天火星飞舞的壮观景象(见图4)?答案很简单:铁、镍等金属燃烧能否持续进行还和其“比表面积”大小有关。“比表面积”是指单位质量物料所具有的总表面积。如普通铁块、铁棒比表面积小,加热到发红也不会在氧气中燃烧起来。细铁丝比表面积增大了,加热到发红虽然不会在空气中燃烧,但伸人氧气瓶中它就会“火星四射”地烧起来。如取实验室的灰色还原铁粉(还原铁粉的结构较疏松,故其比表面积较大)来做燃烧实验,则不需要纯氧气了,只要在空气中将还原铁粉撒在灯焰上,就可看到有一簇簇火星产生。该趣味实验操作更简单、方便,学生也可做成功,具体方法:取一支试管,放入3~5克还原铁粉,点燃一酒精灯或煤气灯,用拍打法将试管内的铁粉撒于灯焰上即可(手势及燃烧效果见图5)。如果铁粉颗粒直径小到20~30nm(纳米),使比表面积变得极大,其在空气中竟会自燃!该趣味实验在中学实验室也可以做成功,具体操作过程:在一支试管中放入1~2g草酸亚铁,试管口塞上附导管的橡皮塞,选用如图6所示的方法用煤气灯加热(如用酒精灯加热,耗时较长)。加热至1-2分钟,草酸亚铁微微发生翻腾,黄色草酸亚铁粉末渐变为灰黑色,此时可轻轻振摇试管,让反应物受热均匀,同时点燃导管口的尾气,尾气起燃。再加热约2分钟后,草酸亚铁变成乌黑色产物,尾气的火焰由大变小,最后熄灭,且管内物质不再翻腾,此时停止加热。拔下带导管的塞子,换上无孑L橡皮塞(尽量避免空气进入),开始时塞子别塞得太紧,防止还会有少些尾气产生,待试管冷却后再塞紧。如不漏气,该产物可放置数月不改变性质。表演时可先用磁石来验证铁粉,磁石放在试管外壁上即可吸引、移动管内黑色粉末。然后倒置一下上述盛有产物的试管,将黑色铁粉置于试管口,再将试管横放,轻轻拔去塞子,及时将铁粉在空气中均匀撒落,黑色粉末遇空气即自燃,可见到有一簇簇火星产生(手势及燃烧效果见图7)。自燃后落在水泥地面上的粉末呈棕褐色(切勿撒在木地板、地毯等易燃物上)。
上述实验提及的草酸亚铁为黄色粉末,含有结晶水(FeC2O4·2H2O),加热时会产生一定量水蒸气,故加热前要强化对试管前部的预热,且选用硬质试管。草酸亚铁如有结块,要先置于研钵中研细。加热草酸亚铁时会产生CO、CO2、H2O等气体,会导致反应物“翻腾”甚至喷料。故试管口应向上倾。加热时尽量加热至管内物质成乌黑色。根据加热条件的不同,有时需5分钟以上方能转为黑色。此实验的演示在较暗的室内进行的话,效果更加明显。
草酸亚铁加热时,除释放出一氧化碳和二氧化碳等气体外,试管内留下的主要成分为Fe、FeO4、Fe2O3,有关该铁粉的制备及燃烧的化学反应式如下:
对于铁、镍等金属的表面燃烧,燃烧条件3+1中的1应该是:“比表面积”。所以说教材实验铁丝在氧气中燃烧的成功关键是所选铁丝—定要细,铁丝越细,该实验成功率越高、现象越好。
“比表面积”不仅会影响“表面燃烧”的燃烧现象,还会影响其他不少固体物质的燃烧。如有位中学老师设计、演示了如下与燃烧有关的探究实验:“用两镊子分别夹一张纸条和一块木炭同时在酒精灯火焰上加热,2秒内即可观察到纸条燃烧了起来,但木炭还没被引燃”。该老师引领学生探究并得出如下结论:“是因纸条的着火点比木炭的低,因此纸条能立即燃烧而木炭没被及时引燃。”这个解释又明显不妥了,这里灯焰之温度已经远远超过纸条、木炭的着火点,故着火点不再是该实验现象产生差异的原因,而是因为块状木炭的比表面积比纸小很多之故!如将纸紧压成硬纸板,硬纸板就比薄纸片难引燃了。如将木炭研成粉末撒于空中,一个火星就会引起爆燃。此个案说明比表面积不仅和表面燃烧有关,还和其他一些固体物质的燃烧(如分解燃烧)、爆炸(如粉尘爆炸)等有关。中学教材上的面粉爆炸实验不易做成功,早就有文章提出“面粉的颗粒仍然相对较大,比生粉(超市有售)形成粉尘相对较难”,该文建议选用比表面积更大的生粉来做面粉爆炸实验。
3.混合燃烧和爆炸极限
混合燃烧(又称预混燃烧)是指可燃气体与空气(氧)在燃烧前混合,并形成一定浓度的可燃混合气体,被火源点燃所引起的燃烧。混合燃烧往往是爆炸式的燃烧,通常所说的气体爆炸就属混合燃烧。
平时实验用的酒精喷灯、煤气灯、丁烷灯,家用的燃气灶、燃气热水器等都有个调节进入空气量的阀门,即都可进行预混燃烧。预混燃烧的特点是火焰变短(有时甚至看不到火焰),而产热高(因为燃烧比扩散燃烧、蒸发燃烧更充分),所以选用酒精喷灯、煤气灯、丁烷灯等作加热灯具,火焰温度会更高,加热速度明显增快。
中学化学中与混合燃烧相关的实验主要是一些爆鸣、爆炸实验,如氢氧爆鸣、乙炔爆鸣、氢氯爆鸣、面粉爆炸等等。同行都知晓:这类混合燃烧的实验成功与否,与各自的爆炸极限密切相关。即混合燃烧能否引发,除了“燃烧三因素”全满足外还要加上一条:即当可燃气体、可燃液体的蒸气(或可燃粉尘)与空气混合并达到一定浓度时,遇到火源才会发生爆炸。这个能够发生爆炸的浓度范围,又叫做爆炸极限范围,其浓度通常用气体的体积百分比来表示。在“发生爆炸的浓度范围”内,有一个最低的爆炸浓度叫爆炸下限;还有一个最高的爆炸浓度叫爆炸上限。只有在这两个浓度之间,才有爆炸的可能。在一封闭容器里如果可燃气体、蒸气或粉尘的浓度低于爆炸下限或高于爆炸上限,则遇到明火后既不会爆炸,也不会燃烧。关于氢氯爆鸣实验最需注意的实验关键就是对其爆炸极限的控制。从理论上讲氢氯爆鸣反应中氢气、氯气所耗分子摩尔数应相等,实验中氢气、氯气的体积配比应为1:1最好!但有文章却认为:该实验为确保成功应“在反应容器内收集1/3容积的氢气和2/3容积的氯气”,即认为氢气与氯气的体积比要取1:2。有读者说这一配比的结果会在反应尾气中残留一体积的氯气,为何要这样啊!
如要问:为何教材上只安排氢气而不安排甲烷气体的爆鸣实验?为何氢氯爆鸣实验中氢、氯两气的体积比要选1:2?只要查一下相关的爆炸极限范围即可明白,如氢气与空气混合(室温,101.3kPa)能发生爆炸的氢气浓度范围在4.1%-74.2%,甲烷气与空气混合(室温,101.3kPa)能发生爆炸的甲烷气浓度范围在5.3%~15.0%,乙炔气与空气混合(室温,101.3kPa)能发生爆炸的乙炔气浓度范围在2.5%~80%,—看相关数据就可知道氢气爆鸣、乙炔爆鸣实验都是容易做成功的,而甲烷爆鸣实验是不易做成功的(事实也是如此)。
在氢、氯混合气体体系中(室温,101.3kPa),当用镁光引爆时,H2的爆炸极限在9.8%~52.8%,这里52.8%是上限,就是说H2在混合气体中的含量超过52.8%,爆鸣则不会发生。而当氢:氯的体积比取1:1时,氢的比例已经很靠近其上限了。在收集两种气体时,氢气通常是用启普发生器制取的,其纯度能得到保证,将其按1:1比例混合后,H2的浓度即在50%左右。但氯气的制取往往要有一个排除空气的过程,例如用一个250毫升圆底烧瓶来制取C12,在C12刚产生时瓶内有250毫升的空气,当瓶内的试剂发生反应产生250毫升氯气后,经测试瓶内氯气的浓度仅为65%左右;当产生两倍于容器体积的氯气时(500毫升),瓶内的氯气浓度仅为90%左右。由于氯气是刺激性很强的气体,略有少量溢出就能明显被感觉到,所以当空放250~500毫升气体后,有的教师就认为已达到较纯的浓度了,就作为纯的氯气收集使用。这易使氢气在氢氯混合气体中的比例超过52.8%,使之超出了爆炸极限的范围而导致爆鸣实验的失败。如果用前面提到的1/3左右的氢气,这一比例恰好在氢、氯爆炸极限范围的中心(也有文章提出氢氯体积比取1:1.5、1:1.3等),这样安排时当氯气收集浓度略偏低或混入少量空气与水分时仍能成功地引爆。
所以对于预混燃烧、爆鸣实验而言,燃烧条件3+1中的1应该是:“爆炸极限范围”。所以教材上安排的气体爆鸣实验最常见的是氢氧(空气)爆鸣的演示,到了高中有氢氯爆鸣、乙炔与空气的爆鸣演示等。至今中学化学教材上尚无甲烷(天燃气)的爆鸣实验的安排。而氢气、氯气爆炸根据其爆炸极限特点,应取1,3左右的氢气、2/3左右的氯气,爆炸成功率最高。
4.分解燃烧和催化剂
分解燃烧是指分子结构较复杂的可燃物,在受热时分解出较小分子,该分解产物进一步和空气(氧气)作用而产生的燃烧反应。如天然高分子材料中的木材、纸张、棉、麻、毛以及合成高分子纤维等的燃烧,故分解燃烧通常有火焰。
物质的分解反应常和催化剂发生关联,初中教材制氧气实验中氯酸钾的分解、双氧水的分解都借助了催化剂。高中教材石蜡催化裂化实验中催化剂的选用也提高了分解实验的效果。
现行苏教版化学选修教材《实验化学》第52页上有一个方糖燃烧实验:把一块由蔗糖压制而成的方糖置于酒精灯灯焰上灼烧时,它会熔化、炭化,但不会起燃。将该块方糖沾上少许香烟灰再放在灯焰上灼烧,它在熔化、炭化的同时竞迅速燃烧起来了。这是颇有名气的“烟灰催化实验”。上世纪国外不少中学教材就将其作为引入‘催化剂”概念的趣味实验来介绍,近年来我国也有不少文章对此进行了探究。蔗糖不是高分子化合物,蔗糖分子的碳原子数还少于石蜡,其式量也小于食用油,而且蔗糖受热也会熔化(很似石蜡、动物油)。所以有人认为方糖的上述燃烧不是分解燃烧而属蒸发燃烧,其中香烟灰的作用就如蜡烛烛芯、油灯灯芯的作用。这一质疑及分析看似很有道理,但深入探究后会发现:蔗糖的熔点达185~186℃远高于石蜡、食用油的熔点,然而在190~220℃的温度下,蔗糖便发生分解(其色泽变黑)。再进一步加热则明显有二氧化碳、一氧化碳等气态产物放出。各化学手册均没有常压下蔗糖的沸点、闪点数值(网上查到一些数据自相矛盾,不足信)。因为蔗糖刚过熔点就开始分解,无法形成蔗糖蒸气的闪燃亦无法测得常压下的沸点。将烟灰压紧用来替代蜡烛烛芯或油灯灯芯,实验证明其不起作用,因为烟灰是燃烧后产生的东西,无法象棉芯燃烧时那样产生并维持火焰及特有的红热火星,烟灰就象烧透后的烛芯只能剪掉(没用了)。曾有我国初三师生用氧化铜、二氧化锰等化学试剂替代烟灰也做成了方糖燃烧实验,他们认为:烟灰中金属氧化物为蔗糖燃烧之催化剂的主要成分。综上所述,国内外中学化学教材目前都把该实验中烟灰的作用视作催化作用是有道理的。所以说至少有一些分解燃烧除了燃烧条件三因素之外,还和催化剂等因素有关。
上面讨论到几个不同燃烧的类型,目的是寻找燃烧条件3+1中的1。讨论中我们发现:在周边发生的各种燃烧,大多不能简单地用某一种燃烧类型去套用,如蜡烛的燃烧过程有石蜡的熔化、气化过程,也有气态石蜡和棉灯芯因灼热而分解的过程,故其间既有蒸发燃烧特征,又有分解燃烧的因素,其因分解产生的可燃性气体的燃烧又属扩散型燃烧……,同时还发现周边的各种燃烧现象所涉3+1中的1也往往是错综复杂的,通常不是“1”个因素,而是几个影响因素同时存在。对蜡烛的燃烧爱因斯坦就曾经提出过一个假设:“在失重的情况下,没有对流现象,氧气无法补充,点燃的蜡烛将会熄灭。”即蜡烛的燃烧能否维持,除了燃烧三因素、除了闪点外,竞还和地球引力有关。1996年美国国家航空航天局在太空舱中成功地进行了微重力环境下的蜡烛燃烧实验。实验结果是:蜡烛并未熄灭,火焰慢慢呈蓝色小球状,火焰变得很小(如图8所示),蜡烛的消耗速率减小,火焰的结构也与常规重力下的蜡烛火焰不同。估计爱因斯坦的粉丝们会辩解说这只是微重力环境下测得的情况,不能凭此推翻爱因斯坦的假设。但就这个微重力环境下的实验现象足已证明地球引力对燃烧的维持有明显影响。
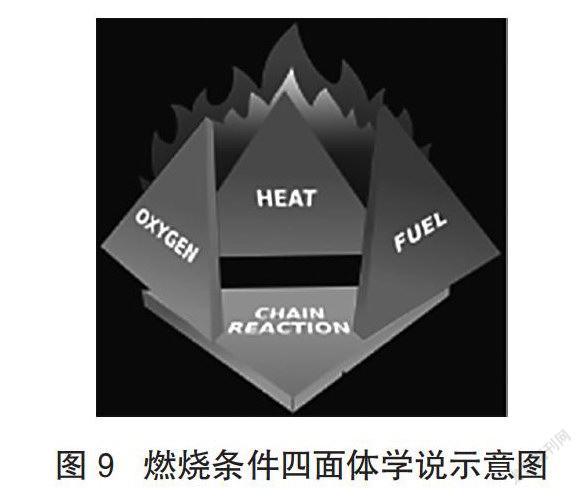
由于情况复杂,所以就应站在较高处来寻觅这燃烧的第4项条件。近代燃烧理论认为,燃烧是一种游离基的链锁反应,即多数可燃物质的氧化反应不是直接进行的,而是经过游离基和原子这些中间体产物的链锁反应进行的。因此有专家提出了燃烧的四面体学说(如图9所示),即除了中学化学所讲的燃烧的三个要素(条件)外,还要加上“能维持不受抑制的链锁反应”这一条。我们把“能维持不受抑制的链锁反应”作为燃烧条件3+1中的1,即站在较高处把错综复杂的影响因素归成这么一条,既简洁又明确。显而易见,对这一问题的深入探究,将有利于我们从微观的角度更科学、更准确地理解燃烧引发时所产生的各种怪异、诡密的现象。至少能避免中学化学里燃烧学入门知识的“半瓶子水”的设置造成的不少指鹿为马、颠倒错位、牛头不对马嘴的解释。

