大黄附子汤对大鼠失血性休克复苏后肠黏膜屏障的保护作用
郭帅 路晓光 战丽彬 范治伟 宋轶 吕春雨 白黎智
失血性休克(hematogenic shock, HS)是临床常见的危重症[1-2]。HS时血液重新分布,肠道成为应激反应的中心,肠黏膜屏障功能破坏,肠源性细菌和内毒素进人血液,是休克后发生脓毒血症和MODS的重要原因之一。正常肠屏障功能的维系依靠机械、免疫、生物、化学4种屏障的共同作用,其中以机械屏障最为重要。上皮细胞紧密连接是构成机械屏障的最主要结构,其结构和功能状态对维持肠屏障的正常功能具有重要作用,对肠黏膜机械屏障的保护是治疗失血性休克的关键[3]。研究表明,ZO-1蛋白是肠道黏膜上皮细胞紧密连接的重要蛋白,被用来作为观察各种组织紧密连接屏障功能和屏障通透性的指标已得到公认[4],P-VASP通过介导ZO-1表达变化,从而调节细胞间紧密连接,调节屏障功能。近年来,中医药在HS并发症防治上越来越具有优势[5-6]。本研究在既往研究的基础上,探索大黄附子汤对HS大鼠肠黏膜屏障功能的保护作用。
材料与方法
一、一般资料
健康清洁级雄性SD大鼠,72只,5~7周龄,体重250~300 g,大连医科大学动物实验中心提供,适应性喂养1周,实验前禁食12 h,禁水4 h。随机分为:对照组、模型组、治疗(大黄附子汤)组,每组24只,各组再按HS模型制备成功后0、6、12 h分为三个亚组,每组8只大鼠。模型组、治疗组采用Wiggers改良法制备HS大鼠模型,模型组以9%等渗盐水保留灌肠,治疗组予以大黄附子汤保留灌肠治疗。
试剂和仪器:大黄附子汤:附子9 g(先煎),大黄9 g(后下),细辛3 g常规水煎制成悬浊液,剂量为200 mL(大连大学附属中山医院药剂科),置100℃水浴消毒80 min,冷却后置4℃冰箱备用。大鼠肠脂肪酸结合蛋白(iFABP)ELISA试剂盒(美国CUSABIO公司)。EKT-5Mset动态革兰氏阴性菌检测试剂盒(一瑞生物工程有限公司)。兔抗大鼠p-VASP蛋白抗体(Serl57)(美国Cell signal公司)。兔抗大鼠ZO-1抗体(美国santa Cruz生物公司)。16道生理信号分析记录系统MPl50(美国BIOPAC公司)。
二、方法
1.动物模型制作:采用Wiggers改良法制备HS大鼠模型[7-9]。(1)腹腔注射20 g/L戊巴比妥钠(按40 mg/kg)麻醉。(2)行右颈总动脉插管,外接16道生理信号分析记录系统监测平均动脉压(MAP)。(3)左股动脉留置导管,按800 U/kg全身肝素化后左股动脉导管放血,HS 0 h组、6 h组、12 h组大鼠经放血1.5~2 mL后血压降至35~45 mmHg,停止后血压逐渐上升,再次缓慢放血后血压降至35~45 mm Hg并稳定60 min。(4)复苏:经右股静脉回输全部放出的血液及2倍量的林格氏液,复苏标准为平均动脉压稳定在90 mmHg(1 mmHg=0.133KPa)。对照组大鼠仅进行手术插管及肝素化处理。各组大鼠于各时相点进行标本取材。
2.治疗方案:对照组依次行腹腔麻醉,右颈总动脉、右股静脉、左股动脉插管及全身肝素化后即刻、3、8 h分别予以0.9%等渗盐水2 mL保留灌肠。模型组和大黄附子汤组分别在复苏后即刻、3 h、8 h分别予以0.9%等渗盐水、大黄附子汤2 mL保留灌肠。
3.指标检测:分别于0、6、12 h经右股静脉采血,4℃以3 000 r/min速度全血离心,30 min分装血清,ELISA法检测静脉血清中IFABP浓度的变化,动态比浊法检测血清中LPS浓度的变化。光镜观察大鼠回肠黏膜病理改变,采用Chiu等[10]的方法计算小肠上皮细胞损伤指数(表1)。 Western blot与免疫组化法测定ZO-1、p-VASP蛋白表达。

表1 小肠上皮损伤指数分级标准
三、统计学分析
结 果
一、血清中LPS含量变化
与对照组比较,模型组在复苏后即刻,大鼠血清中LPS含量明显升高,差异具有显著统计学意义(P<0.01);与模型组比较,大黄附子汤组大鼠血清中LPS含量在6 h降低,差异具有统计学意义(P<0.05),在12 h时明显降低,差异具有显著统计学意义(P<0.01)见表2。

表2 对照组、模型组、大黄附子汤组大鼠血清LPS含量变化
注:与对照组比较:aP<0.01;与模型组比较:cP<0.05,dP<0.01。LPS为内毒素;HS为失血性休克。
二、血清中IFABP含量的变化
与对照组比较,模型组在休克1 h时,大鼠血清中IFABP含量明显升高,差异具有显著统计学意义(aP<0.01);与模型组比较,大黄附子汤组大鼠血清中IFABP含量在6 h降低,差异具有统计学意义(cP<0.05),在12 h时明显降低,差异具有统计学意义(dP<0.01)。见表3。

表3 对照组、模型组、大黄附子汤组大鼠血清IFABP含量变化
注:与对照组比较:aP<0.01;与模型组比较:cP<0.05,dP<0.01。IFABP为脂肪酸结合蛋白;HS为失血性休克。
三、光镜下小肠黏膜改变。
光镜下复苏后大鼠小肠黏膜层绒毛水肿严重,黏膜固有层腺体呈灶性区域性坏死;大黄附子汤组6、12 h小肠粘膜变化明显减轻,且小肠黏膜绒毛水肿、坏死及倒伏程度均好于模型组(见图1)。与对照组比较,模型组在休克复苏后,小肠上皮损伤指数明显升高,差异具有显著统计学意义(P<0.01);与模型组比较,大黄附子汤组大鼠小肠上皮损伤指数在6 h降低,差异具有统计学意义(P<0.05),在12 h时明显降低,差异具有统计学意义(P<0.01),见表4。

注:a.对照组0 h;b.对照组6 h;c.对照组12 h;d.模型组0 h;e.模型组6 h;f.模型组12 h;g.大黄附子汤组0 h;h.大黄附子汤组6 h;i.大黄附子汤组12 h
图1对照组、模型组和大黄附子汤组小肠HE染色组织病理学表现(HE×400)
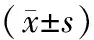
表4 对照组、模型组、大黄附子汤组大鼠小肠组织学评分
注:与对照组比较:aP<0.01;与模型组比较:cP<0.05,dP<0.01。HS为失血性休克。
四、小肠黏膜ZO-1、P-VASP蛋白含量变化
免疫印迹结果显示模型组、大黄附子汤组各时间点小肠黏膜ZO-1蛋白含量、免疫组化评分均较对照组低,差异具有统计学意义(P<0.01);与模型组比较大黄附子汤组小肠黏膜ZO-1蛋白含量明显升高,差异具有统计学意义(P<0.01);P-VASP蛋白含量、免疫组化评分均较对照组高,差异具有统计学意义(P<0.01);与模型组比较大黄附子汤组小肠黏膜P-VASP蛋白含量明显降低,差异具有统计学意义(P<0.01)。(见表5,图2~4)。
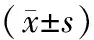
表5 对照组、模型组、大黄附子汤组大鼠小肠ZO-1、P-VASP蛋白表达情况
注:与对照组比较:aP<0.01;与模型组比较:cP<0.05,dP<0.01

图2各组大鼠小肠ZO-1、P-VASP蛋白表达情况。A/E=β-actin;B/F= ZO-1/P-VASP对照组6 h、12 h;C/G=ZO-1/P-VASP模型组6 h、12 h;D/H=ZO-1/ P-VASP治疗组6 h、12 h。
治疗组与模型组比较,随时间推移血流增加,血清内毒素、脂肪酸结合蛋白(IFABP)含量逐渐减低,肠道黏膜损伤程度逐渐减轻,p-VASP蛋白表达下调,ZO-1表达上调。
讨 论
失血性休克时由于体内血流重新分布,肠道最先受累且缺血最重。黏膜屏障功能的破坏,肠道菌群移位是导致疾病恶化的根本原因[11],其诱发、加重全身炎性反应综合征和多器官功能障碍综合征,后者释放各种炎性介质和细胞因子,再次加重肠损伤,形成恶性循环[12-13]。
本研究监测HS大鼠复苏后肠道血流量,提示HS复苏后各时间点大鼠回肠末端血流量较对照组明显减少,复苏后肠道缺血持续存在(另文报告),体内LPS水平、血清IFABP含量明显增高。与Vega等[14]的研究结果一致,提示肠道缺血引发了肠黏膜的透过性增加,肠道长时间缺血导致小肠黏膜屏障功能遭到破坏,大量细菌及内毒素释放入血。
肠黏膜上皮细胞的紧密连接是维持肠黏膜机械屏障功能最重要的因素[15-17],是细胞间最重要的连接方式,也是维持肠黏膜机械屏障功能最重要的结构基础。本研究表明,大鼠HS复苏后,细胞的紧密连接即发生变化,与上皮细胞间紧密连接形成的最重要的结构蛋白ZO-1表达下调,并与血浆细菌内毒素、血清IFABP及肠道黏膜损伤程度变化趋势具有一致性。
大黄附子汤源自张仲景《金匮要略》,由大黄、附子、细辛组成,含大黄素、乌头碱和细辛醚等有效成分。方中三药合用,寒热并重,既温肾暖脾,助阳以扶正,又通腑泄热,活血散结以祛邪,有效改善胃肠功能,减少肠内有害物质的吸收和进入体内的细菌数量,降低肠源性内毒素移位的发生率[18-19]。

注:a.对照组0 h;b.对照组6 h;c.对照组12 h;d.模型组0 h;e.模型组6 h;f.模型组12 h;g.大黄附子汤组0 h;h.大黄附子汤组6 h;i.大黄附子汤组12 h
图3对照组、模型组和大黄附子汤组ZO-1免疫组化表达(HE×200)

注:a.对照组0 h;b.对照组6 h;c.对照组12 h;d.模型组0 h;e.模型组6 h;f.模型组12 h;g.大黄附子汤组0 h;h.大黄附子汤组6 h;i.大黄附子汤组12 h
图4对照组、模型组和大黄附子汤组P-VASP免疫组化表达(HE×200)
本研究结果显示,HS大鼠复苏后辅以大黄附子汤, 能够显著降低血清浓度IFABP和内毒素水平。表明大黄附子汤通过调节ZO-1、p-VASP蛋白,减轻了失血性休克复苏后肠道黏膜屏障损伤。
1 赵晓东.战(创)伤失血性休克的液体复苏策略及存在的问题[J].中华急诊医学医学杂志,2013,22(10):1080-1083.
2 Vanzant EL1,Hilton RE2,Lopez CM,et al.Advanced age is associated with worsened outcomes and a unique genomic response in severely injured patients with hemorrhagic shock[J].Crit Care,2015,19:77.
3 Angele MK,Schneider CP,Chaudry IH.Bench-to-bedside review: latest results in hemorrhagic shock[J].Crit Care,2008,12(4):218.
4 王庆刚,雷若庆,许志伟,等.急性出血坏死性胰腺炎大鼠肠道黏膜屏障功能变化及己酮可可碱对其的保护作用[J].中华胰腺病杂志,2011,11(2):117-120.
5 康新,梁正凯,路晓光,等.大黄附子汤对重症急性胰腺炎肠黏膜上皮细胞线粒体超微结构和离子泵的影响[J].中华实验外科杂志,2015,23(1):41-44.
6 王小周,路小光,康新,等.丙酮酸钠液腹腔复苏对失血性休克大鼠肠黏膜屏障的保护作用[J].中华急诊医学杂志,2014,23(10):1120-1124.
7 褚万立,刘军英,刘雪峰,等.失血性休克大鼠模型的改进及胃黏膜血流量的测定[J].中国实验动物学报,2008,16(1):6-9.
8 Shi HP,Deitch EA,Da Xu Z,et al.Hypertonic saline improves intestinal mucosa barrier function and lung injury after trama-hemorrhagic shock[J].Shock,2002,17(6):496-501.
9 Hammerman C,Goldschmidt D,Caplan MS,et al.Amelioration of ischemreperfusion injury in rat intestine by pentoxifyline-mediated inhibit of xanthine oxidase[J].J Pediatr Gastrol Nutr,1999,29(1):69-74.
10 Chiu CJ,McArdle AH,Brown R,et al.Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J].Arch Surg,1970,101(4):478-483.
11 Sonnier Dl,Makley AT,Friend LA,et al.Hemorrhagic shock induces a proinflammatory milieu in the gut lumen[J].J Surg Res,2011,170(2):272-279.
12 Tiall R,Tan JT,Wang RL,et al.The role of intestinal mucosa oxidativestress in gut barrier dysfunction of severe acute pancreatitis [J].Eur Rev Med Pharmacol Sci,2013,17(3):349-355.
13 刘莉,路小光,范治伟,等. 失血性休克对大鼠肠黏膜屏障Occludin表达的影响[J]. 中华创伤杂志,2013,29(12):1230-1235.
14 Vega D,Badami CD,Caputo FJ,et al.The influence of the typeof resuscitation fluid on gut injury and distant organ injury in a ratmodel of trauma/hemorrhagic shock[J].J Trauma,2008,65(2):409-415.
15 Wang N,Yu H,Ma J,et al.Evidence for tight junction proteindisruption in intestinal mucosa of malignant obstructive jaundicepatients[J].Seand J Gastroenterel,2010,45(2):191-199.
16 Smyth SH,Doyle-McCullough M,Cox OT,et al.Effect of re.productive status on uptake of latex mieroparticles in rat small intestine[J].Life Sci,2005,77(26):3287-3305.
17 Walsh-Reitz MM,Huang EF,Musch MW,et al.AMP-18protects barrier function of colonic epithelial cells:role of tightjunction proteins[J].Am J Physiol Gastrointest Liver Physiol,2005,289(1):163-171.
18 路小光,战丽彬,康新,等.大黄附子汤对急性坏死性胰腺炎大鼠小肠黏膜屏障功能的保护作用[J].中华胰腺病杂志,2011,11(2):113-116.
19 路小光,战丽彬,康新,等.重症急性胰腺炎并发肺损伤促/抗炎症因子的变化及大黄附子汤的干预研究[J/CD].中华临床医师杂志(电子版),2010,4(11):22-26.

