唐古特白刺果多糖对免疫受抑小鼠IFN-γ及T/NK细胞亚群的影响
秀仁杰(1990~),女,蒙古族,青海籍,2012级科学班研究生.* :通信作者,教授,E-mail:gampl2003@aliyun.com
唐古特白刺果多糖对免疫受抑小鼠IFN-γ及T/NK细胞亚群的影响
秀仁杰1,索有瑞2,耿排力1*
(1.青海大学医学院 青海 西宁 810001;
2.中国科学院西北高原生物研究所藏药研究中心 青海 西宁 810001 )
摘要目的本研究采用环磷酰胺建立免疫抑制模型,探讨唐古特白刺果(NTB)多糖对免疫受抑小鼠IFN-γ及T/NK细胞亚群的影响。方法以光学显微镜观察各组小鼠脾脏组织结构的变化;以双抗体夹心法(ELISA)观察NTB多糖对免疫受抑小鼠血清中IFN-γ的影响;以RT-PCR法观察IFN-γ的mRNA表达;以流式细胞术检测CD3、CD4、CD8及NK(CD49b)细胞在内的T/NK细胞亚群的变化。结果模型+NTB多糖组淋巴滤泡增加明显;NTB多糖使免疫受抑小鼠血清IFN-γ的含量显著增加,其mRNA的表达增强。模型+NTB多糖组, CD3`+、CD4`+、CD8`+、NK(CD49b)细胞显著升高。结论NTB多糖可使免疫受抑小鼠脾脏组织中淋巴细胞数量增多且结构明显改善;能够明显增强免疫受抑小鼠血清IFN-γ的含量并增强IFN-γ mRNA的表达;NTB多糖能使参与细胞免疫的CD3、CD4、CD8及NK(CD49b)细胞数量增加。
关键词NTB多糖免疫受抑模型IFN-γT/NK细胞亚群
中图分类号R392.5
文献标识码A
DOI:10.13452/j.cnki.jqmc.2015.03.007
AbstractObjectiveTo explore the effect of Nitraria tangutorum Bobr(NTB)polysaccharide on interferon-γ(IFN-γ)and T/NK subsets in immunosuppressed mice model induced by cyclophosphamide.Method The amount of spleen cells and the structure of spleen were observed by light microscope;The contents of IFN-γ were determined by enzyme linked immunoabsorbent assay(ELISA)in serum and the expression of IFN-γ mRNA were observed by reverse transcription-polymerase chain reaction(RT-PCR)in immunosuppressed mice ;the function and the quantity of CD3,CD4,CD8 and NK(CD49b) cells which participating in cellular immunology were detected by Flow Cytometry(FCM).Result Lymphoid follicles in model + NTB polysaccharide group increased significantly; and the serum IFN-γ content was significantly increased,and the expression of IFN-γ mRNA enhanced as well.CD3`+,CD4`+,CD8`+ and NK(CD49b)cells were significantly increased in model+NTB polysaccharide group.Conclusion NTB polysaccharide can increase the spleen lymphocytes and improve the structure of thymus and spleen in immunosuppressed mice.The NTB polysaccharide can significantly increase serum IFN-γ and IFN-γmRNA expression; it can also increase the number of CD3,CD4,CD8 and NK(CD49b)cells which involving cellular immunity.
KeywordsNitraria tangutorum BobrImmunosuppressed mice modelIFN-γT/NK subsets
收稿日期2015-01-05
EFFECT OF NITRARIA TANGUTORUM BOBR POLYSACCHARIDE
ON IFN-γ AND T/NK SUBSETS IN IMMUNOUSUPPRESSED MICE
Xiu Renjie1,Suo Yourui2,Geng Paili1
(1.Qinghai University Medical College,Xining,Qinghai 810001;
2.Research center for Tibetan medicine,Institute of northwestern Plateau,Chinese Academy of science,
Xining,Qinghai 810001)
唐古特白刺(Nitraria tangutorum Bobr,NTB)为蒺藜科(Zygophyllceae)白刺属(Nitraria)植物。现代药理学研究表明它具有降血脂、降血糖、抗氧化、抗疲劳、抗菌[1-3]等作用。索有瑞等[4]研究发现白刺果实具有调节免疫作用。本研究拟通过环磷酰胺建立免疫抑制模型,探讨唐古特白刺果(NTB)多糖对免疫功能的影响。
1材料与方法
1.1 材料
1.1.1药品及试剂
唐古特白刺果(采自青海省德令哈市天然白刺林场,经中国科学院西北高原生物研究所索有瑞研究员鉴定为柴达木产唐古特白刺果正品,共4000 g,烘干后粉碎,冷藏备用);环磷酰胺[FCM,批号14022425,江苏恒瑞医药股份有限公司生产(每瓶0.2g)];石油醚(沸程 30℃~60℃)、正丁醇、生理盐水(0.9%)、无水乙醇(国产分析纯);FITC-CD3、PE-CD4、ECY5-CD8、NK(CD49b)(美国BD公司产品);肝素抗凝剂、红细胞裂解液、Elisa(IFN-γ)检测试剂盒(武汉博士德生物有限公司);Trizol试剂、逆转试剂盒、2*TAQpcrmix、5*TAE(天根生化科技有限公司)。引物由华大基因生物工程公司合成。
1.1.2主要仪器
超微细粉碎机(上海泰斯特仪器);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);R-201旋转蒸发仪(上海申顺生物科技有限公司);Cary300型紫外可见分光光度计(美国Varian公司);78HW-1定时恒温磁力搅拌器(金坛市正基仪器有限公司);流式细胞仪(美国Becton Dickinson公司);BIO-RAD Smartspec3000紫外可见分光光度计(BIO-RAD公司);酶标仪(BIO-RAD公司);PCR仪(杭州博日科技有限公司)。
1.2 方法
提取唐古特白刺果的多糖成分,观察其对免疫受抑小鼠脾细胞数量及脾脏组织结构的影响;测定血清γ干扰素(Interferon-γ,IFN-γ)含量及IFN-γmRNA的表达;以流式细胞仪检测各组参与免疫应答的淋巴细胞亚群CD3、CD4、CD8以及自然杀伤细胞(Natural Killer,NK )细胞的变化。
1.2.1NTB多糖提取及其多糖含量的测定
NTB果实多糖提取工艺流程:NTB干果→清洁粉碎→加4倍体积石油醚除脂→滤渣挥干加10倍体积80%乙醇85 ℃回流提取2次→滤渣中加入5倍体积蒸馏水→ 90 ℃提取3次,每次60 min →水提液减压蒸馏浓缩→双氧水氧化法脱色→Sevag法去蛋白→乙醇沉淀→有机溶剂脱水→冷冻干燥→NTB多糖。其多糖含量测定时用标准葡萄糖溶液,以苯酚-硫酸法测定。建立回归方程为y=0.0094x-0.0256,R2=0.9986。测得多糖含量为47.78%。
1.2.2动物及分组
昆明种小鼠36只,清洁级,质量(25±2)g,雌雄各半;购自青海省地方病研究所,合格证号:2014009。随机分为三组,每组12只,设正常对照组、模型组及模型+NTB多糖组。模型组腹腔注射环磷酰胺(80mg/kg),连续5 d。模型+NTB多糖组腹腔注射环磷酰胺(80mg/kg),连续5 d,造模成功后腹腔注射NTB多糖(3.6g/kg)[6],连续10 d。正常对照组腹腔注射等量生理盐水。末次给药24 h后断颈采血,称取脾脏和胸腺,取外周血测定IFN-γ、CD3、CD4、CD8及NK(CD49b)的含量。
1.2.3脾脏、胸腺免疫器官及脾脏组织结构观察
末次给药24 h后,断颈处死各组小鼠,无菌取出脾脏和胸腺,小心清除脾脏及胸腺附着的结蹄组织,用生理盐水清洗,吸水纸吸干水分后用分析天平称重,计算脾脏指数和胸腺指数。脾脏称重后固定做石蜡切片,HA染色,40倍显微镜下观察淋巴滤泡及其结构。
1.2.4脾细胞IFN-γ的mRNA提取
按上述方法取出脾脏后制成脾细胞悬液,采用Trizol试剂盒按说明书操作提取总RNA。所提RNA溶于DEPC处理水(50 μL)溶解,用5 μL在紫外分光光度计下检测RNA的纯度以及定量,总RNA-80 ℃保存备用,其余-20 ℃保存备用。
1.2.5逆转录(RT-PCR)合成
反应合成cDNA 取上述mRNA溶液10 μL,按照逆转录试剂盒操作进行cDNA 扩增,反应产物即cDNA,-20 ℃保存备用(引物序列见表1)。

表1 IFN-γPCR扩增引物序列
1.2.6PCR扩增
以上述cDNA为模板进行PCR扩增,PCR反应体系总体积为50 μL。逆转录反应:42 ℃ 50 min;接着95 ℃ 5 min灭活逆转录酶。PCR反应循环参数设置:变性温度85 ℃ 1 min;退火温度54 ℃ 1 min;延伸温度72 ℃ 2 min;共40个循环。72 ℃保温7 min。
1.2.7PCR产物定量
取PCR扩增产物20 μL用5%琼脂糖凝胶进行电泳;1% Gel Green显色后用Bio Rad mycycler凝胶扫描仪对电泳凝胶中的PCR产物条带进行密度扫描,以β-actin作为RT-PCR的质控,计算IFN-γ mRNA与其对应的β-actin峰面积的比值,从而得出NTB多糖对免疫受抑小鼠IFN-γmRNA 表达的影响。
1.2.8小鼠血清IFN-γ的测定
用外周血(0.5mL)分离血清,采用双抗体夹心法(ELISA)测定血清IFN-γ含量。取50 μL血清稀释3倍后加入酶标板内,具体操作步骤按ELISA试剂盒说明进行。
1.2.9T/NK细胞亚群分析
各组外周血T淋巴细胞亚群及NK细胞的检测:取血约0.5 mL用肝素抗凝,取200 μL抗凝血加入单克隆抗体CD3、CD4、CD8和NK(CD49b)荧光标记单克隆抗体20 μL中充分混匀,避光孵育20~35 min,标记样品中分别加入红细胞裂解液,白细胞(WBC)稳定剂及细胞膜固定剂处理后用流式细胞仪进行检测。
1.2.10统计学处理
2结果
2.1 NTB多糖对免疫受抑小鼠脾脏及胸腺重量及指数的影响(表2)
表2 NTB多糖对免疫受抑小鼠脾脏及胸腺重量、指数的影响( ± s)
Table 2 Effect of NTB polysaccharedes on the weight of spleen and thymus in immunosuppressed mice( ± s)
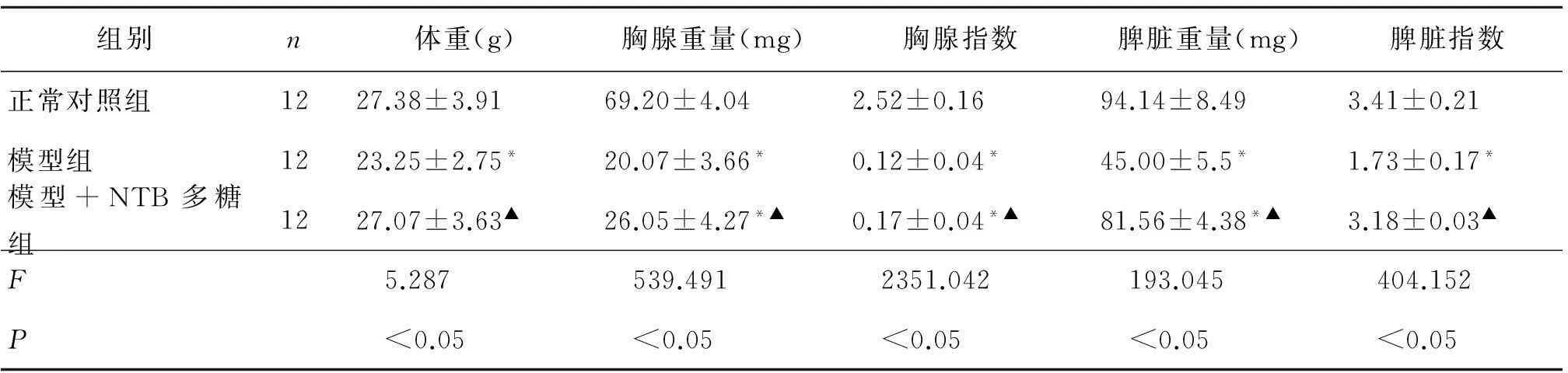
表2 NTB多糖对免疫受抑小鼠脾脏及胸腺重量、指数的影响( ± s)
组别n体重(g)胸腺重量(mg)胸腺指数脾脏重量(mg)脾脏指数正常对照组1227.38±3.9169.20±4.042.52±0.1694.14±8.493.41±0.21模型组1223.25±2.75*20.07±3.66*0.12±0.04*45.00±5.5*1.73±0.17*模型+NTB多糖组1227.07±3.63▲26.05±4.27*▲0.17±0.04*▲81.56±4.38*▲3.18±0.03▲F 5.287 539.491 2351.042 193.045 404.152P <0.05 <0.05 <0.05 <0.05 <0.05
注:*表示与正常对照组比较P<0.05;▲表示与模型组比较P<0.05.Notes:*compared with normol groupP<0.05;▲compared with model groupP<0.05.
表2显示,模型组与正常对照组相比,胸腺及脾脏重量均下降,差异显著(P<0.05);模型+NTB多糖组与模型组相比其胸腺及脾脏重量均显著上升,有明显差异(P<0.05)。
2.2 NTB多糖对免疫受抑小鼠脾脏组织结构的影响(图1)

1 正常对照组2 模型组3 模型+NTB多糖组
1 Normal Group2 Model Group3 Model+NTB polysaccharide Group
图1各组小鼠脾脏组织结构变化图
Figure 1Changes of the spleen structure in the three groups
图1显示,模型组淋巴滤泡及淋巴小结消失,模型组与正常组相比有明显差异;模型+NTB多糖组与模型组差异明显,模型+NTB多糖组的淋巴滤泡及淋巴小结恢复。
2.3 NTB多糖对免疫受抑小鼠脾细胞IFN-γ mRNA表达的影响(表3,图2)
表3 NTB多糖对免疫受抑小鼠脾细胞IFN-γmRNA表达的影响( ± s)
Table 3 Effects of NTB polysaccharedes on IFN-γ mRNA expression in Immunosuppressed mice( ± s)

表3 NTB多糖对免疫受抑小鼠脾细胞IFN-γmRNA表达的影响( ± s)
组别nIFN-γ/β-actin血清IFN-γ(pg·mL-1)正常对照组120.564±0.132723.66±6.99模型组120.267±0.225*505.56±4.45*模型+NTB多糖组120.545±0.227▲886.64±4.28*▲F 8.322 15131.033P <0.05 <0.05
注:*表示与正常对照组比较P<0.05;▲表示与模型组比较P<0.05.Notes:*compared with normol groupP<0.05;▲compared with model groupP<0.05.
表3显示,模型+NTB多糖组与模型组相比,IFN-γ显著升高,差异显著(P<0.05)。
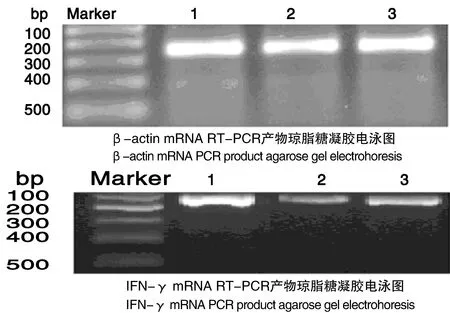
1模型+NTB多糖组2模型组3正常对照组
1 Model+NTB polysaccharide Group2 Model Group3 Normal Group
图2RT-PCR产物琼脂糖凝胶电泳图
Figure 2RT-PCR agarose gel electrophoresis
图2显示,半定量分析NTB对小鼠脾细胞中IFN-γ mRNA表达的影响,其目的条带与内参(β-actin)相比较,模型+NTB组可明显增强IFN-γ mRNA的表达(P<0.05),并使免疫受抑小鼠模型IFN-γ的mRNA表达接近正常对照组水平。
2.4 NTB多糖对外周血T/NK细胞亚群的影响(表4,图3~5)
表4 NTB多糖对外周血淋巴细胞/NK细胞亚群的影响( ± s)
Table 4 Impact of NTB polysaccharides on peripheral blood lymphocytes and NK subsets( ± s)

表4 NTB多糖对外周血淋巴细胞/NK细胞亚群的影响( ± s)
组别nCD3+(%)CD4++(%)CD8+(%)NK(%)正常对照组1266.2±16.3633.1±3.0619.3±1.4022.5±0.29模型组1238.6±8.24*13.5±9.07*11.1±8.86*10.8±2.04*模型+NTB多糖组1267.4±13.06▲32.6±2.30▲17.6±6.42▲21.7±1.03▲F 18.881 46.382 5.542 289.835P <0.05 <0.05 <0.05 <0.05
注:*表示与正常对照组比较P<0.05;▲表示与模型组比较P<0.05.Notes:*compared with normol groupP<0.05;▲compared with model groupP<0.05.
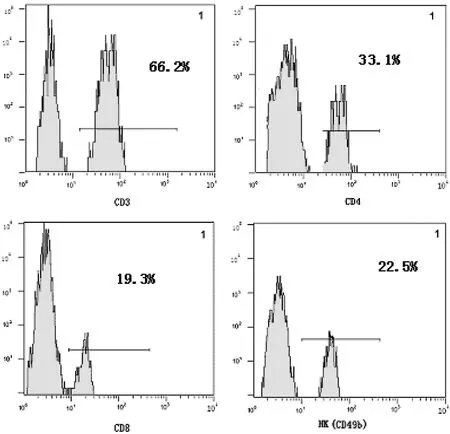
图3 正常对照组CD3、CD4、CD8及NK细胞比值

图4 模型组CD3、CD4、CD8及NK细胞比值

图5 模型+NTB多糖组CD3、CD4、CD8及NK细胞比值
表4及图3~5可见,与模型组相比,模型+NTB组CD3+、CD4+、CD8+、NK(CD49b)细胞显著升高(P<0.05),说明NTB多糖对免疫受抑小鼠T细胞亚群及NK细胞具有保护和促进作用。
3讨论
近年来,国内外学者对中药多糖从不同角度进行了大量研究,并逐步阐明其化学、生理学和药理学等多方面的性质[5-6]。
本研究在索有瑞等前期工作基础上,利用NTB多糖对小鼠免疫受抑模型进行干预,观察其免疫器官及细胞因子、淋巴细胞亚群、NK细胞在内的多项指标。实验结果表明,NTB多糖对免疫受抑小鼠模型受损的脾、胸腺具有保护作用。这与张乐萃等以复方中药多糖,张晓冬用大枣和地黄多糖观察其对免疫器官影响的研究结果有相同之处[7-8]。
IFN-γ是诸多细胞因子的一种,它能对宿主免疫细胞活性产生影响,如对巨噬细胞、T细胞、B细胞和NK细胞等均有调节作用[9]。本实验中我们观察到,NTB多糖能增强免疫受抑小鼠脾细胞中IFN-γ的mRNA表达,亦能增加血清中IFN-γ含量。
T细胞亚群按其CD抗原主要分为三类,其中CD3主要代表成熟T细胞,而CD4则代表辅助性T细胞(Th),CD8代表抑制性T细胞(Ts)[10]。临床上,通过检测外周血T细胞亚群及Th/Ts比值了解患者的免疫状态。可以说,Th和Ts亚群是免疫应答的核心枢纽。本实验中,NTB多糖可上调由免疫抑制剂环磷酰胺导致的T细胞亚群数量降低,对免疫系统呈现有效的保护作用。NK细胞作为天然免疫系统的重要效应细胞,通过介导细胞毒性免疫反应,分泌细胞因子等途径发挥免疫监视、免疫调节的重要功能。本实验中,NTB多糖亦能提高低下的NK(CD49b),这说明对以NK为代表的非特异性免疫也有较强的调整作用。朱彩平、张声华报道,枸杞多糖对肝癌H22荷瘤鼠的T淋巴细胞和NK细胞活性具有增强作用[11]。谭周进、谢大凭和Ims A等也有类似的报道[12-13]。
NTB多糖的特殊结构可能有利于宿主免疫系统的识别,不仅能提高机体的非特异性免疫,还能够提高特异性免疫。至于其提高和调整免疫功能详细机制有待进一步研究。
参考文献
[1]索有瑞,王洪伦,汪汉卿.柴达木盆地唐古特白刺果实降血脂和抗氧化作用研究[J].天然产物研究与开发,2004,16(1):54-58.
[2]朱利娜,强伟,史俊友,等.唐古特白刺果粉的抗氧化作用研究[J].中国野生植物资源,2010,29(2):41-44.
[3]马挺军,徐艺青.西伯利亚白刺籽油的抗疲劳活性[J].中国实验动物学报,2012,20(5):77-79.
[4]索有瑞,李玉林,王洪伦,等.柴达木盆地唐古特白刺果实调节免疫、抗疲劳和耐寒冷作用研究[J].天然产物研究与开发,2005,17(6):717-721.
[5]常改,杨溢,霍飞,等.植物多糖的研究进展及保健功能[J].中国公共卫生,2003,19(11):1394-1395.
[6]陶遵威,郑夺,邸明磊,等.植物多糖的研究进展[J].药物评价研究,2010,33(2):148-152.
[7]张乐萃,王金宝,孙月平,等.复方中药多糖对鸡免疫器官形态学的影响[J].中国兽医科技,1998,28(8):26-28.
[8]张晓冬.两种中药多糖对小鼠性腺及免疫器官的影响[J].中国保健营养(中旬刊),2013,10:42-44.
[9]B. Wei,S.Baker,J.Wieckiewicz,et al.IFN-γ Triggered STAT1-PKB/AKT Signalling Pathway Influences the Function of Alloantigen Reactive Regulatory T Cells[J].American Journal of Transplantation,2010,10(1):69-80.
[10]Marik Jutel,Cezim A. Akdis.T Cell Subset Regulation in Atopy[J].Current Allergy and Asthma Reports,2011,11(2):139-145.
[11]朱彩平,张声华.枸杞多糖对肝癌H22荷瘤鼠的抑瘤和免疫增强作用[J].营养学报,2006,28(2):182-183.
[12]谭周进,谢大凭. 多糖的研究进展[J].食品科技,2002,(3):10-12.
[13]Ims A,Kim K,Lee CK.Immunomodulatory activity of polysaccharides isolated from Salicornia herbacea[J].Int Immunopharmcol,2006,6(9):1451-1458.

