两种土著水生植物对铀矿坑水的修复能力研究
两种土著水生植物对铀矿坑水的修复能力研究
聂小琴1,董发勤1,*,丁德馨2,刘宁3,李广悦2,张东4,刘明学1
(1.西南科技大学 核废物与环境安全国防重点学科实验室,四川 绵阳621010;
2.南华大学 铀矿冶生物技术国防重点学科实验室,湖南 衡阳421001;
3.四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室,四川 成都610064;
4.中国工程物理研究院 核物理与化学研究所,四川 绵阳621900)
摘要:通过野外采样、室内分析和水培实验,研究了某废弃铀矿坑水中的土著水生植物大薸(Pistia stratiotes L.)和凤眼莲(Eichhornia crassipes)对铀矿坑水的原位修复能力。野外采样分析结果表明,大薸和凤眼莲对废弃铀矿坑水中的铀有极强的富集能力。废弃铀矿坑水中铀浓度在0.4~0.6 mg/L之间,高出国家排放标准(GB 23727—2009)规定值(0.05 mg/L)的10倍左右。废弃铀矿坑水中土著水生植物大薸和凤眼莲根系平均铀含量分别为1 015.40 mg/kg (干重)和504.87 mg/kg (干重);富集系数分别为2 071和1 001。水培实验结果表明,大薸对铀矿坑水中铀的去除能力与植物生长期、生物量和覆盖水体面积呈正相关。生长后期(单株生物量鲜重≥100 g)的大薸、凤眼莲,投加量为100 g/L时,10 d可将铀矿坑水中铀浓度由1.93 mg/L降至0.03 mg/L以下,去除率达到98% 以上。SEM-EDS结果表明,大薸和凤眼莲在酸性条件下与水体中的铀结晶矿化,生成纳米片状晶体堆簇在根系表面;在碱性条件下(接近废弃铀矿坑水的pH值时),未出现类似矿化结晶体。表明大薸和凤眼莲对于不同酸度的铀废水体系有不同的修复机理。
关键词:铀矿坑水;大薸;凤眼莲;植物修复
中图分类号:X171 文献标志码:A
收稿日期:2014-06-23;修回日期:2014-09-13
基金项目:973计划资助项目(2014CB846003);国家自然科学基金青年基金资助项目(41502316);核废物与环境安全国防重点学科实验室预先研究基金资助项目(15yyhk11);西南科技大学博士研究基金资助项目(15zx7109)
作者简介:聂小琴(1985—),女,四川安县人,助理研究员,博士,核燃料循环与材料专业
doi:10.7538/yzk.2015.49.11.1946
*通信作者:董发勤,E-mail: fqdong2004@163.com
Ability ofPistiastratiotesL. andEichhorniacrassipes
for Remediation of Uranium-contaminated Waste Water
NIE Xiao-qin1, DONG Fa-qin1,*, DING De-xin2, LIU Ning3, LI Guang-yue2,
ZHANG Dong4, LIU Ming-xue1
(1.FundamentalScienceonNuclearWastesandEnvironmentalSafetyLaboratory,
SouthwestofScienceandTechnology,Mianyang621010,China;
2.FundamentalScienceonBiotechnologyinUraniumMiningandHydrometallurgy,
UniversityofSouthChina,Hengyang421001,China;
3.KeyLaboratoryofRadiationPhysicsandTechnology,MinistryofEducation,
InstituteofNuclearScienceandTechnology,SichuanUniversity,Chengdu610064,China;
4.InstituteofNuclearPhysicsandChemistry,
ChinaAcademyofEngineeringPhysics,Mianyang621900,China)
Abstract:The field sampling, laboratory analysis and hydroponic solution culture experiments were conducted on the native aquatic plants, Pistia stratiotes L. and Eichhornia crassipes in-situ repair ability of uranium mine pit water. The results of field sampling analysis show the strong enrichment of uranium from abandoned uranium mine pit water by Pistia stratiotes L. and Eichhornia crassipes. The uranium concentration range of abandoned uranium mine pit water is between 0.4 mg/L to 0.6 mg/L, which is about 10 times higher than the national emission standards of China. The mean uranium concentrations (dry weight) in roots of Pistia stratiotes L. and Eichhornia crassipes are 1 015.40 mg/kg and 504.87 mg/kg, and the enrichment coefficients are 2 071 and 1 001, respectively. The results of hydroponic solution culture experiments show that the uranium removal ability is closely relative to the growing period and fresh weight of per plant and the area of the plant covering water. 100 g of Pistia stratiotes L. or Eichhornia crassipes at the mature stage (fresh weight more than 100 g per plant) are grown in 1 L of uranium mine pit water with the initial concentration of uranium was 1.93 mg/L, after 10 days, the uranium concentration reduces to below the national emission standards of China, and the uranium removal rates are higher than 98%. SEM-EDS results show that a mass of uranium precipitates with nanometer sized schistose structures on the root surface of Pistia stratiotes L. and Eichhornia crassipes are formed at acidic conditions. But there are no similar crystals observed on the surface of Pistia stratiotes L. and Eichhornia crassipes at alkaline conditions. The present work suggests the different repair mechanisms of uranium-contaminated waste water by the Pistia stratiotes L. and Eichhornia crassipes between acidic and alkaline conditions.
Key words:uranium mine pit water;PistiastratiotesL.;Eichhorniacrassipes; photoremediation
铀矿开采、冶炼以及核能的研究、利用过程是铀在环境中富集并产生污染的重要途径。尤其是在大规模的铀矿开采和冶炼过程中,产生了大面积的低浓度含铀废水[1]。这类废水中铀的质量浓度约为0.5~5 mg/L,远高于国家标准铀矿冶辐射防护和环境保护规定(GB 23727—2009)[2]中设定的铀浓度排放限值(0.05 mg/L)。通过饮水(约占总摄入量的64%)和食物链等途径,水体中的铀一部分最终会进入人体并造成潜在威胁[3]。进入人体后的铀主要蓄积于肝脏、肾脏和骨骼中,以化学毒性和内照射两种形式对人体造成损伤。
Wang等[4]发现,在法国中部一个受铀矿开采影响的湿地中一条小溪的溪水以及旁边的湿地土壤中的铀浓度较高。研究表明,来自废弃矿山的铀污染可能会是一个较以前所认为的更大的问题。铀(Ⅳ)能通过与铁和有机物颗粒相结合而发生潜在释放,说明铀(Ⅳ)可能并不像之前学界所相信的那样容易被固化,其活力被严重低估。这一发现可能会促使人们对废弃矿山导致的地表水和地下水中铀污染的治理策略进行修正。
传统铀污染水体的治理技术如沉淀、蒸发、离子交换等方法多存在费用高、占用空间大、易造成二次污染等缺点[5-6],植物修复技术作为当前新兴的铀污染废水的治理技术,以费用低、效果好、操作简便、可恢复生态环境以及可回收资源等诸多优点而备受关注[7-14]。
有研究[15]显示,向日葵根系积累铀的浓度较水中高5 000~10 000倍,且向日葵生物量较大,被认为是处理铀污染水体的首选植物材料。除向日葵外,浮游植物也能去除污染水体中的铀。Mkandawire等[16-17]研究了利用浮萍(LemnagibbaL.)修复铀尾矿水中铀和砷的能力,结果显示,在21 d实验室稳态测试期间,铀积累量为(896.9±203.8) mg/kg,估计在7 d内就能将1 000 L水中的铀浓度从100 μg/L降低至德国所推荐的周围地表水中限值30.0 μg/L。胡南等[8]的研究结果表明,在2 L铀浓度为1.25 mg/L的铀溶液中投加15 g满江红,将水中铀浓度降至国家排放标准浓度以下需要17 d。Shahandeh等[18]的研究表明,一般来说,草本植物中,双子叶植物较单子叶植物能积累更多的铀。如双子叶植物向日葵(Helianthusannus)和印度芥菜(Brassicajuncea)体内积累的铀最高,单子叶植物小麦(Triticumaestivum)和黑麦草体内积累的铀最低。
本文以我国南方某铀矿废弃铀矿坑水及其中生长的土著水生植物大薸(PistiastratiotesL.)和凤眼莲(Eichhorniacrassipes)为研究对象,通过野外采样、实验室分析和室内水培验证,考察土著水生植物对铀污染水体的原位修复能力。
1材料与方法
1.1野外采样
通过对我国南方某铀矿的一个废弃铀矿坑水的长期考察,发现有几种水生植物在其坑口流出水体中生长旺盛且繁殖迅速。本文选择其中的10个采样点(S1~S10)采集水样以及在其中长势良好的水生植物。其中S1和S6为对照点(距离铀矿废弃矿坑口5 km),其他为污染点。采样前,用5%的硝酸浸泡聚乙烯采样瓶24 h,再用双重去离子水反复冲洗5次,采集水样时先用水样润洗聚乙烯采样瓶及外盖3次。采集的植物样品盛放于聚乙烯采样袋中。采集后立即做好标签,并尽快带回实验室分析。
1.2分析方法
1) 植物物种
本研究主要采集了多点分布的2种优势植物,分属2科。采样点植物的分布情况列于表1。

表1 采样点植物的分布
2) 植物样品分析
植物样品分为根和水上部分(茎、叶和花)。先用自来水充分冲洗样品,以去除粘附在植物样品上的渣滓和污物,然后用去离子水冲洗2~3遍,沥去水分,于105 ℃下杀青5 min,再在75 ℃下烘干至恒重,研碎后通过100目尼龙筛。过筛后的植物样品用干法+湿法进行消化。先称取1.00 g样品于瓷坩埚中,加盖置于700 ℃的马弗炉中灰化4 h,取出冷却后,全部转移至50 mL的聚四氟乙烯烧杯中,于通风橱内用移液器少量多次加入10 mL HCl(36%)、2 mL HNO3(68%)、2 滴H2O2(30%),加表面皿,静置10 min后,置于电热板上,在150 ℃左右蒸至近干,再加入5 mL HCl(36%)、1 mL HNO3(68%),蒸至近干,用热双蒸水反复多次润洗表面皿及烧杯底部和内壁,润洗液过滤至50 mL容量瓶中,冷却后,用蒸馏水定容待测。
3) 铀浓度分析
水(测试前经滤纸过滤)中和植物各部位中铀含量的测定参照EJ 267.4—1984[19]方法进行。
1.3室内水培实验
1) 生长期对大薸修复铀污染水体的影响
待修复的铀污染水体A:c0(U)=1.48 mg/L,pH=7.43,取自某铀矿坑水。将单株生物量均小于120 g生长前期、生长中期、生长后期的大薸分别以S/4、S/2、3S/4、S不同覆盖面积的方式投加至5 L的烧杯中,内盛5 L的水体A。每隔2 d取样分析水体A的残余铀浓度,连续监测10 d。
2) 投加量对大薸和凤眼莲修复铀污染水体的影响
待修复的铀污染水体B:c0(U) =1.93 mg/L,pH=7.83,取自某铀矿坑水。实验分2个系列进行,分别考察大薸和凤眼莲两种植物。每个系列分为5组投加量。将2 L水体B装于2 L的烧杯中,然后分别投加一株鲜重为50、100、200、300、400 g的植物(大薸或凤眼莲),每组设4个平行样。投加后每隔24 h取样分析水体B的残余铀浓度,连续监测10 d。
3) 水体积对植物修复铀污染水体的影响
待修复的铀污染水体C:c0(U) =1.91 mg/L,pH=7.65,取自某铀矿坑水。实验分两个系列进行,分别将500、1 000、2 000 mL水体C装于2 L的烧杯中,然后投加一株鲜重约为300 g的大薸,每隔24 h取5 mL水样分析,每组设4个平行样。连续监测6 d。
4) 大薸和凤眼莲与铀污染水体作用后的扫描电镜与能谱分析
大薸和凤眼莲经与pH值分别为3、5、8(采用0.1 mol/L HNO3、10 g/L Na2CO3和5 g/L NaHCO3的缓冲液调节溶液pH值),初始铀浓度为100 mg/L(为便于在扫描电镜下观察铀的生成物,铀浓度设置较高)的铀溶液作用72 h后,用超纯水反复清洗,选取1~2条根于盖玻片上,自然干燥后,加入2.5%戊二醛,固定5 h后去掉戊二醛溶液,依次用30%、50%、70%、90%、100%的乙醇溶液逐级脱水,每次脱水20 min,最后自然晾干,备用。对照实验采用Hoagland营养液作为培养介质,其余操作同上。利用Emitech SC7620喷金仪对样品进行喷金处理,置于Ultra55型场发射扫描电子显微镜(SEM,德国蔡司公司)下室温扫描,观察样品形貌,并用Oxford IE450型能谱仪(EDS,英国Oxford公司)分析样品微区元素分布。
2结果与分析
2.1野外采样分析结果
所采集的8个水样和土著植物样品以及对照组中铀含量的分析结果列于表2。由表2可见,在S1和S6两个对照点,水体铀浓度均为0.04 mg/L,满足GB 23727—2009规定值0.05 mg/L。而8个污染水样中铀平均浓度为0.50 mg/L,是GB 23727—2009规定排放限值的10倍,同时也表明,在该废弃铀矿坑水中采集的土著水生植物大薸和凤眼莲对铀均有较强的富集能力,且铀主要赋存于根系,这与文献[7-11]的结果一致。Srivastava等[13]的研究表明,水生杂草黑藻在铀浓度为100 mg/L时对铀的最大富集量为78 mg/kg(干重),富集系数为0.78。Soudek等[14]的研究表明,玉米在0.1~1 mmol/L铀溶液中对铀的富集量为160 mg/kg(干重),为研究的20种植物中对铀富集量最高的植物。胡南等[8]报道了满江红在10 mg/L铀溶液中的最高生物富集系数为354。由表2可知,大薸和凤眼莲在0.5 mg/L的铀矿坑水中,根系对铀的平均富集量分别为1 015.40 mg/kg(干重)和504.87 mg/kg(干重),富集系数分别高达2 071和1 001,远高于上述报道。茎和叶对铀的平均富集量分别为39.10 mg/kg(干重)和9.87 mg/kg(干重),表明土著水生植物大薸和凤眼莲对水体中的铀具有很强的富集能力。即使在铀浓度很低的对照点,大薸和凤眼莲对铀仍表现出很强的吸收富集性能。
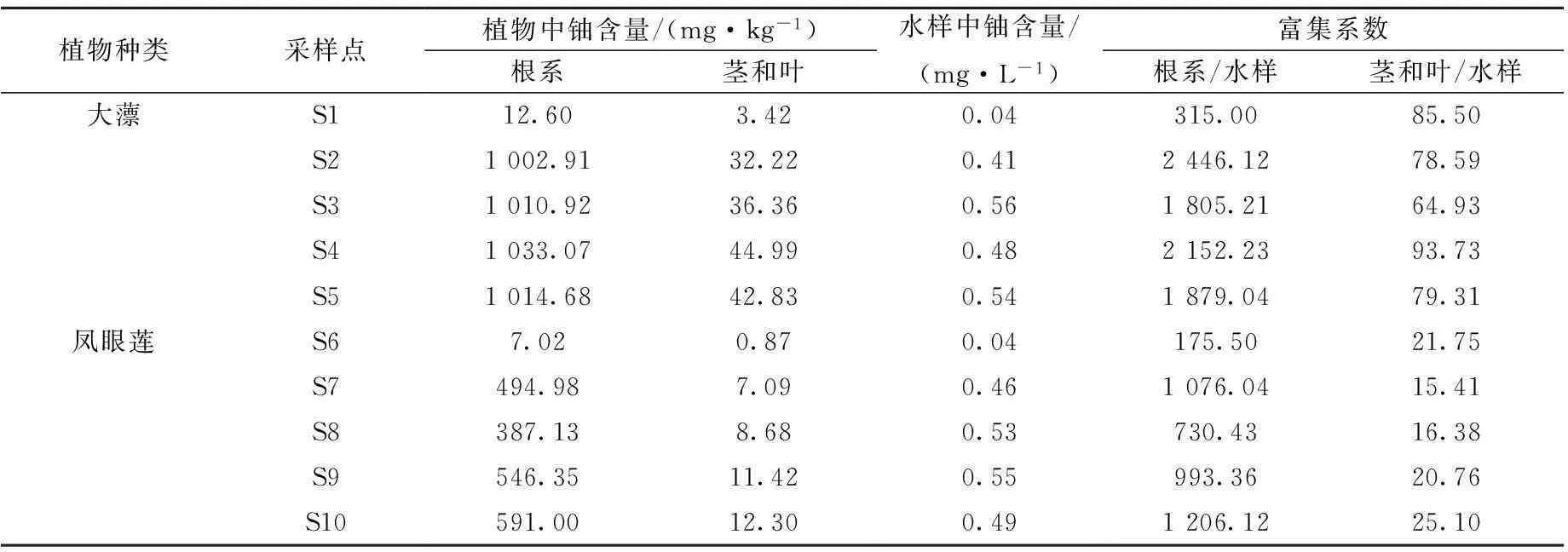
表2 铀矿坑口外排水及植物体内的铀含量
注:植物中的铀含量以干重计
2.2生长期和覆盖面积对大薸修复铀矿坑水的影响
大薸对铀矿坑水中铀的去除率随生长期和覆盖面积的变化分别示于图1、2。由图1可知,处于相同生长期的大薸,覆盖面积越大,对水体中铀的去除率越高。由图2可知,覆盖面积相同的大薸,其生长期越靠后,对水体中铀的去除率越高。随着接触时间的延长,大薸和凤眼莲对铀污染水体A中铀的去除率均逐渐增加,且各实验组的植株长势均很好。生长后期的大薸以100%的覆盖面积投加于水体A,10 d后对铀污染水体A中铀的去除率可达80%以上。
2.3投加量对植物修复铀污染水体的影响
投加量对植物修复铀污染水体的影响示于图3。从图3可看出,投加量对大薸和凤眼莲修复铀污染水体的效果影响很大。在2 L水体B中投加单株鲜重为50 g和100 g的大薸和凤眼莲(分别处于生长前期和生长中期),对水体B的修复效果明显低于投加量为200~400 g的效果。具体表现为,将单株鲜重为100 g的大薸和凤眼莲投加至2 L水体B,10 d后,对水体中铀的去除率分别为38.2%和52.0%。当投加量≥200 g(单株鲜重,生长后期)时,投加量越大,铀的去除率越高。单株鲜重200 g的大薸和凤眼莲投加至2 L水体B中,1 d后,水体B的残余铀浓度≤1.0 mg/L,铀的去除率均大于50%;7 d后,铀去除率在97.9%~100.0%之间,水体B的残余铀浓度均小于0.05 mg/L。10 d后,水体B的残余铀浓度≤0.03 mg/L,低于世界卫生组织规定的饮用水中铀浓度的限值。尤其是当凤眼莲的投加量为300 g和400 g时,分别在7 d和4 d后,水体B的残余铀浓度均≤0.03 mg/L。实验结果还表明:单株大薸(鲜重(FW)400 g)在投加到水体B中10 d后,叶片和根系的平均干重分别为(21.91±1.49) g和(4.34±0.36) g,干重显著高于对照组;平均铀浓度分别为(3.94±0.48)、(763.54±27.13) mg/kg。植物体内的铀浓度达到铀污染水体中铀总量的97%以上。

图1 大薸生长期对铀污染水体A中铀去除效果的影响 Fig.1 Removal effect of uranium by different growing periods of Pistia stratiotes L. exposed to uranium wastewater A
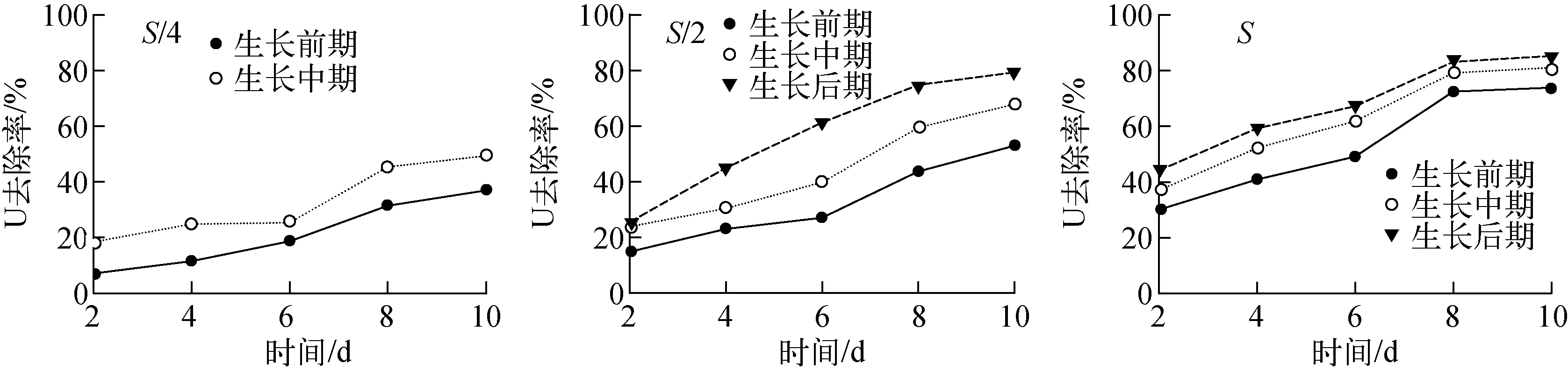
图2 水体A中大薸覆盖面积对铀去除效果的影响 Fig.2 Removal effect of uranium by Pistia stratiotes L. at different cover area exposed to uranium wastewater A
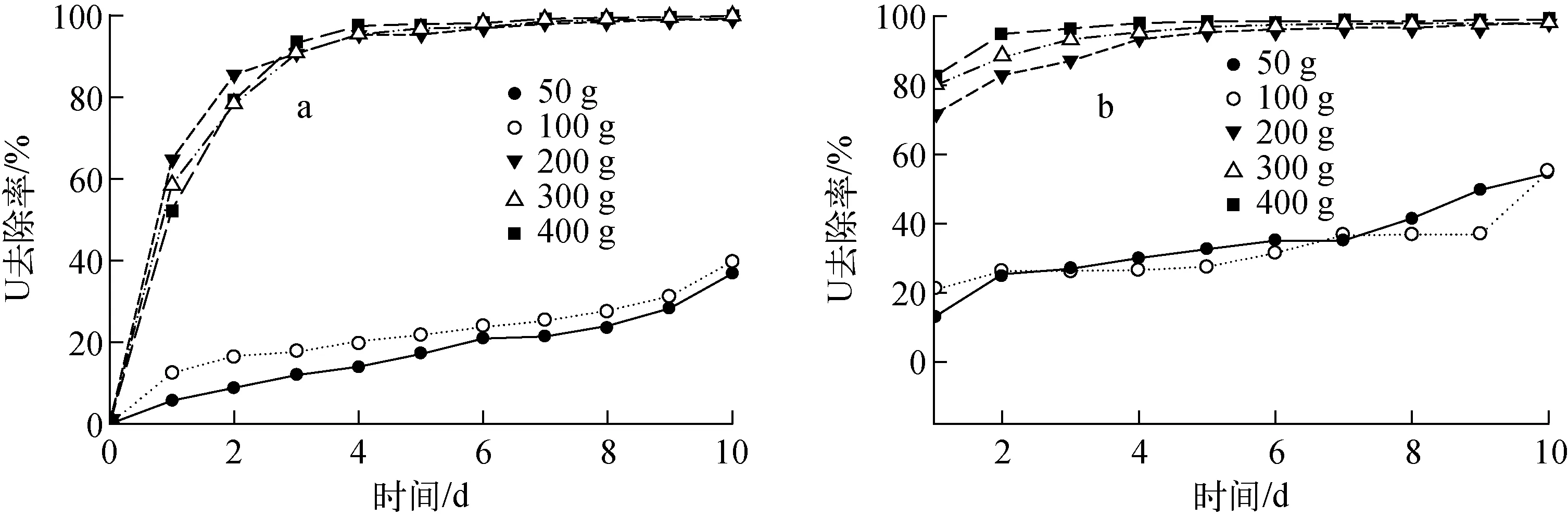
图3 大薸(a)和凤眼莲(b)投加量对修复铀污染水体B的影响 Fig.3 Effect of biomass contents of Pistia stratiotes L. (a) and Eichhornia crassipes (b) on uranium removal rate of uranium wastewater B
2.4水体体积对大薸修复铀矿坑水的影响
不同水体体积对大薸修复铀矿坑水的影响如图4所示。本研究筛选到的优势植物大薸和凤眼莲均属于双子叶植物,对铀均表现出很强的吸收和积累性能。实验结果表明,单株鲜重为300 g的大薸分别在第1、2、3 d可将5 00、1 000、2 000 mL的水体C的铀浓度降至0.03 mg/L以下。与大型陆生植物向日葵、印度芥菜[18]和小生物量的漂浮植物浮萍[16-17]相比,土著大型水生植物大薸和凤眼莲对铀矿坑水的原位修复具有更良好的环境适应性和工程化应用的推广前景。
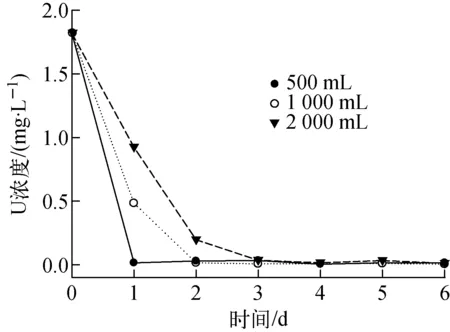
图4 生长后期的大薸 对不同体积水体C的修复效果 Fig.4 Effect of volume of uranium mine pit water on uranium removal rate by Pistia stratiotes L. of uranium wastewater C
2.5凤眼莲和大薸与水体中铀作用前后的SEM和EDS分析
凤眼莲和大薸与水体中铀作用前后的SEM图像及EDS分析结果示于图5。由图5a和e可见,未与铀作用时,大薸和凤眼莲根系表面光滑。图5i和k分别为大薸和凤眼莲根系与100 mg/L铀溶液作用前的EDS谱,表明大薸根系主要由C、O元素组成,凤眼莲根系主要由C、O、Si、Al组成。在与不同酸度、初始铀浓度为100 mg/L的铀溶液作用72 h之后,碱性条件(pH=8,接近铀矿坑水的酸碱度)下,大薸和凤眼莲表面光滑,未观察到特殊形貌的铀沉积物(图5b、f);在酸性条件下,如图5c、d、g、h所示,大薸和凤眼莲根系表面堆满100~500 nm含铀的片状纳米晶体。图5j、l分别为大薸和凤眼莲根系与100 mg/L铀溶液作用72 h后的EDS谱,分析可知,在大薸根系表面堆簇的片状结晶体主要由C、O、U、Si元素组成;而在凤眼莲根系表面生成的片状晶体更为密实和完整,除根系本身的组成元素外,主要由U、P元素组成。并且在与pH=5,c0(U)=100 mg/L的铀溶液作用72 h之后,凤眼莲一直正常存活,表现出极强的铀耐受性。推测酸性条件下,在凤眼莲和大薸根系表面生成的片状堆簇系铀的无机结晶体,主要为U的氧化物或U的磷酸盐。推测在酸性条件下是大薸和凤眼莲代谢性矿化铀,尤其是大薸与铀溶液接触后,大量有机磷从大薸根系组织中释放分解为无机磷,在根系表面与部分U结合并结晶矿化为氢铀云母。细胞壁能广泛富集铀,位于细胞壁内、外的代谢磷脂是U6+最初出现络合反应和随后铀矿物成核、生长的位置[20]。而在弱碱性条件下,凤眼莲和大薸对铀的吸收主要为物理化学吸附,未发生类似的矿化结晶过程。

a、e——凤眼莲和大薸的对照样; b、c、d——凤眼莲与pH=8、pH=5、pH=3,c 0(U)=100 mg/L的铀溶液作用72 h后的SEM图像; f、g、h——大薸与pH=8、pH=5、pH=3,c 0(U)=100 mg/L的铀溶液作用72 h后的SEM图像; i、j、k、l——a、c、e、g的EDS谱 图5 凤眼莲和大薸与水体中铀作用前后的SEM图像和EDS谱 Fig.5 SEM images and EDS results of Pistia stratiotes L. and Eichhornia crassipes before and after biosorption of uranium
3结论
1) 在该废弃铀矿坑生长的土著水生植物大薸和凤眼莲对铀矿坑水中铀具有很强的耐受性能和富集能力,大薸和凤眼莲根系对铀的富集量分别为1 015.40 mg/kg(干重)和504.87 mg/kg(干重)。
2) 处于相同生长期的大薸,覆盖水体面积越大,对铀矿坑水中铀的去除率越高;覆盖水体面积一致的大薸,生长期越靠后,对铀矿坑水中铀的去除率越高。
3) 当大薸和凤眼莲的单株生物量鲜重≥200 g时,可在7 d内将2 L真实铀矿坑水中的铀浓度由1.93 mg/L降至0.03 mg/L 以下,满足饮用水对铀浓度的要求。且植物体内的铀总量达铀污染水体中铀总量的97%以上。土著浮水植物大薸和凤眼莲繁殖速度快,对铀污染水体适应性好,对水体中铀的富集能力强,具备将其应用于铀矿坑水及相似铀污染水体原位修复的潜质。
4) 大薸和凤眼莲在酸性条件下与水体中的铀结晶矿化,生成纳米片状晶体堆簇在根系表面,在碱性条件下,接近废弃铀矿坑水的pH值时,未出现类似矿化结晶体。表明大薸和凤眼莲对于不同酸度的铀废水体系有不同的修复机理。
参考文献:
[1]林莹,高柏,李元峰. 核工业低浓度含铀废水处理技术进展[J]. 山东化工,2009,38(3):35-38.
LIN Ying, GAO Bai, LI Yuanfeng. Development of study on treatment technology for wastewater with low-level uranium content of nuclear industry[J]. Shangdong Chemical Industry, 2009, 38(3): 35-38(in Chinese).
[2]中华人民共和国国家质量监督检验总局. GB 23727—2009铀矿冶辐射防护和环境保护规定[S]. 北京:中华人民共和国国家质量监督检验总局,2009.
[3]魏广芝,徐乐昌. 低浓度含铀废水的处理技术及其研究进展[J]. 铀矿冶,2007,26(2):90-95.
WEI Guangzhi, XU Lechang. Treatment technology of low concentration uranium bearing wastewater and its research progress[J]. Uranium Mining and Metallurgy, 2007, 26(2): 90-95 (in Chinese).
[4]WANG Y H, FRUTSCHI M, SUVORVA E, et al. Mobile uranium(Ⅳ)-bearing colloids in a mining impacted wetland[J]. Nature Communications, 2013, 4: 2 942-2 947.
[5]NEWSOME L, MORRIS K, LIOYD J R. The biogeochemistry and bioremediation of uranium and other priority radionuclides[J]. Chemical Geology, 2014, 363: 164-184.
[6]张学礼,王尔奇. 环境中铀污染的植物修复[J]. 铀矿冶,2008,27(1):44-49.
ZHANG Xueli, WANG Erqi. Review on phytoremediation of uranium-contaminated environment[J]. Uranium Mining and Metallurgy, 2008, 27(1): 44-49 (in Chinese).
[7]FAVAS P J, PRATAS J, VARUN M, et al. Accumulation of uranium by aquatic plants in field conditions: Prospects for phytoremediation[J]. Sci Total Environ, 2014, 470-471: 993-1 002.
[8]胡南,丁德馨,李广悦,等. 五种水生植物对水中铀的去除作用[J]. 环境科学学报,2012,32(7):1 637-1 645.
HU Nan, DING Dexin, LI Guangyue, et al. Uranium removal from water by five aquatic plants[J]. Acta Scientiae Circumstantiae, 32(7): 1 637-1 645(in Chinese).
[9]GAVRILESCU M, PAVEL L V, CRETESCU I. Characterization and remediation of soils contaminated with uranium[J]. J Hazard Mater, 2009, 163(2-3): 475-510.
[10]LEE M, YANG M. Rhizofiltration using sunflower (helianthusannuusL.) and bean (PhaseolusvulgarisL.var.vulgaris) to remediate uranium contaminated groundwater[J]. J Hazard Mater, 2010, 173(1-3): 589-596.
[11]PRATAS J, PAULO C, FAVAS P J C, et al. Potential of aquatic plants for phytofiltration of uranium-contaminated waters in laboratory conditions[J]. Ecological Engineering, 2014, 69: 170-176.
[12]LI J, ZHANG Y. Remediation technology for the uranium contaminated environment: A review[J]. Procedia Environmental Sciences, 2012, 13: 1 609-1 615.
[13]SRIVASTAVA S, BHAINSA K C, D’SOUZA S F. Investigation of uranium accumulation potential and biochemical responses of an aquatic weed hydrilla verticillata (L. f.) royle[J]. Bioresour Technol, 2010, 101(8): 2 573-2 579.
[14]SOUDEK P, PETROVA S, BENESOVA D. Uranium uptake by hydroponically cultivated crop plants[J]. J Environ Radioact, 2011, 102(6): 598-604.
[15]ENTRY J A, VANCE N C, Hamilton M A, et al. Phytoremediation of soil contaminated with low concentrations of radionuclides[J]. Water Air Soil Pollution, 1996, 88: 167-176.
[16]MKANDAWIRE M, TAUBERT B, DUDEL E G. Resource manipulation in uranium and arsenic attenuation byLemnagibbaL. (duckweed) in tailing water of a former uranium mine[J]. Water, Air, and Soil Pollution, 2005, 166: 83-101.
[17]MKANDAWIRE M, TAUBERT B, DUDEL E G. Capacity ofLemnagibbaL. (duckweed) for uranium and arsenic phytoremediation in mine tailing waters[J]. International Journal of Phytoremediation, 2004, 6(4): 347-362.
[18]SHAHANDEH H, HOSSNER L R. Role of soil properties in phytoaccumulation of uranium[J]. Water, Air, and Soil Pollution, 2002, 141: 165-180.
[19]中华人民共和国核工业部. EJ 267.4—1984低品位铀矿石中铀的测定:三正辛氧膦(三烷基氧膦)萃取2-(5-溴-2-砒啶偶氮)-5-乙氨基苯酚分光光度法[S]. 北京:中华人民共和国核工业部,1984.
[20]JEONG B C, HAWES C, BONTHRONE K M, et al. Localization of enzymically enhanced heavy metal accumulation byCitrobactersp. and metal accumulation in vitro by pink tetracocci[J]. Appl Environ Microbiol, 1997, 33: 1 129-1 133.

