一株高效木质素降解菌株LG-1的筛选、鉴定及酶活测定
■王 全 王 会李红亚李术娜
(1.河北农业大学生命科学学院,河北保定071001;2.衡水市农机管理总站,河北衡水053000)
木质素是结构复杂的一种天然有机高分子化合物。它广泛存在于高等植物细胞壁中,是含量仅次于纤维素的生物多聚体。由于分子大(相对分子质量>1.0×105),溶解性差,没有任何规则的重复单元或易被水解的键,所以木质素分子结构复杂而不规则;由于含有各种生物学稳定的复杂键型,因而微生物及其分泌的胞外酶不易与之结合,是目前公认的微生物难降解的芳香族化合物之一。尽管许多微生物能分解单独存在的纤维素,但由于在细胞壁中纤维素受到木质素的保护,而木质素有完整坚硬的外壳,不易被微生物降解,因此,纤维素的分解受到限制。
目前,影响牲畜对植物纤维素高效利用的关键问题之一是木质素的阻碍作用。秸秆主要成分为木质素,难以被禽畜直接消化利用,利用微生物将木质素降解为单糖、氨基酸等小分子物质,可大大增加秸秆的消化率。国外科学家对一些降解木质素能力强并具有较强选择性的菌种进行了较为深入的研究,有的菌种或其产生的高效木质素降解酶已经被应用到某些工农业生产中。
我国在此方面的研究起步较晚,具有较强降解木质素能力并有较好工农业应用前景的菌种也较匮乏,传统的秸秆饲料发酵剂中降解木质素的菌株为白腐菌、褐腐菌、软腐菌、黄孢原毛平革菌、变色栓菌等[1-4],多为真菌类,普遍存在大规模生产工艺复杂,菌剂稳定性低,活性不易保存等一系列缺点。虽然细菌对木质素的降解作用远小于真菌。但是并不能说细菌在木质素生物降解研究中地位就不重要。细菌的繁殖速度远高于真菌,在初级代谢阶段即可降解木质素,使木质纤维物质发生改性,以利于后续菌株的有效降解[5-12]。
本研究中采用水解圈结合定量测定酶活的方法,从自然界特殊环境中筛选高效降解木质素的产芽孢细菌,并对其种属进行鉴定,利用定性测定方法对这几株菌种的木质素降解酶产生能力和活力进行了比较,筛选出1株较优菌种,最后摸索其产芽孢条件。
1 试验材料与方法
1.1 材料
1.1.1 玉米秸秆
所用秸秆品种为农大3138(CAU 3138),秸秆切割成1 mm和1~2 cm的小段便于后期分析。1 mm的玉米秸秆发酵后用苯-乙醇提取后分析。
1.1.2 菌株来源
河北农业大学养殖场新鲜牛粪便。
1.1.3 化学试剂
木质素标准品购自Sigma化学试剂公司;其他试剂均为国产分析纯级试剂;0.4%放线菌酮溶液。
1.1.4 培养基
基本培养基(BM)、苯胺蓝培养基、牛肉膏蛋白胨培养基(NA)、NB培养基、复筛液体发酵培养基、产芽孢基础培养基、菌种鉴定培养基、甲基红(M.R)试验培养基、V-P试验培养基、淀粉水解培养基、硝酸盐还原试验培养基、亚硝酸盐还原试验培养基、产氨试验培养基、脲酶培养基、吲哚试验培养基、苯丙氨基酸脱氨酶培养基、明胶液化试验培养基、脂酶(Tween-80)试验培养基见《微生物学试验》[13]。生理生化鉴定培养基及试剂见《常见细菌系统鉴定手册》[14]。
1.2 试验方法
1.2.1 降解木质素芽孢杆菌的富集培养和初筛
芽孢菌富集:取所采粪便样品1.0 g内含物置于含放线菌酮母液的BM培养液中,37℃培养20 h后,取1.0 ml发酵液装于9.0 ml无菌水的试管中,经90℃加热处理15 min。混匀取1.0 ml进行梯度稀释,得到一系列不同浓度的稀释液。分别取10-4、10-5、10-6浓度梯度的稀释液0.1 ml涂布到BM培养基平板上,置于37℃恒温箱培养24 h。挑取单菌落转接到BM培养基斜面上,编号,置于37℃恒温培养24 h。
初筛(苯胺蓝平板脱色法):在BM培养基中加入0.01 g/100 ml的苯胺蓝(Azure B)和 1.8 g/100 ml的琼脂,灭菌后铺平板,培养基上以画十字法接种待测菌,37℃避光培养5 d,每天观察记录,以蓝色培养基中菌落的脱色圈的有无及产生快慢和脱色圈的大小来定性检测木质素过氧化物酶(LiP)和(或)锰过氧化物酶(MnP)的产生情况。试验均设计3次重复,初筛所得菌株斜面置于4℃下保存。
1.2.2 菌株复筛
采用管碟法将初筛所得菌株在液体发酵培养基中进行发酵,考察发酵代谢产物的降解活性。一方面按初筛方法考察发酵上清液的产酶能力;一方面定量测定发酵上清液酶活。
将初筛得到的菌株扩培,转接到NB培养基上,置于37℃恒温培养24 h以活化菌株。将活化后的菌株接种至复筛液体发酵培养液中,37℃静置培养48 h后,以10 000 r/min、4℃离心5 min,取上清液点样于苯胺蓝平板的微孔,每孔点样100 μl。37℃避光培养5 d后观察并记录脱色圈的有无及大小。
1.2.3 菌株酶活力测定
木质素降解菌的酶活力考察一般通过木质素过氧化酶和锰过氧化酶活性来测定。
木质素过氧化物酶活力测定(以Lip在H2O2存在下氧化Azure B染料来表示Lip活力的方法):125 mmol/l的酒石酸钠缓冲液(pH值3.0)1.0 ml,0.160 mmol/l的Azure B溶液500 μl,培养液上清500 μl,30 ℃下加入2 mmol/l的H2O2溶液 500 μl启动反应,测反应最初3 min内651 nm处OD值减少速率,1个酶活力单位以每分钟每毫升的培养基滤出液降低0.1个OD值表示。
锰过氧化物酶(MnP)活力测定:50 mmol/l的乳酸钠缓冲液(pH值4.5)3.4 ml,1.6 mmol/l的MnSO4溶液0.1 ml,0.4 ml的培养液上清,预热至37℃加入1.6 mmol/l的H2O2溶液0.1 ml启动反应,测定反应最初3 min内λ=240 nm处吸光度变化,1个酶活力单位为每分钟吸光值增加0.1的酶量。
木质纤维素含量的测定:采用72%硫酸法测定木质素含量;硝酸-乙醇法测定纤维素含量;蒽酮比色法测定半纤维素含量。
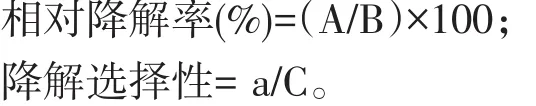
式中:A——纤维素(半纤维素或木质素)的降解总量;
B——原样品中纤维素(半纤维素或木质素)的总量;
a——纤维素(半维素或木质素)的降解率;
C——总纤维素的降解率。
1.2.4 菌种对秸秆木质素降解能力的测定
每300 ml三角瓶中准确称取玉米秸秆粉20 g(20~40目),加入一定量的葡萄糖和硫酸铵,60 ml蒸馏水,即得固态培养基,121℃灭菌30 min。接种所筛菌株到秸秆固体培养基中,接种量为1.0×106个/ml,34℃静止培养,每隔5 d从固态发酵基质中取样,过滤澄清,定容后进行酶活力测定,将剩余固态基质105℃烘干至恒重,测定木质纤维素含量。
大规模堆积培养模拟试验:称取粗粉碎后的秸秆粉200 g,用蒸汽灭菌15 min后,放入3 000 ml大三角瓶中,冷却至常温后,接入50 ml NB种子液。搅拌均匀后放入培养箱中,以堆积状态(厚度30 cm)进行培养。堆积放置过程中,为防止秸秆因发酵生热、温度升高,应注意控制温度27~32℃。
1.2.5 产芽孢木质素降解菌株的种属鉴定
根据菌株的菌落形态特征、菌体形态特征、革兰氏染色性状、芽孢染色性状,有关生理生化鉴别试验,参照《常见细菌系统鉴定手册》、《伯杰氏细菌鉴定手册》[15]进行属和种的鉴定。
1.2.5.1 菌种形态鉴定
菌株体形态观察:将复筛得到的菌株进行10倍梯度稀释,取10-4、10-5梯度的稀释液涂NA平板,37℃培养24 h得单菌落,观察记录菌落形状和大小、边缘、表面、隆起形状,透明度、菌落及培养基的颜色等。另挑取斜面上37℃培养24 h的各个菌株,参照东秀珠等[14]的《常见细菌系统鉴定手册》上的方法进行革兰氏染色,显微镜下观察其菌体形态。并进行芽孢染色、鞭毛染色及异染粒观察等。
1.2.5.2 生理生化鉴定
参照东秀珠等[14]的《常见细菌系统鉴定手册》对菌株进行生理生化试验。主要进行H2S产生试验、吲哚试验、明胶液化试验、过氧化氢酶(接触酶)试验、氨基酸脱羧酶试验、淀粉水解、V-P(乙酰甲基甲醇)试验、M.R(甲基红,Methyl Red)试验、柠檬酸盐利用、石蕊牛奶分解、糖、醇发酵、苯丙氨酸脱氨酶、产氨试验、脲酶(尿素水解)试验、亚硝酸盐还原试验、硝酸盐还原试验和荧光色素试验[16]。
1.2.5.3 DNA提取和16S rDNA基因扩增
参考Kim等和Rainey等的方法提取细菌总DNA[17-18]。1%琼脂糖电泳检测。
引物为通用引物[10],正向引物为 27F:5’-AGA GTTTGATCCTGGCTCAG-3’;反向引物为1495R:5’-CTACGGCTACCTTGTTACGA-3’。
PCR反应体系:DNA(70 ng/μl)模板2 μl;dNTP Mixture(2.5 mmol/l)2.5 μl;27F(20 μmol/l)1.5 μl;1495R(20 μmol/l)1.5 μl;10×ExTaq Buffer(Mg2+pluse)5 μl;ExTaq DNA聚合酶 0.2 μl;补足ddH2O到50 μl。
PCR条件为:94℃预变性3 min;然后94℃变性1 min、55 ℃退火1 min、72 ℃延伸3 min,共30个循环;最后72℃延伸5 min。PCR产物经试剂盒纯化后,送上海生工生物工程技术服务有限公司测序。
1.2.5.4 16S rDNA序列分析及系统发育树绘制
将所测得的16S rDNA序列用BLAST软件与Gen-Bank数据库进行相似性分析,并与GenBank中的相近序列在Clustal X(1.8)程序包中进行多重序列匹配排列(Multiple alignments)分析,最后形成一个多重序列匹配排列阵,其中形成的缺口用横杠“-”填补,用Neighbor-Joining法构建系统发育树[19]。
2 结果与分析
2.1 降解木质素菌的初筛(见表1及图1)

表1 初筛结果
本试验共筛选到具有脱色圈的菌株14株,分别命名为LG-1、LG-2、LG-3、LG-4、LG-5、LG-6、LG-7、LG-8、LG-9、LG-10、LG-11、LG-12、LG-13、LG-14。
由表1可知,筛选出的木质素降解菌LG-1脱色圈最大(见图1),降解木质素的效果最好。
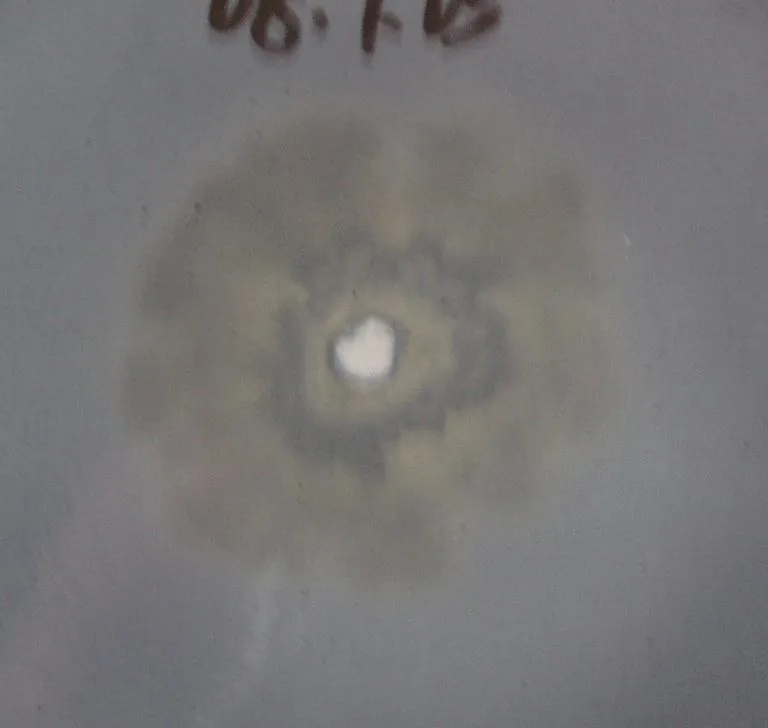
图1 木质素降解菌LG-1脱色圈
2.2 复筛结果
对初筛菌株中脱色圈圈直径较大的5个菌株LG-1、LG-7、LG-6、LG-11和LG-9进行液体发酵,测定脱色圈大小,结果见表2。

表2 复筛结果
由表2可知,菌株LG-1脱色圈直径最大,与初筛的结果一致,肯定了LG-1的降解活性,后续试验将LG-1确定为目的菌株。
2.3 菌株LG-1菌种鉴定结果
2.3.1 LG-1菌株形态及生理生化特征
菌落特征:根据NA培养基上生长的菌株LG-1的菌落形态,初步判断其为细菌菌落,培养24 h的菌落为不透明的浅黄色,呈近圆形,边缘不整齐,表面无皱摺,中间有突起(见图2)。

图2 菌株LG-1的菌落形态
菌体形态特征:供试菌株LG-1经染色后置于光学显微镜下观察,菌体呈杆状,革兰氏染色呈阳性,菌体长约2.9 μm,宽约0.8 μm,芽孢呈椭圆形中生,长约1.8 μm,宽约0.8 μm(见图3)。
生理生化试验结果见表3。
将菌株LG-1形态及生理生化特征与《常见细菌系统鉴定手册》中相应属、种进行对照,其与芽孢杆菌属的典型特征基本一致,初步鉴定菌株LG-1属于芽孢杆菌属(Bacillus)。
2.3.2 16S rDNA序列分析
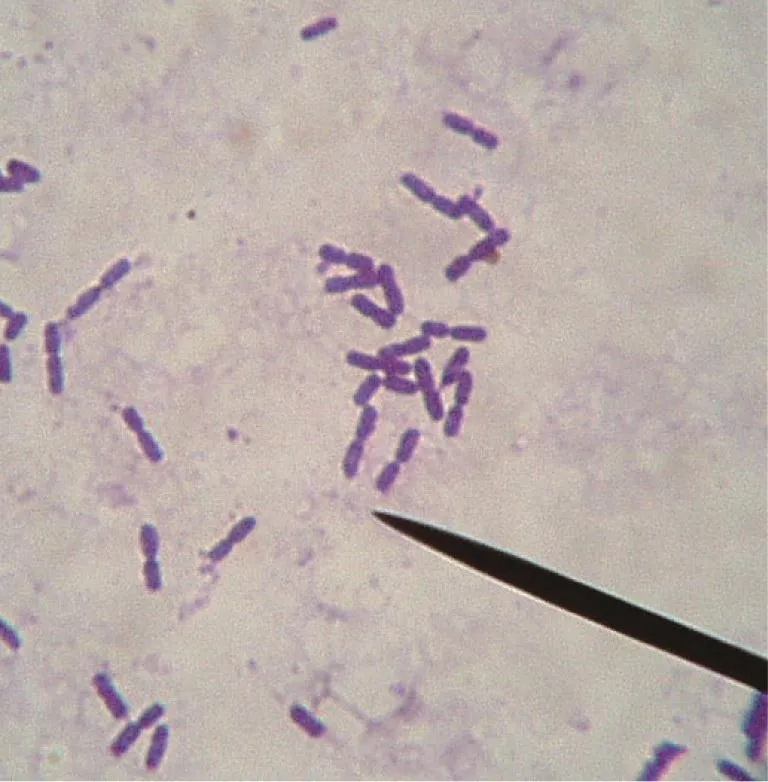
图3 菌株LG-1的菌体形态

表3 菌株LG-1的生理生化特征
将菌株LG-1的16S rDNA序列与GenBank中所有已测定的原核生物16S rDNA序列进行比较,得到该菌株及相关菌株的进化距离并构建了系统发育树,结果见表4和图4。
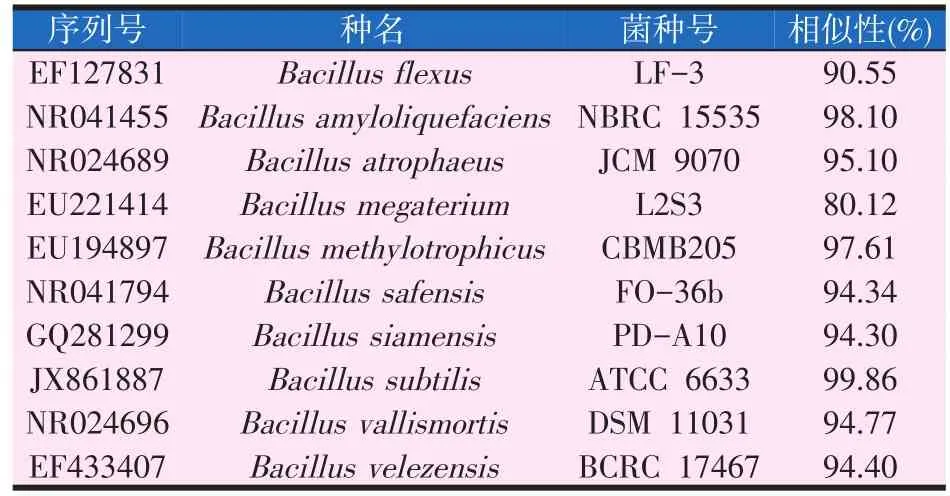
表4 菌株LG-1与参比菌株的16S rDNA序列相似性
由表4和图4可知,与菌株LG-1的16S rDNA序列同源相似性最高的9株标准菌株均属于芽孢杆菌属,其中有8株与菌株LG-1的16S rDNA序列相应的同源相似度高于90%,仅巨大芽孢杆菌与菌株LG-1序列的同源相似度较低,达到80%以上,因此可初步判断菌株LG-1属于芽孢杆菌属。同时,由于供试菌株LG-1与枯草芽孢杆菌(Bacillus subtilis)的标准菌株ATCC 6633的16S rDNA序列的同源相似性最高,达99.86%;另外,其形态特征及生理生化特性也与枯草芽孢杆菌(Bacillus subtilis)相应的典型特征基本一致,因此,综合以上试验结果,鉴定菌株LG-1为一株枯草芽孢杆菌(Bacillus subtilis)。
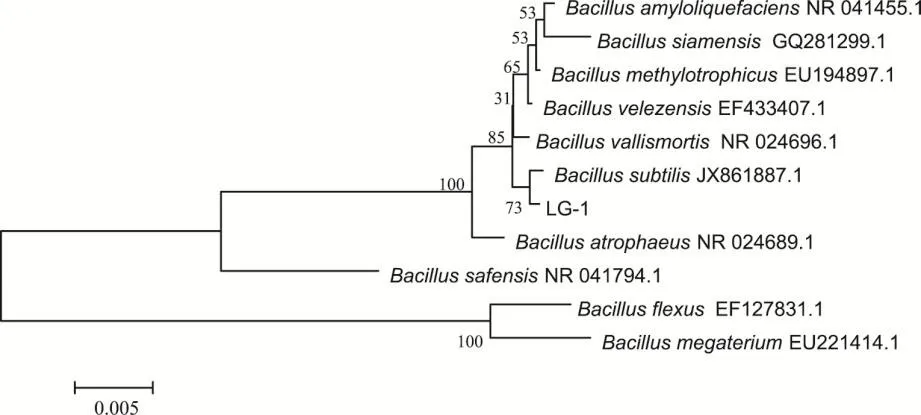
图4 菌株LG-1及相关菌株的系统发育树
2.4 酶活测定
2.4.1 木质素过氧化酶活力测定
枯草芽孢杆菌LG-1菌株在发酵36 h后测定其木质素过氧化酶的酶活力结果,并与其它菌株的酶活力进行比较(见表5)。
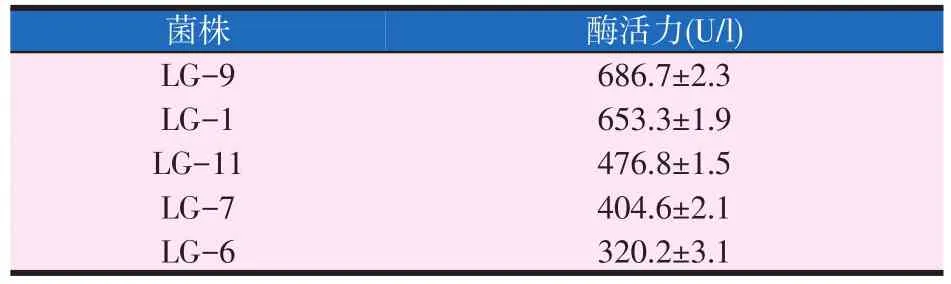
表5 发酵36 h后木质素过氧化酶酶活力
由表5可以看出,发酵36 h时,菌株LG-1酶活力虽然不是最高的,但已经和最高的LG-9很接近。同时也可以看出,菌株LG-1的酶活力远远高于其它菌株。
枯草芽孢杆菌LG-1菌株在发酵60 h后测定其木质素过氧化酶的酶活力结果,并与其它菌株的酶活力进行比较(见表6)。

表6 发酵60 h后木质素过氧化酶酶活力
由表6可以看出,发酵60 h时,菌株LG-1酶活力是最高的,是LG-7的2.15倍,LG-6菌株的3.35倍,LG-11菌株的3.72倍。
2.4.2 锰过氧化物酶(MnP)活力测定
枯草芽孢杆菌LG-1菌株在发酵60 h后测定其锰过氧化酶的酶活力结果,并与其它菌株的酶活力进行比较(见表7)。

表7 发酵60 h后锰过氧化酶酶活力
由表7可知,LG-1菌株在发酵60 h后的MnP酶活力达到610.8 U/l。
2.5 木质素降解能力测定
将枯草芽孢杆菌LG-1接种到玉米秸秆粉中,在不同的时间测定其对秸秆的降解率,结果如图5所示。
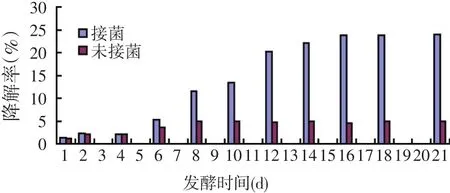
图5 菌株降解率与发酵时间示意图
由图5可以看出,枯草芽孢杆菌LG-1对玉米秸秆中的木质素有显著的降解能力。随着发酵时间的延长,木质素的降解率逐渐增加,在21 d后降解率达到最高水平23.9%,但未接种组的木质素降解率只有4.9%。从木质素降解率的变化趋势来看,在发酵16 d时就已经达到23.6%,在后面5 d中变化不大。原因是由于孢子液直接接种到玉米秸秆粉中,从孢子萌发到产生代谢酶需要一定时间,所以在发酵的初始阶段酶的活性较低,木质素降解率较低。随着菌株的生长,酶的产生量达到最高水平,木质素的降解率同时也达到最高水平。在发酵16 d时,酶的产生量达到最高水平,从16~21 d,酶的产生量变化不大,因此木质素的降解率变化也不大。
3 讨论
产芽孢细菌在不良环境下可形成休眠体芽孢,可以耐受恶劣环境。在工业化生产中可制成芽孢菌粉,有生物量高、存活时间长的特点,在降解木质素的应用效果中,能持续发挥降解作用。本研究分离筛选到能高效降解木质素的枯草芽孢杆菌LG-1,为木质素降解提供可供工业化生产及大规模应用的优良菌种。
堆积发酵试验表明,在未进行发酵条件优化的情况下,LG-1菌株对秸秆木质素表现出强降解作用。LG-1菌株发酵玉米秸秆16 d后,木质素降解率可达23.6%。相较于燕红等[20]报道的地衣芽孢杆菌对麦麸木质素的降解率17.3%、蜡样芽孢杆菌对稻草木质素降解率2.81%,丁志刚等[21]报道的地衣芽孢杆菌对麦秸和稻草木质素2.2%和3.9%的降解率而言,LG-1菌株降解木质素的能力更有效。LG-1菌株对木质素的强降解作用依赖于LiP及MnP的产生,对于有无其他关键酶系尚需进一步研究确定。
木质素是人类可再生的纤维资源之一,使木质素转变为有用的物质,变废为宝,这将对我国的造纸工业、环境保护以及可持续发展等均具有深远的意义。木质素的生物降解在许多应用领域有着广阔的前景,但由于一些基础研究如木质素的空间结构、每种木质素酶的作用机理以及木质素酶基因结构及其表达调控等尚未完全研究清楚,所以,离实际应用还有一段距离。正因如此,木质素的生物降解也一直是世界性研究热点和难题。相信在不久的将来,随着蛋白质分离、纯化、空间构象测定技术的发展,随着对木质素酶催化机理认识的加深,以及应用分子生物学技术对木质素降解酶相关基因结构、表达调控机理等深入研究,这些问题将会逐一解决。
4 结论
木质素降解菌枯草芽孢杆菌LG-1菌株可以产生MnP及LiP等木质素降解酶,并可高效降解玉米秸秆木质素,为工业化生产提供优良菌种。

