武汉地区马铃薯Y病毒株系的类型
武汉地区马铃薯Y病毒株系的类型
陈汝豪1, 2, 3, 4,王靖惠1, 2, 3, 4,姚妮娜1, 2, 3, 4,柳俊1, 2, 3, 4,NIE Xianzhou5,聂碧华1, 2, 3, 4*
(1.园艺植物生物学教育部重点实验室;2.国家蔬菜改良中心华中分中心;3.湖北省马铃薯工程技术研究中心;4.华中农业大学园艺林学学院,湖北武汉430070;5.加拿大农业与农业食品部马铃薯研究中心,加拿大新不伦瑞克,弗雷德里克顿E3B4Z7 )
马铃薯是仅次于水稻、小麦和玉米的世界第四大粮食作物,在全世界耕地面积减少和谷物类增产幅度下降的形势下,作为最大的块茎作物,马铃薯成为未来发展中国家粮食安全的重要保障[1,2]。马铃薯是无性繁殖作物,病毒病尤其严重,也是导致马铃薯种薯退化的主要原因[3]。据报道,有近40种病毒和2种类病毒能侵染马铃薯,其中9种病毒和1种类病毒被认为分布广泛且危害严重,其中马铃薯Y病毒(PVY)造成的产量损失可达80%[4,5]。
PVY有丰富的株系多样性,包括普通株系(PVYO),烟草叶脉坏死株系(PVYN),重组株系(PVYN : O和PVYNTN)等[6,7]。近些年,PVYNTN在世界许多国家和地区相继出现,由于它能导致块茎发生环状坏死而受到广泛关注[6,8]。而PVYO的一种致病性更强的变异型PVYO-FL也超过原有的PVYO成为加拿大东部地区主要PVYO类型[9]。表明PVY的株系组成不仅复杂,而且在发生变化。
常规的ELISA病毒检测通常不能区分PVY的各个株系,因此国内鲜有PVY株系分析的报道。本研究对武汉地区马铃薯田间收集的PVY样品进行了基因型分析,初步了解了PVY的株系类型的组成,对PVY的防治和新品种选育都有重要的意义。
1 材料与方法
1.1样品收集和总RNA的提取
2012年春季,在武汉市华中农业大学马铃薯田间依据PVY引起的植株花叶、失绿和坏死等常见症状,采集了124份叶片样品,并用Na2SO3法提取总RNA[10],具体步骤如下:用叶汁提取仪榨取6滴叶片汁液加入300 μL抽提缓冲液(含0.1M Tris-HCl, 2.5 mM MgCl2, 0.65%的Na2SO3,20 μL/mL 的DNase I),在37℃水浴中孵育10 min。加入200 μL水饱和酚充分摇匀,在4℃、12 000 r/min离心15 min(下同)。取上清液加入400 μl苯酚/氯仿/异戊醇(25ϑ24ϑ1),充分摇匀后离心。收集上清液加入50 μL 3 M醋酸钠和500 μl异丙醇,震荡摇匀,-70℃放置40 min,离心倾去上清液。用70%的乙醇洗涤沉淀,干燥后用无菌水溶解RNA沉淀,于-20℃存储。
1.2PVY病毒的RT-PCR检测
反转录反应(RT)用2.5 μL RNA(400 ng)在68℃孵育8 min,在冰上冷却3 min使RNA变性。加入7.5 μL RT反应混合液,使最终各组分浓度达到要求(20 ng/μL 6-9 bp随机引物, 50 mM Tris-HCl, pH 8.3, 75 mM KCl, 10 mM DTT, 2.5 mM MgCl2, 1.5 mM4 种dNTPs,20 URNasin以及200 UMMLV-RT),然后在42℃孵育60 min,最后95℃3 min终止反应。
PVY以及COX1基因(BA000042)检测的PCR反应用2 μL的样品cDNA模板在25 μL体系中进行(含1×PCR buffer,3 mM MgCl2, 0.625 U Taq,4 mM每种dNTPs,1 μM各引物)。PCR反应:94.0℃变性1.5 min,接着94.0℃变性45 s;57℃退火45 s;72℃延伸1 min;36个循环,最后72℃延伸10 min。8 μL PCR产物在1.5%琼脂糖凝胶上电泳检测并拍照。PVY及COX1基因检测引物分别产生480 bp和500 bp的特征条带[11]。所用引物见表1。

表1 马铃薯PVY病毒检测和分型的PCR引物Table 1 Primers for PCR detection and differentiation for potato virus Y
1.3PVY株系类型分析
PVY阳性样品的株系类型分析分为三步:1)P1基因分析[12],用一个三重PCR区分PVYO与PVYN/N:O/NTN类型,其中856 bp为共有带型,443 bp为PVYN/N:O/NTN类型的特征带,281 bp为PVYO特征带;2)重组位点检测[6],以区分PVYN、PVYN:O和PVYNTN三种株系,其中PVYN株系没有重组位点,PVYN:O株系含有641 bp的重组位点1(RJ1),而PVYNTN株系含有所有三个重组位点(RJ1、RJ2和RJ3);3)三重RT-PCR分析鉴定PVYO的强毒(PVYO-FL)和弱毒(PVYO-RB)变异型[9],其中464 bp为强毒PVYO-FL类型的特征带,399 bp为弱毒PVYO-RB类型的特征带,238 bp为两种PVYO类型的共有条带。上述RT-PCR反应引物见表1。
2 结果与分析
2.1PVY病毒的RT-PCR检测
对样品PVY以及内参基因COX1的检测结果如图1所示。124个样品中93个样品中检出PVY 480 bp的特征带,占总数的75.0%(图1A),内参基因500 bp的特征条带均十分明显(图1B)。由此可见,根据植株叶片症状来采集PVY病毒样品的方法是高效、可行的。
2.2PVY病毒株系类型分析
对上述93个PVY阳性样品进行进一步基因型的分析以调查PVY的株系组成。首先进行P1基因分析。如图2A所示,所有PVY阳性样品均扩增出856 bp的共有条带,而其中56个样品仅扩增出443 bp特征带,其P1基因为PVYN/NTN/N:O类型,占60.2%;19个样品只扩增出281 bp的特征带,其P1基因为PVYO类型,占20.4%;还有18个样品具有443 bp和281 bp两条特征带,推断为上述两种类型PVY的混合侵染,占19.4%。
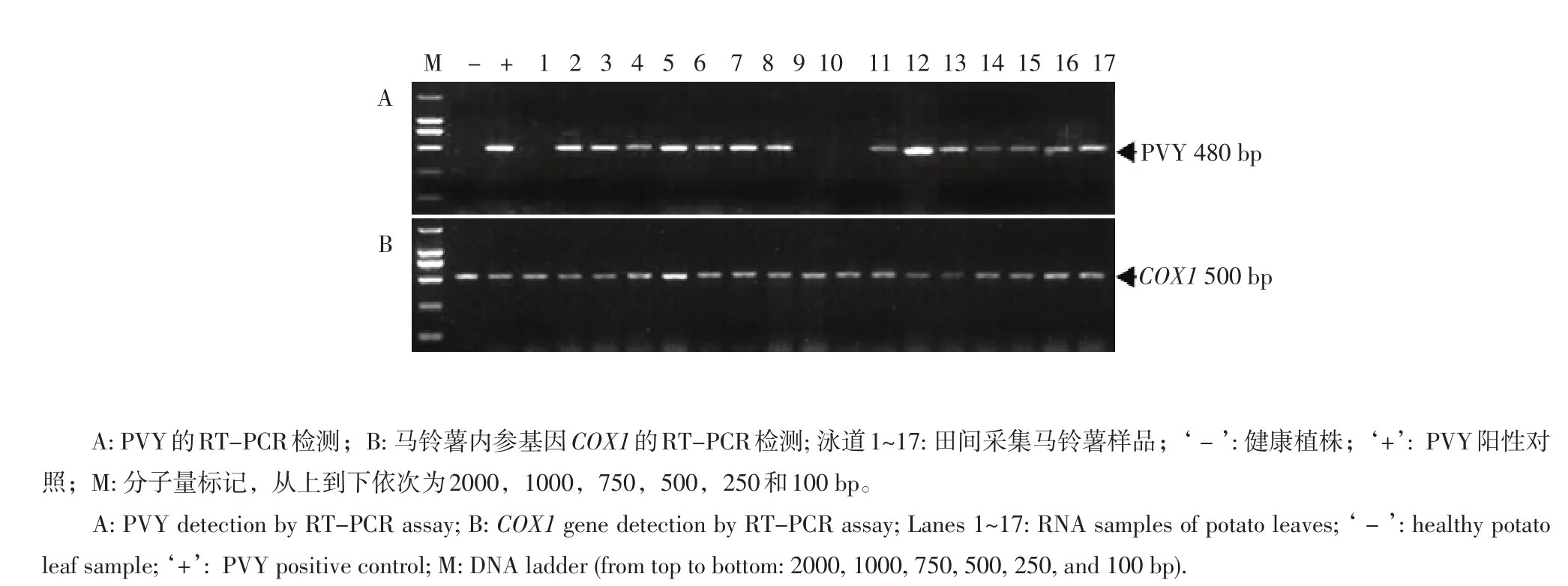
图1 RT-PCR检测马铃薯田间样品的PVY和内参基因COX1Figure 1 RT-PCR assay for detection of PVY and COX1 gene in RNA samples of field collected potato leaves
继续对74个PVYN/N:O/NTN类型PVY样品进行重组位点分析,部分样品电泳结果如图2B所示。3个样品没有扩增出任何特征带,推断它们是没有重组位点的PVYN,占总数的4.0%;有9个样品扩增出一条641 bp的特征条带,推断它们是具有一个重组位点的PVYN:O,占12.2%。其余62样品扩增出了RJ1(641 bp)和RJ2(448 bp)两个重组位点,比阳性材料PVYNTN少了一个RJ3(290 bp)重组位点,推断它们可能是PVYNTN,占83.8%。
对另外37个PVYO类型样品进行了CP基因分析以区分它们可能的致病力强弱,部分样品电泳结果如图2C所示。所有样品都含有238 bp的PVYO共有的条带,其中有26个样品具有464 bp特征带,属于强毒的PVYO-FL变异型,占PVYO总数的70.3%。其余样品与阳性对照PVYO-RB一样,只有一条238 bp的共有条带,虽然缺少299 bp的特征带,推断为弱毒的PVYO-RB变异型,占PVYO总数的29.7%。
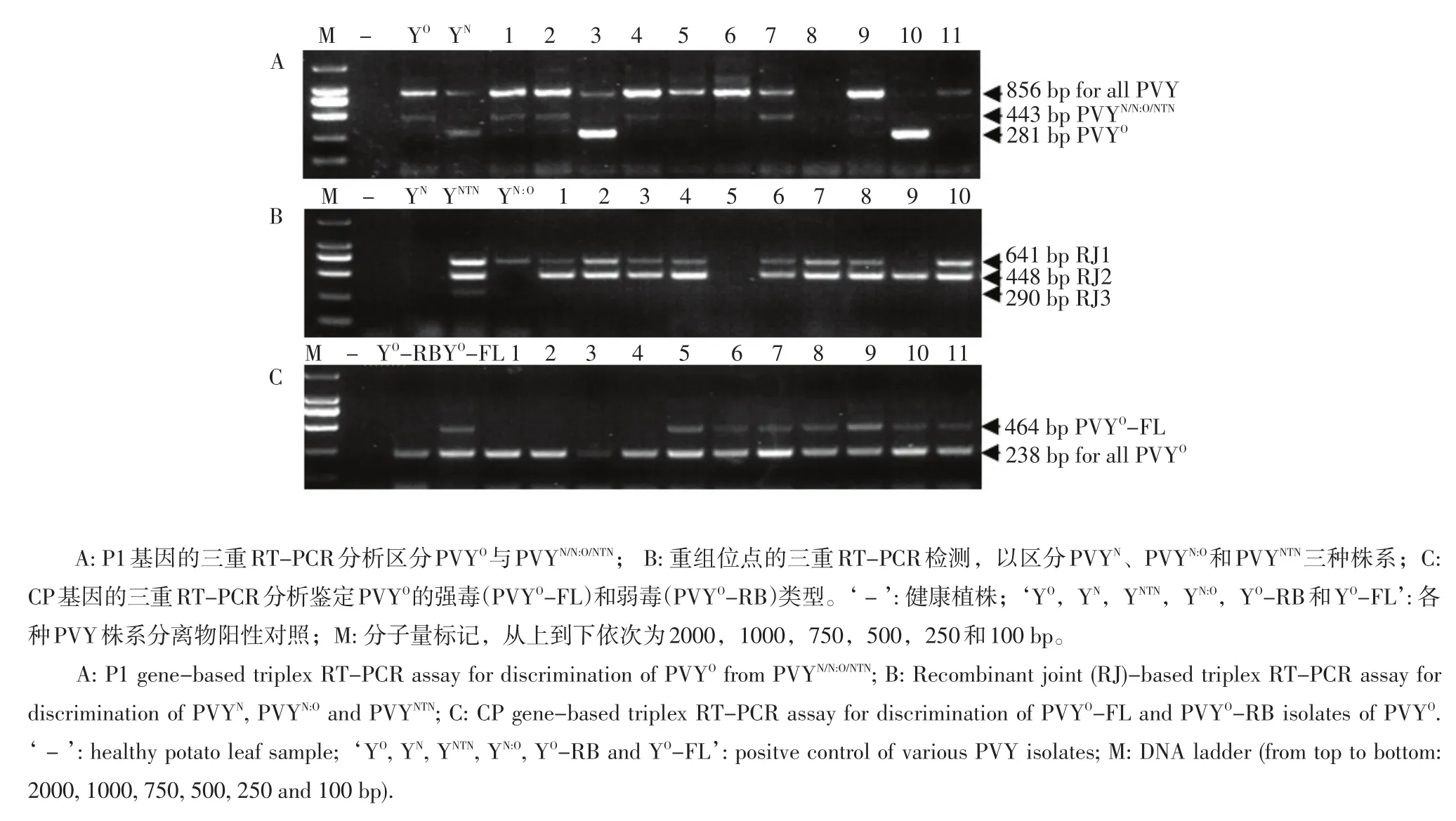
图2 PVY阳性样品的基因型分析Figure 2 RT-PCR based genotyping assay of PVY positive samples
3 讨论
本研究用RT-PCR的方法对依据症状采集的马铃薯叶片样品进行了PVY检测。结果显示,根据PVY在马铃薯上引起的花叶、失绿和坏死等常见症状来进行取样,获得PVY阳性样品的比率可达75.0%。而那些PVY检测为阴性又表现出疑似症状的样品,可能由其它病毒或其它原因导致。
通过对这些PVY阳性样品的P1基因、重组位点以及CP基因的RT-PCR分析,进一步明确了这些PVY样品的株系类型。包含混合侵染,本研究在93份PVY阳性样品中共检测出111份阳性的各株系分离物,5种PVY株系或分离物PVYNTN、PVYO-FL、PVYO-RB、PVYN:O和PVYN出现的频度和所占比例分别为62(55.9%)、26(23.4%)、11 (9.9%)、9(8.1%)和3(2.7%)。表明样品中含有所有检测的5种PVY株系或分离物,其中以PVYNTN和PVYO-FL为主要流行的PVY,它们占总数的79.3%。
PVYNTN在本次检测中发生频率如此高并非偶然,在北美、中国等地相继报道PVYNTN正有流行的趋势[13,14],而且本次对其重组位点的分析显示,所有检查的PVYNTN都只发现两个重组位点而不是典型的三个重组位点,从中国湖南分离的PVYNTN也只检测出上述两个重组位点,进一步分析显示该PVYNTN的第三个重组位点的位置发生了变化,导致检测失败[8]。最近对PVYO株系进一步依据致病力的强弱分为PVYO-FL、PVYO-RB两个亚型,在加拿大等地的检测分析显示,致病力更强的PVYO-FL正慢慢占据主要地位[9,13],本研究初步分析的结果也显示,近七成PVYO为PVYO-FL类型。
PVY有复杂的株系类型,是侵染马铃薯的主要病毒之一。本研究提供的PVY株系组成信息对本地区的PVY防治和品种选育工作具有一定的指导意义。
[参考文献]
[1] Visser R G F, Bachem C W B, Boer J, et al. Sequencing the potato genome: Outline and first results to come from the elucidation of the sequence of the world's third most important food crop [J]. Am J Pot Res, 2009, 86: 417-429.
[2] Xu X, Pan S, Cheng S, et al. Genome sequence and analysis of the tuber crop potato [J]. Nature, 2011, 475 (7355): 189-195.
[3] Jansky S, Jin L, Xie K, et al. Potato production and breeding in China [J]. Potato Research, 2009, 52: 57-65.
[4] Whitworth J L, Nolte P, McIntosh C, et al. Effect of potato virus Y on yield of three potato cultivars grown under different nitrogen levels [J]. Plant Dis, 2006, 90: 73-76.
[5] Kerlan C. Potato viruses [M]//Brian W J M, Marc H V R. Desk encyclopedia of plant and fungal virology, 2008: 458-471.
[6] Nie X, Singh R P. Specific differentiation of recombinant PVYN:Oand PVYNTNisolates by multiplex RT-PCR [J]. J Virol Methods, 2003, 113: 69-77.
[7] Piche L M, Singh R P, Nie X, et al. Diversity among potato virus Y isolates obtained from potatoes grown in the United States [J]. Phytopathology, 2004, 94: 1368-1375.
[8] Hu X, He C, Xiao Y, et al. Molecular characterization and detection of recombinant isolates of potato virus Y from China [J]. Arch Virol, 2009, 154: 1303-1312.
[9] Nie B, Singh M, Sullivan A, et al. Recognition and molecular discrimination of severe and mild PVYOvariants of potato virus Y in potato in New Brunswick, Canada [J]. Plant Dis, 2011, 95: 113-119.
[10] Singh R P, Nie X, Singh M, et al. Sodium sulphite inhibition of potato and cherry polyphenolics in nucleic acid extraction for virus detection by RT-PCR [J]. J Virol Methods, 2002, 99: 123-131.
[11] Nie X. Salicylic acid suppresses potato virus Y isolate N:O induced symptoms in tobacco plants [J]. Phytopathology, 2006, 96: 255-263.
[12] Nie X, Singh R P. A new approach for the simultaneous differentiation of biological and geographical strains of potato virus Y by uniplex and multiplex RT-PCR [J]. J Virol Methods, 2002, 104: 40-54.
[13] Nanayakkara U N, Singh M, Pelletier Y, et al. Investigation of potato virus Y (PVY) strain status and variant population in potatoes in New Brunswick, Canada [J]. Am J Pot Res, 2012, 89: 232-239.
[14]胡新喜,雷艳,何长征,等.湖南省马铃薯主产区马铃薯病毒种类及流行分析[J].中国马铃薯, 2012, 26(6): 358-361.
摘要:马铃薯Y病毒(PVY)是严重危害我国马铃薯生产的主要病毒之一。本研究通过RT-PCR的方法,对依据症状采集的124份马铃薯叶片样品进行了病毒检测,并对其中PVY阳性样品进行了株系类型分析。结果显示,在93份PVY阳性样品中,PVYN/NTN/NϑO类型株系占60.2%,而PVYO普通株系占20.4%,还有18个样品(19.4%)显示受到两种类型PVY的混合侵染。进一步分析表明,在PVYN/NTN/NϑO类型株系中,PVYNTN、PVYNϑO和PVYN三种株系分别占83.8%、12.2%和4.0%;而PVYO普通株系中,PVYO-FL和PVYO-RB两种变异型各占70.3%和29.7%。本研究结果显示,PVYNTN和PVYO-FL是检测样品中主要的PVY株系,该结果为指导马铃薯PVY的防治提供一定的依据。
关键词:马铃薯;马铃薯Y病毒;多样性;RT-PCR
Potato Virus Y (PVY) Strain Status in Potato Samples Collected from Wuhan Area
CHEN Ruhao1,2,3,4, WANG Jinghui1,2,3,4, YAO Nina1,2,3,4, LIU Jun1,2,3,4, NIE Xianzhou5,NIE Bihua1,2,3,4* ( 1. Key Laboratory of Horticultural Plant Biology, Ministry of Education; 2. National Center for Vegetable Improvement (Central China); 3. Potato Engineering and Technology Research Center of Hubei Province; 4. College of Horticulture and Forestry Sciences,
Huazhong Agricultural University, Wuhan, Hubei 430070, China;5. Potato Research Center, Agriculture and Agri-Food Canada, 850 Lincoln Road, P. O. Box 20280, Fredericton NBE3B4Z7, Canada )
Abstract:Potato virusY(PVY) is one of the main viruses which restricts potato production in China.In this study, 124 leaf samples were collected in potato field according to the foliar symptoms. RNAswere extracted andRT-PCRmethods were used for the strain analysis of thosePVYpositive samples.The results showed that 60.2%PVYN/NTN/N:Oand20.4%PVYOweredetected in 93 PVYpositive samples, while 18 samples (19.4%) were infected by both. Furthermore, 83.8% PVYNTN, 12.2% PVYN:Oand 4.0%PVYNweredetectedamong PVYN/NTN/N :Ogroupsamples,respectively.Meanwhile,PVYOgroup samples were consisted of 70.3% PVYO-FL and 29.7% PVYO-RB, respectively. The investigation revealed that PVYNTNand PVYO-FL were the epidemic PVYstrains/isolates insamplescollected in this study,whichmight provide importantanduseful information for PVYcontrol.
Key Words:potato; potato virus Y; diversity; reverse transcription-polymerase chain reaction(RT-PCR)
*通信作者(Corresponding author):聂碧华,副教授,博士,主要从事马铃薯病毒互作研究,E-mail: nbihua@mail.hzau.edu.cn。
作者简介:陈汝豪(1990-),男,硕士研究生,从事马铃薯病毒互作研究。
基金项目:现代农业产业技术体系建设专项资金资助(CARS-10-P08);国家自然科学基金项目(31101191);中央高校基本科研业务费专项资金资助项目(2011QC080)。
收稿日期:2014-11-06
文章编号:1672-3635(2015)01-0037-05
文献标识码:A
中图分类号:S532

