鸡胚小肠上皮细胞的体外分离培养和鉴定
詹 康 左晓昕 贡笑笑 陈银银 占今舜 赵国琦(扬州大学动物科学与技术学院,扬州225009)
鸡胚小肠上皮细胞的体外分离培养和鉴定
詹 康 左晓昕 贡笑笑 陈银银 占今舜 赵国琦∗
(扬州大学动物科学与技术学院,扬州225009)
摘 要:本试验旨在提供鸡小肠上皮细胞的体外分离方法,为进一步研究鸡肠道疾病的致病机理、鸡肠道营养物质转运吸收与免疫机理提供模型。本试验采用组织块培养法来分离培养鸡小肠上皮细胞。运用刮除法、酶消化法、有限稀释法纯化鸡小肠上皮细胞。利用噻唑蓝(MTT)法来鉴定鸡小肠上皮细胞生长情况。通过实时荧光定量PCR(RT⁃PCR)检测鸡小肠上皮细胞特异性基因的表达来鉴定鸡小肠上皮细胞。结果表明:1)采用组织块细胞培养法能够成功获得鸡小肠上皮细胞系。2)接种组织块8 h内鸡小肠上皮细胞开始大量增殖。3)鸡小肠上皮细胞的生长曲线为“S”形,符合细胞增殖规律。4)传至第5代的鸡小肠上皮细胞体积开始变大,细胞形态模糊并开始衰老凋亡;细胞传代时进行接种,大量的细胞未贴壁。综上所述,采用在6孔板内接种鸡小肠组织快,能够获得具有稳定性的鸡小肠上皮细胞,为鸡肠道疾病致病机理、鸡肠道营养物质转运吸收和永生化鸡小肠上皮细胞提供细胞素材。
关键词:鸡小肠上皮细胞;营养免疫;稳定性;永生化
肠道是抵御外来病原菌入侵体内的主要屏障和营养物质吸收的主要场所。鸡小肠上皮细胞参与物质的消化吸收和免疫调控,并实时监测外来入侵的病原微生物[1]。鸡小肠上皮细胞是小肠组织内最重要的细胞,在消化吸收蛋白质、氨基酸以及转运吸收小肽方面产生重要的作用。国外研究小肠上皮细胞生物学功能以及肠道免疫机理的较多[2-4]。目前,国外通过转染猴空泡病毒40 (SV40)也建立了一些小肠上皮细胞系[5-8],但不是转化细胞并具有稳定性功能,与正常的小肠上皮细胞系的消化吸收、免疫和分化都具有相似的功能。然而,鸡小肠上皮细胞系的成功建立未见报道。同时,鸡小肠上皮细胞未商品化,很难获得细胞素材。因此,建立鸡小肠上皮细胞系迫在眉睫。本研究旨在通过6孔板接种鸡胚小肠组织块,8 h内可获得增殖旺盛的鸡小肠上皮细胞,为导入SV40T致癌基因建立永生化鸡小肠上皮细胞系奠定基础。
1 材料与方法
1.1 试验材料
对无特定病原(SPF)鸡蛋破壳,无菌取鸡胚小肠组织放入含有2倍青霉素和链霉素的完全培养基中。DMEM/F12完全培养基:10%澳洲胎牛血清、杜氏磷酸盐缓冲液(DPBS)、0.25%胰酶、5 mL胰岛素-转铁蛋白-硒(ITS)均为Gibco产品;100 U/mL青霉素、100 μg/mL链霉素、4 mL L-谷氨酰胺溶液、2.8 μmol/L氢化可的松、二甲基亚砜(DMSO)、噻唑蓝(MTT)均为Sigma产品,15 ng/mL表皮生长因子(EGF)为Peprotech产品;Trizol为Invitrogen公司产品;反转录试剂盒为TaKaRa产品;荧光定量PCR试剂盒为Roche产品。
1.2 鸡小肠上皮细胞原代培养
在超净台内无菌取出鸡胚小肠,将小肠组织放入含有2倍青霉素和链霉素50 mL离心管中,用含有2倍青霉素和链霉素DPBS清洗小肠数次,剔除脂肪组织和肠系膜,将组织移至灭菌的培养皿中,用DPBS再进行清洗小肠,直至上清液清亮。用无血清的培养基反复清洗鸡胚小肠组织,直至培养基上清液清亮无漂浮物,并转移至50 mL小烧杯中,并用剪刀将小肠组织剪成碎片,静置5 min自行沉淀,弃去上清液。继续剪碎,加无血清培养基悬浮组织块,再转移至15 mL的离心管中清洗,1 000 r/min离心4 min,倒掉上清。反复清洗鸡小肠组织,直至上清液澄清。加入含10%血清DMEM/F12完全培养基悬浮组织块,用扩口移液管将小肠组织块转入6孔板中,放入二氧化碳(CO2)培养箱中培养。培养大约8 h之后,组织周围出现小肠上皮细胞和成纤维细胞。
1.3 鸡小肠上皮细胞的纯化和克隆
将6孔板放在倒置显微镜下观察,用记号笔圈出上皮细胞集落处,然后用一次性细胞刮刀将其他区域的细胞全部刮掉,并用DPBS清洗去除杂细胞。用胰酶分离消化细胞,在倒置显微镜下观察细胞皱缩发亮的程度,一旦细胞开始漂浮,立即终止消化,用DPBS清洗除去杂细胞。完全培养基终止消化,吹打并悬浮细胞,计数,使细胞密度为500个/mL,取100 μL细胞悬液加入96孔板中,培养1周。
1.4 鸡小肠上皮细胞的生长曲线的测定
取第2代鸡小肠上皮细胞,按照4×103个/孔的密度接种到96孔板,24 h之后取8孔,每孔加入20 μL的MTT溶液放入培养箱继续培养4 h。吸出MTT溶液再用磷酸盐缓冲液(PBS)清洗细胞2~3遍并吸弃,每孔加入150 μL的DMSO,慢摇10 min。吸出8孔的液体并转入96孔板中,490 nm测吸光度(OD)值,连续测7 d。
1.5 鸡小肠上皮细胞特异性基因的表达
将鸡小肠上皮细胞接种于6孔板内,待细胞密度至80%,进行总RNA的提取。吸掉培养基,按照每孔加1 mL Trizol裂解液并吹打细胞。操作程序按照Invitrogen说明书进行总RNA的提取。通过1%的琼脂糖凝胶电泳鉴定提取总RNA的完整性。按照罗氏反转录说明书进行cDNA的合成。以cDNA为模板进行目的基因的扩增,利用2%的琼脂糖凝胶电泳对目的基因的检测。实时定量PCR(RT⁃PCR)引物序列和参数见表1。
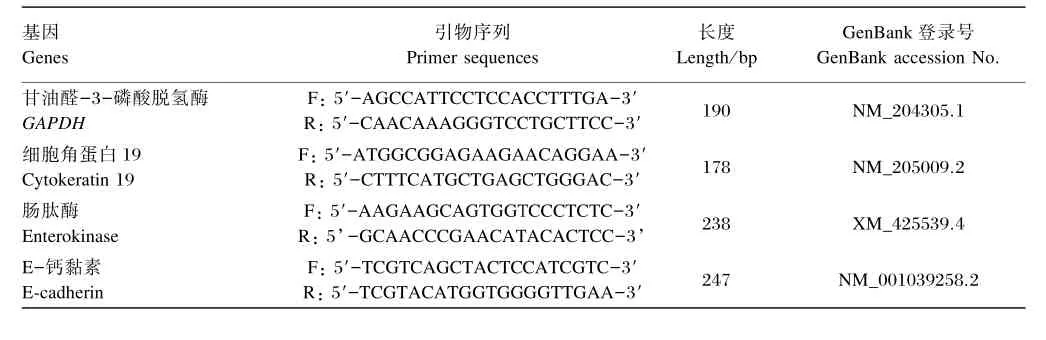
表1 实时定量PCR引物序列和参数Table 1 Sequences and parameters of primers for RT⁃PCR
1.6 鸡小肠上皮细胞冻存与复苏
细胞冻存:待鸡小肠上皮细胞密度生长至80%时,通过酶消化分离细胞,待细胞发亮时用完全培养基终止消化,这时用移液枪吹打细胞,此吹打过程一定要温和操作,避免细胞机械性死亡,1 000 r/min离心5 min。用冻存液悬浮细胞并转移细胞悬液到冻存管中,接下来放入细胞存程序降温盒,直接放-80℃冰箱。
细胞复苏:从-80℃冰箱取出鸡小肠上皮细胞并在37、50、65℃的水浴中快速解冻,待冻存管还剩指甲大小的冰块时停止解冻,酒精喷洒冻存管周围并放入生物安全柜慢慢解冻。将冻存液转入10 mL培养基中,此过程慢慢加入,避免渗透压对细胞的损伤。100 g离心5 min,用预热的培养基悬浮细胞,计数同时计算细胞的活力。
2 结 果
2.1 鸡小肠上皮细胞的原代培养
由图1可知,8 h内鸡小肠组织块即可贴壁,组织块周围首先分裂出小肠上皮细胞和少量的成纤维细胞。由图2可知,第3天成纤维细胞迅速增殖并处于对数生长期,和小肠上皮细胞夹杂着生长。由图3可知,第6天鸡小肠上皮细胞增殖明显,但也伴随着一些细胞的衰老,细胞形态变得模糊。然而,鸡小肠上皮细胞传至第5代,细胞质变大,细胞开始凋亡,并从培养瓶底部脱落。

图1 组织块接种植8 h后贴壁,并分裂出小肠上皮细胞和少量成纤维细胞(物镜,4×)Fig.1 The tissue starts the adherence to the plate 8 h after culture,and divides the intestinal epithelial cells and a few of fibroblast cells (objective,4×)

图2 第3天成纤维细胞迅速增殖并和上皮细胞夹杂生长(物镜,4×)Fig.2 The fibroblast cells grow rapidly in day 3,and they grow together with epithelial cells (objective,4×)

图3 第6天鸡小肠上皮细胞增殖明显同时也有一些细胞开始衰老(物镜,4×)Fig.3 At day 6 of culture,the chicken intestinal epithelial cells grow rapidly,and some cells start senescence(objective,4×)
2.2 鸡小肠上皮细胞的纯化和克隆
从图4可知,利用有限稀释法克隆鸡小肠上皮细胞,成功获得克隆的鸡小肠上皮细胞株。鸡小肠上皮细胞呈现出不同形态,细胞与细胞之间紧密相连,细胞形态呈单层“铺石路”和蝌蚪形生长。
2.3 鸡小肠上皮细胞生长曲线的测定
由图5可知,第1天内鸡小肠上皮细胞生长缓慢;第2~4天生长较快,进入对数生长期;第4~6天鸡小肠上皮细胞生长缓慢达到平台期。从图5看出细胞生长曲线为“S”形,符合细胞生长的一般规律。
2.4 鸡小肠上皮细胞特异性基因的表达与鉴定
本试验选择小肠上皮细胞特异性表达的细胞角蛋白19、E-钙黏素、肠肽酶等蛋白质。细胞角蛋白是上皮细胞的骨架蛋白质,也是上皮细胞的特异抗原。因此,常用来鉴定上皮源细胞。E-钙黏素是上皮细胞重要的分化标志,它也是构成上皮细胞间连接的关键蛋白质。肠肽酶是十二指肠上皮细胞分泌的一种蛋白质水解酶,能够水解蛋白质形成小肽。肠肽酶的正常表达被认为是小肠上皮细胞标志性蛋白质,对动物小肠营养的吸收起重要作用。由图6可知,细胞角蛋白19、E-钙黏素、肠肽酶等蛋白质在鸡小肠上皮细胞中能够很好地表达。

图4 利用96孔有限稀释法获得单克隆鸡小肠上皮细胞系(物镜,4×)Fig.4 Apply 96⁃well plates limiting dilution method to achieve monoclonal chicken intestinal epithelial cells line(objective,4×)

图5 鸡小肠上皮细胞生长曲线Fig.5 Growth curve of the chicken intestinal epithelial cells
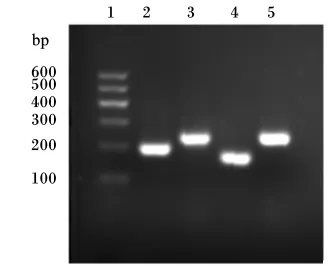
图6 鸡小肠上皮细胞特异性基因表达分析Fig.6 Gene expression analysis of thechicken intestinal epithelial cells
2.5 细胞冻存与复苏
本研究选择37、50、60℃的水浴中快速解冻鸡小肠上皮细胞。通过台盼蓝染色发现,在60℃的水浴中快速解冻鸡小肠上皮细胞能够提高鸡小肠上皮细胞的成活率。慢慢融化,水分进入细胞内从而改变细胞的渗透压,导致细胞损伤。然而,60℃的水浴能够快速解冻细胞,最大限度降低鸡小肠上皮细胞死亡率。
3 讨 论
3.1 组织块法培养原代鸡小肠上皮细胞
培养原代细胞方法有多种,如酶消化和组织块培养都能获得所需要的细胞[9]。酶消化法获得的细胞纯度比较高,但是细胞活力较弱。组织块细胞培养所获得的细胞活力较强,增殖旺盛,但是大量含有成纤维细胞,纯化步骤比较繁琐。本试验采用组织块细胞培养法,由于此方法未经任何酶的处理,虽然有成纤维细胞污染,但是通过几步纯化也能够获得活性很高且增殖旺盛的细胞,这为建立永生化细胞系奠定基础。Kimmich[10]利用透明质酸酶消化鸡小肠组织块,分离出的小肠上皮细胞可以用于营养物质的转运以及营养物质代谢试验。本试验采取组织块细胞培养法,并成功获得鸡小肠上皮细胞株。利用组织培养细胞首先要避免组织不被微生物污染,尤其是细菌的污染。组织剪碎之后在吸取组织块时,要预先湿润组织块,这是防止组织块粘在管内壁。鸡小肠组织块接种到6孔板8 h之后,组织块周围就辐射出鸡小肠上皮细胞和少量的成纤维细胞。李艳等[11]在培养奶牛乳腺上皮细胞7 d之后,组织块周围才辐射出乳腺上皮细胞。这是由于鸡小肠组织块采集于鸡胚,而乳腺组织采集于成年的奶牛,在时间上鸡小肠还属于胚胎时期,因此细胞分裂旺盛。组织块接种到6孔板之后,培养基的用量是鸡小肠上皮细胞能否成功培养的关键。接种的组织湿润并贴在瓶底部即可,组织上表面也不能干涸。24 h之后可以适当增加完全培养基,绝不能使鸡小肠组织块飘起。从培养箱拿出6孔板时候,在观察细胞时移动6孔板动作要缓和,防止组织块从底部脱落。本试验还研究结果表明,利用组织块培养鸡小肠上皮细胞能够获得大量的有活力的上皮细胞,为下游试验提供了较好的素材。
3.2 鸡小肠上皮细胞分离纯化与克隆
利用组织块细胞培养最大的缺点是成纤维细胞太多,上皮细胞与成纤维细胞夹杂生长,很难纯化。本实验室采用刮除法、相差消化、相差贴壁和有限稀释法来纯化克隆鸡小肠上皮细胞。首先用细胞刮刀将大部分成纤维细胞刮掉,用PBS清洗以去除杂细胞。这时,生长在上皮细胞周围的成纤维细胞不能用刮除法来去除杂细胞。此时,采用0.05%胰酶来消化贴壁细胞,置于倒置显微镜下观察细胞皱缩发亮程度,并拍打培养瓶,一旦有细胞开始脱落就立即用完全培养基终止消化。这是由于成纤维细胞和上皮细胞对胰蛋白酶的敏感性不同,0.05%胰酶就可以轻松把成纤维细胞消化下来,而鸡小肠上皮细胞只有一小部分脱落,仍继续贴壁。接下来,用0.05%胰酶消化细胞,并使细胞完全脱落加完全培养基终止消化。洪智敏等[12]在分离鸡胚小肠上皮细胞时采用酶消化获得鸡小肠上皮细胞,但是也存在成纤维细胞的污染,而且细胞活力比较低。然而,单克隆的鸡小肠上皮细胞才是我们最终获得的理想细胞系。许多国外的克隆细胞采用克隆环方法[13],但是本试验未获得成功,可能是由于技术上不够娴熟,有待进一步研究。本试验利用有限稀释法克隆鸡小肠上皮细胞,其中有6孔的细胞密度为50%,接下来消化孔内的细胞,转入到24孔板中进行扩大培养。
3.3 鸡小肠上皮细胞的生长曲线的测定
鸡小肠上皮细胞的生长特性对于小肠上皮细胞的营养吸收至关重要。由于本试验所培养的细胞并不是永生化的鸡小肠上皮细胞,因此细胞增殖的速率要比永生化细胞增殖慢。一般来说,细胞每隔3 d传代1次对于细胞的生长是合适的。但是,原代细胞增殖速率较慢,而且还伴随着一些鸡小肠上皮细胞的衰老。因此,本试验接种的细胞数目为1×104个/cm2,3 d之后鸡小肠上皮细胞密度为80%。由图5可知,当细胞培养24 h,鸡小肠上皮细胞并没有出现明显的增殖,反而细胞数变少。这可能是鸡小肠上皮细胞并非是永生化细胞,在接种时已经有一部分细胞死亡的原因。当鸡小肠上皮细胞培养至2~4 d时,细胞增殖明显,呈现对数生长期。培养至5~6 d时,鸡小肠上皮细胞并不能增殖,细胞处于平台期。我们的研究发现,传至第5代之后细胞生长速度明显减慢,无法增殖,细胞开始出现衰老,细胞间隙变大,细胞体积变大并伴随着细胞从瓶底脱落。有研究认为,原代培养的细胞PD20之后,细胞经过M0期,一部分细胞开始死亡。之后,细胞开始进入M1期和M2期,这时候细胞开始大量凋亡。然而一些致癌基因可以使原代细胞逃离M1期和M2期,这些致癌基因表达的致癌蛋白会使细胞的肿瘤抑制因子失活或控制细胞生长的信号通路失活从而使细胞永生化[14-15]。
Shamanin等[16]利用HPV16 E6致癌基因使肿瘤抑制因子p14ARF⁃p53通路失活并激活细胞内端粒酶活性,使染色体更加稳定不被降解,细胞成功逃离M2期,细胞产生了无限增殖的永生化细胞。本试验研究结果表明,培养的鸡小肠上皮细胞具有一定的增殖能力,符合上皮源细胞的生长特性。然而,培养至第5代鸡小肠上皮细胞完全无法增殖,因此,想要获得连续增殖的鸡小肠上皮细胞系,就必须导入SV40T致癌基因,使鸡小肠上皮细胞永生化。
3.4 鸡小肠上皮细胞特异性基因的表达与鉴定
鉴定小肠上皮细胞的方法,目前主要是细胞角蛋白18抗原、碱性磷酸酶染色、显微镜观察法。国内外鉴定上皮细胞主要通过对上皮细胞的细胞角蛋白18抗原检测[17-18]。但是,国外也通过对上皮细胞特异性表达的蛋白质进行检测[19]。细胞角蛋白、E-钙黏素、肠肽酶则是小肠上皮细胞特异性蛋白质,尤其是细胞角蛋白。细胞角蛋白在维持上皮细胞的结构和稳定起到至关重要作用。E-钙黏素也广泛分布于细胞膜,它对细胞间和细胞与外界的联系具有中间作用。E-钙黏素与细胞一旦结合发生相互作用,从而改变细胞骨架重排,产生细胞间的分子信号转导,并将这一信号传递给细胞质,引起胞内蛋白质的磷酸化。肠肽酶广泛分布于十二指肠上皮细胞,主要分泌一种蛋白质水解酶,对蛋白质的水解和胰蛋白酶的形成起到至关重要的作用,并且肠肽酶的正常表达被认为是小肠上皮细胞标志性蛋白质[20]。同时,我们也可以通过显微镜来鉴别上皮细胞。但是,组织块培养鸡小肠上皮细胞的最大缺点是杂细胞较多。组织块培养过程中,成纤维细胞占有绝对优势,可以进行大量的增殖。当成纤维细胞生长密度至100%时候,这时候成纤维细胞开始相互挤压,原来梭形的成纤维细胞会改变自身的形态,形态似乎与上皮细胞呈现铺路石。因此,细胞刚开始生长的时候,通过显微镜能够很好地鉴定上皮细胞。一旦成纤维细胞密度很大时,就无法辨别上皮细胞。本试验通过RT⁃PCR对鸡小肠上皮细胞特异性角蛋白19、E-钙黏素、肠肽酶表达分析,结果表明,角蛋白19、E-钙黏素、肠肽酶能够在鸡小肠上皮细胞中很好地表达,进一步证实了培养的细胞为鸡小肠上皮细胞。
4 结 论
本试验利用组织块细胞培养法成功培养了鸡小肠上皮细胞且细胞活力较强,并能够进行继续传代。原代鸡小肠上皮细胞成功培养可为细胞的永生化、鸡肠道营养吸收与免疫调控机制研究提供理想的试验模型。
参考文献:
[1] OSWALD I P.Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J].Veteri⁃nary Research,2006,37(3):359-368.
[2] 寇涛,吕佳琪,李伟,等.母猪饲粮中添加精氨酸对仔猪肠道免疫细胞数量的影响[J].动物营养学报,2014,26(8):2077-2084.
[3] CONTEAS C N,MAJUMDAR A P N.The effects of gastrin,epidermal growth factor,and somatostatin on DNA synthesis in a small intestinal crypt cell line (IEC⁃6)[J].Proceedings of the Society for Experi⁃mental Biology and Medicine,1987,184(3):307-311.
[4] KOH S Y,GEORGE S,BRÖZEL V,et al.Porcine in⁃testinal epithelial cell lines as a new in vitro model for studying adherence and pathogenesis of enterotoxigen⁃ic Escherichia coli[J].Veterinary Microbiology,2008,130(1/2):191-197.
[5] KAEFFER B,BOTTREAU E,VELGE P,et al.Epithe⁃lioid and fibroblastic cell lines derived from the ileum of an adult histocompatible miniature boar(d/d haplo⁃type)and immortalized by SV40 plasmid[J].Europe⁃an Journal of Cell Biology,1993,62(1):152-162.
[6] LU S,YAO Y,MENG S M,et al.Overexpression of apolipoprotein A⁃Ⅳenhances lipid transport in new⁃born swine intestinal epithelial cells[J].The Journal of Biological Chemistry,2002,277(35):31929-31937.
[7] SCHIERACK P,NORDHOFF M,POLLMANN M,et al.Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J].Histochemistry and Cell Biology,2006,125 (3):293-305.
[8] PETTO C,LESKO S,GÄBEL G,et al.Establishment and characterization of porcine colonic epithelial cells grown in primary culture[J].Cells Tissues Organs,2011,194(6):457-468.
[9] CHOUGULE P,HERLENIUS G,HERNANDEZ N M,et al.Isolation and characterization of human pri⁃mary enterocytes from small intestine using a novel method[J].Scandinavian Journal of Gastroenterol,2012,47(11):1334-1343.
[10] KIMMICH G A.Isolation of intestinal epithelial cells and evaluation of transport functions[J].Methods in Enzymology,1990,192:324-340.
[11] 李艳,徐凯,赵国琦.奶牛乳腺上皮细胞的培养与鉴定[J].上海畜牧兽医通讯,2014(1):8-11.
[12] 洪智敏,贾永杰,瞿明仁,等.鸡胚小肠上皮细胞的分离及原代培养研究[J].江西农业大学学报,2011,33(6):1164-1170.
[13] DEVENEY C W,RAND⁃LUBY L,RUTTEN M J,et al.Establishment of human colonic epithelial cells in long-term culture[J].Journal of Surgical Research,1996,64(2):161-169.
[14] SHAY J W,WRIGHT W E,BRASISKYTE D,et al.E6 of human papillomavirus type 16 can overcome the M1 stage of immortalization in human mammary epi⁃thelial cells but not in human fibroblasts[J].Onco⁃gene,1993,8(6):1407-1413.
[15] BAND V,ZAJCHOWSKI D,KULESA V,et al.Hu⁃man papilloma virus DNAs immortalize normal hu⁃man mammary epithelial cells and reduce their growth factor requirements[J].Proceedings of the National A⁃cademy of Sciences of the United States of America,1990,87(1):463-467.
[16] SHAMANIN V A,ANDROPHY E J.Immortalization of human mammary epithelial cells is associated with inactivation of the p14ARF⁃p53 Pathway[J].Molecular Cellular Biology,2004,24(5):2144-2152.
[17] WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of ca⁃sein and mTOR pathway related genes in mammaryepithelial cells from dairy cattle[J].PLoS One,2014,9(5):e95985.
[18] WHEELER T T,CALLAGHAN M R,DAVIS S R,et al.Milk protein synthesis,gene expression,and hormo⁃nal responsiveness in primary cultures of mammary cells from lactating sheep[J].Experimental Cell Re⁃search,1995,217(2):346-354.
[19] RUSU D,LORET S,PEULEN O,et al.Immunochem⁃ical,biomolecular and biochemical characterization of bovine epithelial intestinal primocultures[J].BMC Cell Biology,2005,6:42.
[20] 范斌,余冰,田刚,等.新生家兔空肠上皮细胞的体外分离培养与鉴定[J].动物营养学报,2014,26(6):1570-1578.
Culture and Identification of the Chicken Intestinal Epithelial Cells Isolated from Chick Embryo in Vitro
ZHAN Kang ZUO Xiaoxin GONG Xiaoxiao CHEN Yinyin ZHAN Jinshun ZHAO Guoqi
∗
(责任编辑 陈 燕)
(College of Animal Science and Technology,Yangzhou University,Yangzhou 225009,China)
Abstract:This experiment was conducted to provide a stable model of chicken intestinal epithelial cell line for the study the pathogenesis of chicken intestinal diseases,chicken intestinal absorption of nutrients transport and immune mechanism.Our research applied the chicken intestinal tissue culture to successfully isolate and culture the chicken intestinal epithelial cell.We applied curettage,enzyme digestion,limiting dilution method to purify the chicken intestinal epithelial cell.MTT method was used to identify the growth curve of the chicken intestinal epithelial cell.The specific genes of chicken intestinal epithelial cells were detected by quantitative real⁃time PCR(RT⁃PCR).The results showed as follow:1)the chicken intestinal epithelial cells could be successfully cultured by tissue culture cells.2)The chicken intestinal epithelial cells started the proliferation 8 h after see⁃ding the tissue.3)The“S”shape of the growth curve of the chicken intestinal epithelial cells was accordance with the law of cell proliferation.4)The chicken intestinal epithelial cells were swollen and started senescence and apoptosis after 5 passages.And many cells were not adherent to the bottom of the plate after seeded by pas⁃sage.In conclusion,seeding the chicken intestinal tissue in 6⁃well plate,we are able to obtain a stable chicken intestinal epithelial cells line,which provides a stable cell model to study the pathogenesis of chicken intestinal disease,the absorption of chicken intestinal nutrients transport,immortalized chicken intestinal epithelial cells line.[Chinese Journal of Animal Nutrition,2015,27(7):2150⁃2156]
Key words:chicken intestinal epithelial cell;nutrition and immunity;stability;immortalize
Corresponding author∗,professor,E⁃mail:gqzhao@yzu.edu.cn
通信作者:∗赵国琦,教授,博士生导师,E⁃mail:gqzhao@yzu.edu.cn
作者简介:詹 康(1988—),男,江苏南京人,博士研究生,从事动物分子营养研究。E⁃mail:zhankang0305@163.com
基金项目:江苏省高校优势学科建设工作资助项目(PAPD)
收稿日期:2015-02-01
doi:10.3969/j.issn.1006⁃267x.2015.07.020
文章编号:1006⁃267X(2015)07⁃2150⁃07
文献标识码:A
中图分类号:S852.2

