壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响
黄鑫玮 杨莎莎 刘 毅 范 涛 明 伟 林荣楠 温安祥(四川农业大学生命科学学院,雅安625014)
壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响
黄鑫玮 杨莎莎 刘 毅 范 涛 明 伟 林荣楠 温安祥∗
(四川农业大学生命科学学院,雅安625014)
摘 要:为探究壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响,选择初始体重为(8.78±0.38)g的健康幼建鲤225尾,随机分为5组(每组设3个重复,每个重复15尾),分别饲喂壳寡糖添加量为0(对照组)、0.30%、0.60%、0.90%和1.50%的饲料80 d。结果表明:与对照组相比,各壳寡糖添加组幼建鲤的特定生长率和增重率均有所升高(P>0.05);0.6%组血浆甘油三酯和总胆固醇含量显著低于其余各组(P<0.05),而血浆高密度脂蛋白胆固醇含量则显著高于其余各组(P<0.05);各壳寡糖添加组血浆丙二醛含量显著低于对照组(P<0.05),0.6%组血浆总抗氧化能力显著高于对照组(P<0.05);各壳寡糖添加组白细胞吞噬率、肠道皱襞密度显著高于对照组(P<0.05),0.6%和0.9%组肠壁厚度显著大于对照组(P<0.05);各壳寡糖添加组肠道大肠杆菌数量均显著低于对照组(P<0.05),0.6%和0.9%组肠道双歧杆菌和大肠杆菌数量显著高于对照组(P<0.05)。由结果可知,壳寡糖可增强幼建鲤的生长性能和非特异性免疫功能,调节脂肪代谢;通过回归曲线的X极值分析得出,当饲料中壳寡糖的添加量在0.86%~1.09%之间时,对幼建鲤的非特异性免疫及肠道健康的保护性最佳。
关键词:壳寡糖;幼建鲤;生长;脂肪代谢;免疫;肠道
壳寡糖(chitosan oligosaccharides,COS)是甲壳质脱乙酰化的产物壳聚糖经降解获得,是由2~10个氨基葡萄糖通过β-1,4糖苷键连接而成的低聚糖,也是自然界中大量存在的碱性氨基多糖,具有水溶性好、易吸收的特点[1]。壳寡糖具有提高免疫力、抗肿瘤、调控脂肪代谢、调节肠道生长情况以及消化道微生物区系等作用,已广泛应用于食品、医药以及畜牧饲料方面,但在水产饲料中的应用却少见报道。为此,本试验通过在饲料中添加不同剂量的壳寡糖,研究其对幼建鲤(Cypri⁃nus carpio var.Jian)生长性能、脂肪代谢相关指标、非特异性免疫指标、肠道组织结构及肠道菌落的影响,探讨壳寡糖影响鲤鱼生长性能和免疫抗病的作用机制,为壳寡糖在水产动物饲料中的运用提供理论依据。
1 材料与方法
1.1 试验设计与饲料
基础饲料组成及营养水平见表1。在基础饲料中分别添加质量分数为0(对照组)、0.30%、0.60%、0.90%和1.50%的壳寡糖(由青岛云宙生物技术有限公司提供,脱乙酰度大于90%,壳寡糖含量大于93%,pH为7.0~9.0),配制成5种试验饲料,并将上述试验饲料制成直径为2 mm的颗粒饲料。
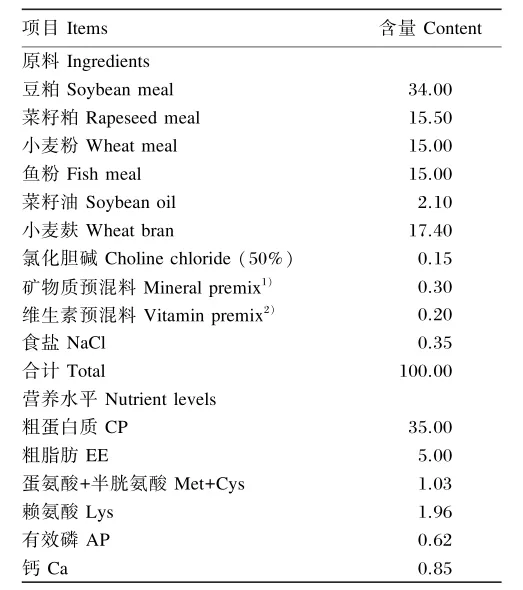
表1 基础饲料组成及营养水平(风干物质)Table 1 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.2 试验动物及饲养管理
试验用幼建鲤购于四川通威鱼种养殖基地,试验开始前将健康幼建鲤消毒后暂养2周,然后选取健壮幼建鲤225尾[初始体重为(8.78± 0.38)g],随机分为5组,每组设3个重复,每个重复15尾,饲养于60 cm×45 cm×45 cm的玻璃缸中,24 h充氧,每天投喂2次(08:30和17:00各1次)。按鱼体重的5%投喂,投喂量根据实际情况适时调整。试验期为80 d。每天定时清除缸内幼建鲤的排泄物和残饵,控制水温在26~28℃,pH 7~8,溶氧浓度保持在7 mg/L。记录试验期内幼建鲤摄食情况和死亡数。
1.3 样品采集
试验结束后,停食24 h后,每个重复随机挑选10尾作为测定样本。测定体重和体长后尾静脉取血,置于抗凝管中。血液分为2份,一份用于白细胞吞噬率的测定,另一份于4℃条件下3 000 r/min离心10 min,制备血浆,测定总胆固醇(TCH)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL⁃C)、丙二醛(MDA)含量和总抗氧化能力(T⁃AOC)。在每个重复的测定样本中,随机挑选4尾进行解剖,取出肠道组织,用生理盐水冲洗肠道内容物,做菌落检测,然后将肠道组织迅速浸泡于10%的中性甲醛溶液中,用于组织切片。
1.4 指标测定
1.4.1 生长指标测定
增重率(WGR,%)=100×(Wt-W0)/W0。
特定生长率(SGR,%/d)=100×(lnWt-lnW0)/d。
存活率(SR,%)=100×Nt/N0。
肥满度(CF,%)=100×Wt/L3。
式中:Wt为末体重(g);W0为初体重(g);d为饲养天数(d);Nt为成活尾数;N0为初始尾数;L为鱼体长度(cm)。
1.4.2 脂肪代谢相关指标测定
血浆TCH、TG和HDL⁃C含量,按南京建成生物工程研究所试剂盒说明书方法,用酶标仪测定。
1.4.3 非特异性免疫相关指标的测定
1.4.3.1 白细胞吞噬能力的测定
参照王军等[2]的方法改进后进行测定,具体如下:在0.1 mL的血液中滴加20 μL的致敏酵母,37℃温浴,2 000 r/min离心后制成白细胞血涂片,吉姆萨染色,油镜下观察,随机计数100个白细胞中有吞噬现象的细胞数,计算白细胞吞噬率。
1.4.3.2 血浆中抗氧化指标的测定
血浆T⁃AOC和MDA含量,按南京建成生物工程研究所试剂盒说明书方法,用Unico-2000型分光光度计测定。
1.4.4 肠道的组织学观察以及肠道菌群检测
1.4.4.1 前、中、后肠组织学观察
将中性甲醛固定液中的肠道组织取出,依次经过冲洗、逐级脱水、透明、浸蜡、包埋后切片机连续切片(厚度为6 μm),烘干、脱蜡后复水,苏木精-伊红(HE)染色,中性树脂封片。采用Olym⁃pus⁃DP70显微镜观察并拍照。
每组取6张肠道切片进行肠皱襞高度、肠皱襞密度(肠上皮细胞表面伸出的细长指状突起的个数)和肠壁厚度的测量,观察肠道发育情况。
1.4.4.2 肠道菌群检测
肠道微生物的测定采用点种法[3]。将肠道内容物取出称取0.1 g后用0.9 mL生理盐水混匀,取上清液10倍系列梯度稀释至10-6,然后用微量进样器取稀释梯度样品100 μL,接种于各种培养基[大肠杆菌用伊红美兰琼脂(EMB)培养基,乳酸杆菌用MRS琼脂(MRSA)培养基,双歧杆菌用MRS+X⁃gal琼脂培养基]中,每个稀释梯度做4个平行。在37℃下培养48 h,培养结束后选取菌落清晰分散的进行计数。菌群数量以每克肠道内容物所含细菌群落总数的对数[lg(CFU/g)]表示。
1.5 数据处理
试验结果采用SPSS 17.00进行单因素方差分析(one⁃way ANOVA),并采用Duncan氏法进行组间的多重比较,除SR外的所有数据均以平均值±标准差来表示,P<0.05表示差异显著。线性回归方程通过曲线估计进行建立和分析,并得出R2和X极值。
2 结果与分析
2.1 壳寡糖对幼建鲤生长性能的影响
如表2所示,与对照组相比,添加壳寡糖后幼鱼的WGR、SGR和SR均有所提高,但均无显著差异(P>0.05);随壳寡糖添加量的增加,WGR和SGR呈先上升后下降的趋势,但均高于对照组。各壳寡糖添加组的CF与对照组相比亦无显著差异(P>0.05)。
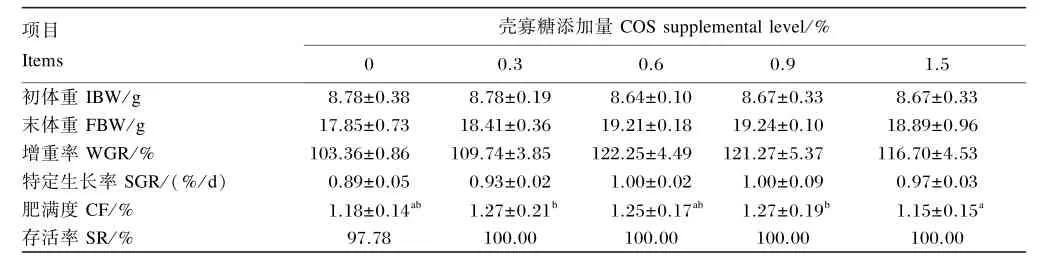
表2 壳寡糖对幼建鲤生长性能的影响Table 2 Effects of COS on growth performance of juvenile Jian carp(Cyprinus carpio var.Jian)
同行数据肩标不同字母表示差异显著(P<0.05)。下表同。
Values in the same row with different letter superscripts were significantly different(P<0.05).The same as below.
2.2 壳寡糖对幼建鲤脂肪代谢相关指标的影响
如表3所示,0.6%组与其他各组比较,血浆中TCH含量显著降低(P<0.05),其他壳寡糖添加组血浆中TCH含量与对照组比较均有所降低,但差异不显著(P>0.05);0.6%组血浆中TG含量显著低于其他各组(P<0.05),其他壳寡糖添加组血浆中TG含量较对照组均有所降低,但未达到显著水平(P>0.05);与对照组比较,各壳寡糖添加组血浆中HDL⁃C含量均有所升高,其中0.6%和0.9%组显著高于对照组(P<0.05),0.3%和1.5%组较对照组差异不显著(P>0.05)。

表3 壳寡糖对幼建鲤脂肪代谢相关指标的影响Table 3 Effects of COS on lipid metabolism related indices of juvenile Jian carp(Cyprinus carpio var.Jian) mmol/L
2.3 壳寡糖对幼建鲤非特异性免疫指标的影响
如表4所示,各壳寡糖添加组的白细胞吞噬率均显著高于对照组(P<0.05);各壳寡糖添加组血浆中T⁃AOC较对照组均有所提高,但仅0.6%组与对照组的差异达显著水平(P<0.05);各壳寡糖添加组血浆中MDA含量均显著低于对照组(P<0.05)。

表4 壳寡糖对幼建鲤非特异性免疫指标的影响Table 4 Effects of COS on non⁃specific immune indices of juvenile Jian carp(Cyprinus carpio var.Jian)
2.4 壳寡糖对幼建鲤肠道组织结构的影响
如表5所示,各壳寡糖添加组的肠皱襞密度均显著大于对照组(P<0.05),但各壳寡糖添加组之间差异不显著(P>0.05);各壳寡糖添加组的肠皱襞高度均高于对照组,但差异不显著(P>0.05);此外,0.6%和0.9%组的肠壁厚度显著大于对照组(P<0.05)。
如图1所示,添加壳寡糖后幼鱼肠皱襞上黏膜脱落、断裂现象较对照组减少。如图2所示,各壳聚糖添加组皱襞内肥大细胞数量较对照组有明显的增加,杯状细胞紧密排列在皱襞外缘下,结构完整。从整体上来看,添加壳寡糖后肠道组织的生长发育情况较对照组好,皱襞排列紧密,高度有所增加。

表5 壳寡糖对幼建鲤肠道结构的影响Table 5 Effects of COS on intestinal structure of juvenile Jian carp(Cyprinus carpio var.Jian)
2.5 壳寡糖对幼建鲤肠道菌群的影响
如表6所示,添加壳寡糖后幼鱼肠道内双歧杆菌数量增加,其中0.6%、0.9%和1.5%组幼鱼肠道内双歧杆菌数量显著高于对照组(P<0.05);各壳寡糖添加组幼鱼肠道内大肠杆菌数量均显著低于对照组(P<0.05);0.6%和0.9%组幼鱼肠道内乳酸杆菌数量显著高于对照组(P<0.05),其他壳寡糖添加组较对照组有所提高,但差异均不显著(P>0.05)。
2.6 回归分析
回归方程中R2越大,回归曲线的可信度越高。通过分析回归曲线中R2大于0.9的测试指标,求出曲线的X极值,该值即为对应指标的最适添加量。如表7所示,饲料中壳寡糖添加量为1.01%时,白细胞吞噬率最高;饲料中壳寡糖添加量为0.93%时,血浆中MDA含量最低;饲料中壳寡糖添加量为0.86%时,肠皱襞密度最大;饲料中壳寡糖添加量分别为0.97%和0.88%、1.09%时,双歧杆菌和乳酸杆菌、大肠杆菌的数量最佳。如前所述,幼建鲤非特异性免疫和肠道免疫相关指标的最适添加量均被包含在0.86%~1.09%之间。

图1 幼建鲤肠道显微镜结构观察(HE染色,200×)Fig.1 The observed of intestinal microscopic structure of juvenile Jian carp(Cyprinus carpio var.Jian)(HE⁃staining,200×)

图2 幼建鲤肠道显微镜结构观察(HE染色,400×)Fig.2 The observed of intestinal microscopic structure of juvenile Jian carp(Cyprinus carpio var.Jian)(HE⁃staining,400×)

表6 壳寡糖对幼建鲤肠道菌群的影响Table 6 Effects of COS on intestinal bacteria of juvenile Jian carp(Cyprinus carpio var.Jian)lg(CFU/g)

表7 回归分析Table 7 Regression analysis
3 讨 论
3.1 壳寡糖对幼建鲤生长性能的影响
寡糖在水产饲料中作为添加剂早有报道。Refstie等[4]研究发现,投喂寡糖后的大西洋鲑生长情况明显优于未添加寡糖的对照组,增重率有显著提高。于艳梅等[5]在饲料中分别添加0.1%、0.2%、和0.3%的甘露寡糖,结果表明,甘露寡糖提高了试验组黄颡鱼的增重率,添加量为0.2%组的效果最佳。孙立威等[6]在罗非鱼饲料中添加不同量的壳寡糖并饲养10周,其结果显示添加壳寡糖的各组的增重率、特定生长率等情况均优于未添加壳寡糖的对照组,添加量为0.5%时效果最佳。本试验结果表明,在饲料中添加壳寡糖后,幼建鲤的增重率和特定生长率均得到了提高,但各组的增重倍数较低,这可能与养殖密度及日投喂次数有关。上述结果说明,添加壳寡糖等寡糖类物质对鱼类的生长有促进作用,其原因可能是壳寡糖能促进矿物质元素的吸收,壳寡糖分子上含有氨基(—NH2)和羟基(—OH)等活性基团,很容易与矿物质元素结合后在小肠被吸收[7]。壳寡糖还能够使肠道绒毛密度和高度增加,加大肠道内吸收面积,进而促进营养物质的消化吸收[8];同时,壳寡糖还具有改善肠道菌群的作用,保护肠黏膜的完整性,进而提高饲料的利用率[9]。
3.2 壳寡糖对幼建鲤脂肪代谢相关指标的影响
动物血液是营养和代谢物质的重要载体,血液中TG和TCH含量的升高会危害动物健康[10]。研究发现,壳寡糖可以降低动物血液中TG和TCH的含量,进而调节脂肪代谢,降低体内脂肪沉积[11]。刘冰等[12]在对正常大鼠和糖尿病大鼠的研究中发现,添加壳寡糖后的试验大鼠血清中TG 和TCH的含量显著低于正常对照组和糖尿病对照组。王际英等[13]在对星斑川鲽幼鱼的研究中发现,添加壳寡糖后各组幼鱼血清中TG和TCH的含量均低于对照组。本试验结果表明,在饲料中添加壳寡糖后,幼建鲤血浆中TG和TCH的含量较对照组也有所降低,血浆中HDL⁃C的含量得到了提高,且在0.6%组有显著的改善。HDL⁃C被认为是“好”胆固醇,它是胆固醇由组织细胞运输回肝脏的主要工具,可将肝外的自由胆固醇逆向运输回肝脏代谢,调节肝脏和血液中脂肪的平衡,清除血液和组织细胞中过剩的胆固醇。马利等[14]在饲料中添加壳寡糖饲喂南美白对虾,8周后发现,壳寡糖可以有效地降低南美白对虾血清中TG和TCH的含量,提高HDL⁃C的含量,从而促进脂肪代谢。
3.3 壳寡糖对幼建鲤非特异性免疫指标的影响
非特异性免疫是鱼类主要的免疫系统。白细胞吞噬能力、血浆T⁃AOC和MDA含量都是衡量鱼类非特异性免疫的重要指标。白细胞的主要功能是吞噬细菌和异物,在非特异性免疫中起到重要的作用。T⁃AOC反映机体防御体系的抗氧化能力的强弱,其与健康程度存在着密切联系。MDA是生物体内脂质过氧化反应的氧化终产物,脂质过氧化会引起细胞损伤,因此血浆中MDA的含量可以间接地反映机体内细胞的损伤程度。本试验结果表明,各壳寡糖添加组幼鱼的白细胞吞噬率与对照组相比均有显著提高;血浆中T⁃AOC含量均高于对照组,且在0.6%组有显著的提高;血浆中MDA含量与对照组比较均有显著降低。王树芹等[15]在饲料中添加壳聚糖后饲喂异育银鲫,发现壳寡糖可以提高白细胞吞噬能力。张国启等[16]研究发现,壳寡糖可以提高黄河鲤血清T⁃AOC,同时抑制MDA的产生。壳寡糖能提升鱼类的非特异性免疫能力,可能是因为壳寡糖具有清除羟自由基(·OH)的能力,从而提升鱼体的抗氧化能力,保护免疫器官,进而加强免疫作用的效果[17];此外,壳寡糖能激活巨噬细胞释放白细胞介素-1 (IL⁃1),提升巨噬细胞的活性[18]。巨噬细胞源自单核细胞,单核细胞作为白细胞的种类之一,其吞噬活性的提升可能是在某些因子的刺激下发生的。
3.4 壳寡糖对幼建鲤肠道健康的影响
鱼类的肠道是消化与吸收营养物质的主要场所,也是鱼类最大的黏膜免疫器官和最脆弱的免疫屏障[19]。肠道形态结构的正常是营养物质吸收和肠道免疫正常的基础。壳寡糖是由N-乙酰-D-葡萄糖胺以β-1,4糖苷键结合而成的多糖,可以不被消化酶和胃酸降解而被肠道上皮细胞直接吸收[20],促进肠道生长发育。肠道菌落的变化对肠道结构具有重要的影响。壳寡糖分子中的游离氨基带正电荷,它能抑制微生物和真菌的生长。壳寡糖中含有双歧杆菌促生长因子,对双歧杆菌的生长具有促进作用,可以增加肠道内有益菌群数量,有效地保护肠道黏膜。王秀武等[21]在对肉鸡生产性能的研究中指出,添加壳寡糖可改变肉鸡的肠道结构。连国琦等[22]在对环江香猪的研究中发现,添加壳寡糖对大肠杆菌、链球菌等肠道有害菌有明显的抑制作用,而对双歧杆菌和乳酸杆菌有明显的促进作用。蔡雪峰等[23]报道了壳寡糖对虹鳟肠道菌群的影响,研究发现添加壳寡糖后肠道菌群总数没有变化,但是菌群的种类发生了明显的变化,能够利用壳寡糖作为唯一碳源的菌株种类,其数量均多于对照组。本试验结果表明,添加壳寡糖后幼鱼肠道菌落的分布有了明显的变化,有益菌落双歧杆菌和乳酸杆菌的数量较对照组都有所增加,其中0.6%和0.9%组效果显著,大肠杆菌的数量均显著低于对照组。双歧杆菌可以黏附在肠黏膜细胞表面,对肠黏膜起到保护作用,同时,双歧杆菌释放B族维生素,增强肠道蠕动和肠黏膜表面对蛋白质的吸收能力,促进肠道的生长发育[24]。添加壳寡糖后肠道内皱襞高度、密度、皱襞肥大细胞和杯状细胞数量都优于对照组,说明肠道菌落的组成与肠道的生长发育情况以及完整性有一定的相关性。其原因可能是因为壳寡糖促进了双歧杆菌的生长繁殖,形成优势菌群,产生了短链脂肪酸,降低了肠道内的pH,从而抑制了肠道内其他病原菌的生长[25]。
4 结 论
饲料中添加壳寡糖可提高幼建鲤的生长性能和非特异性免疫功能,调节脂肪代谢。通过回归曲线的X极值分析得出,当饲料中壳寡糖的添加量在0.86%~1.09%时,对幼建鲤的非特异性免疫及肠道健康的保护性最佳。
参考文献:
[1] 徐魏,谷薇薇,于勇,等.功能性壳寡糖的生物学活性[J].生命的化学,2012,32(5):460-463.
[2] 王军,鄢庆枇,苏永全,等.免疫添加物对大黄鱼血液白细胞数量及其吞噬功能的影响[J].海洋科学,2001,25(9):44-46.
[3] 莫照兰,俞勇,李会荣,等.弧菌拮抗菌的筛选[J].青岛海洋大学学报:自然科学版,2001,31(2):225-231.
[4] REFSTIE S,STOREBAKKEN T,ROEM A J.Feed consumption and conversion in Atlantic salmon(Sal⁃mo salar)fed diets with fish meal,extracted soybean meal or soybean meal with reduced content of oligo⁃saccharides,trypsin inhibitors,lectins and soya anti⁃gens[J].Aquaculture,1998,162(3/4):301-312.
[5] 于艳梅,吴志新,陈孝煊,等.魔芋甘露寡糖对黄颡鱼非特异性免疫功能及生长的影响[J].华中农业大学学报,2010,29(3):351-355.
[6] 孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[7] 郭芳宁,李春超,金黎明,等.壳寡糖铁配合物的合成及抗氧化作用[J].食品工业科技,2013,34(20):119-121.
[8] LI X,PIAO X,KIM S,et al.Effects of chito⁃oligosac⁃charide supplementation on performance,nutrient di⁃gestibility,and serum composition in broiler chickens [J].Poultry Science,2007,86(6):1107-1114.
[9] HUANG R L,YIN Y L,WU G Y,et al.Effect of diet⁃ary oligochitosan supplementation on ileal digestibility of nutrients and performance in broilers[J].Poultry science,2005,84(9):1383-1388.
[10] KIM K N,JOO E S,KIM K I,et al.Effect of chitosan oligosaccharides on cholesterol level and antioxidant enzyme activities in hypercholesterolemic rat[J].Jour⁃nal of the Korean Society of Food Science and Nutri⁃tion,2005,34(1):26-41.
[11] 占今舜,胡金杰,林彬彬,等.壳寡糖的生物学功能及其在动物生产中的应用[J].中国饲料,2012(4):33-36.
[12] 刘冰,刘万顺,韩宝芹,等.壳寡糖及其衍生物对实验性糖尿病大鼠调节血脂和抗氧化作用[J].山东大学学报:理学版,2006,41(4):158-163.
[13] 王际英,蒋锦坤,张利民,等.壳聚糖对星斑川鲽幼鱼生长、脂肪含量及抗氧化能力的影响[J].中国农学通报,2013,29(8):64-70.
[14] 马利,曹俊明,吴建开,等.壳寡糖对南美白对虾生长和血清生化指标的影响[J].淡水渔业,2006,36 (2):6-8.
[15] 王树芹,周洪琪.壳聚糖对异育银鲫溶菌酶和白细胞吞噬活性的影响[J].上海水产大学学报,2004,13 (2):121-125.
[16] 张国启.壳寡糖对黄河鲤生产性能、免疫指标和肠道菌群影响的研究[D].硕士学位论文.郑州:河南工业大学,2012.
[17] 竺国芳,赵鲁杭.几丁寡糖和壳寡糖的研究进展[J].中国海洋药物,2000,19(1):43-46
[18] SUZUKI K,MIKAMI T,OKAWA Y,et al.Antitumor effect of hexa⁃N⁃acetylchitohexaose and chitohexaose [J].Carbohydrate Research,1986,151:403-408.
[19] 吴莉芳,邢秀苹,赖红娥,等.大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响[J].西北农林科技大学学报:自然科学版,2014,42(10):7-14.
[20] 张丽.壳寡糖的制备及对动物营养功能的研究进展[J].山东畜牧兽医,2005(6):43-44.
[21] 王秀武,林欣,张丽,等.壳寡糖对肉仔鸡生产性能、小肠组织结构和肌组织矿物质元素含量的影响[J].中国粮油学报,2005,20(2):83-88.
[22] 连国琦,周笑犁,孔祥峰,等.壳寡糖对环江香猪生化参数及肠道菌群组成的影响[J].天然产物研究与开发,2012,24(11):1605-1609.
[23] 蔡雪峰,罗琳,战文斌,等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报:自然科学版,2006,36(4):606-610.
[24] 杜昱光,白雪芳,虞星矩,等.寡聚糖类物质生理活性的研究[J].中国生化药物杂志,1997,18(5):268-271.
[25] VAN DER WERF M J,VENEMA K.Bifidobacteria:genetic modification and the study of their role in the colon[J].Journal of Agricultural and Food Chemistry,2001,49(1):378-383.
Effect of Dietary Chitosan on Growth Performance,Lipid Metabolism,Non⁃Specific Immune Function and Intestinal Health of Juvenile Jian Carp(Cyprinus carpio var.Jian)
HUANG Xinwei YANG Shasha LIU Yi FAN Tao MING Wei LIN Rongnan WEN Anxiang
∗
(责任编辑 菅景颖)
(College of Life Sciences,Sichuan Agricultural University,Ya’an 625014,China)
Abstract:This experiment was conducted to investigate the effects of chitosan oligosaccharides on growth per⁃formance,lipid metabolism and non⁃specific immune function and intestinal health of juvenile Jian carp(Cyp⁃rinus carpio var.Jian).A total of 225 juvenile Jian carp with an average body weight of(8.78±0.38)g were randomly divided in 5 groups with 3 replicates per group and 15 fish per replicate.The fish in the 5 groups were fed the diets supplemented with 0(control group),0.3%,0.6%,0.9%and 1.5%of chitosan oligosac⁃charides for 80 days,respectively.The results showed as follows:compared with the control group,specific growth rate and weight gain rate in different chitosan oligosaccharides groups were increased(P>0.05);plas⁃ma triglyceride and total cholesterol contents of 0.6%group were significantly lower than those of other groups (P<0.05),while plasma high density lipoprotein cholesterol content was significantly higher than that of other groups(P<0.05);plasma malondialdehyde content of each chitosan oligosaccharides group was significantly lower than that of control group(P<0.05),and plasma total antioxidant capacity of 0.6%group was signifi⁃cantly higher than that of control group(P<0.05);the phagocytic rate of leukocyte and intestinal fold density of each chitosan oligosaccharides group were significantly higher than those of control group(P<0.05),and intestinal wall thickness of 0.6%and 0.9%groups was significantly bigger than that of control group(P<0.05);the amount of Escherichia coli in intestine of chitosan oligosaccharides group was significantly lower than that of control group(P<0.05),while the amounts of Bifidobacterium and Lactobacillus in intestine of 0.6%and 0.9%groups were significantly higher than those of control group(P<0.05).Collectively,these findings suggest that the chitosan oligosaccharides can improve growth performance and non⁃specific immune function,and adjust lipid metabolism of juvenile Jian carp.According to the X extreme value analysis of regres⁃sion curves of non⁃specific immunity and intestinal health,it can be concluded that the optimal supplemental level of chitosan oligosaccharides in the diet of juvenile Jian carp is 0.86%to 1.09%.[Chinese Journal of Ani⁃mal Nutrition,2015,27(7):2106⁃2114]
Key words:chitosan oligosaccharides;juvenile Jian carp(Cyprinus carpio var.Jian);growth performance;lipid metabolism;immune;intestine
Corresponding author∗,professor,E⁃mail:waxwbw@aliyun.com
通信作者:∗温安祥,教授,博士生导师,E⁃mail:waxwbw@aliyun.com
作者简介:黄鑫玮(1988—),男,四川成都人,硕士研究生,研究方向为水生动物营养免疫。E⁃mail:739941347@qq.com
基金项目:四川省教育厅重点项目(11ZA292)
收稿日期:2015-02-03
doi:10.3969/j.issn.1006⁃267x.2015.07.016
文章编号:1006⁃267X(2015)07⁃2106⁃09
文献标识码:A
中图分类号:S963

