食管癌组织中CtBP2与P16INK4A的表达及其相关性分析
食管癌组织中CtBP2与P16INK4A的表达及其相关性分析*
戴晓荣,成宏伟,李瑶瑶,周瑞
(扬州大学医学院附属泰兴市人民医院,江苏泰兴225400)
摘要:目的:探讨CtBP2与P16INK4A在食管癌组织中的表达,并且分析两者之间的相关性。方法:使用免疫组化法(PV二步法)对我院90例食管癌患者组织中CtBP2与P16INK4A的表达进行检测,并使用统计软件对两者的相关性进行分析。结果:在不同分期中,Ⅰ期和Ⅱ期患者食管癌组织中的P16INK4A阳性率为55.77%,Ⅲ期以上为18.42%,差异较为显著(=7.176,P<0.05);在淋巴结转移中,CtBP2阴性和阳性的差异比较大(=10.986,P<0.01);P16INK4A与CtBP2呈现典型的负相关关系,r=-0.417,P<0.01。结论:CtBP2可以通过抑制细胞周期抑制因子P16INK4A来实现细胞增殖,两者对于细胞的调控是从相反的两个方向进行的。
关键词:P16INK4A;CtBP2;食管癌组织
文章编号:1006-6233(2015)10-1663-04
基金项目:*江苏省泰州市科技支撑项目,(编号:TS2013014)
文献标识码:B
食管癌是全球发病率和死亡率比较高的恶性肿瘤之一,其五年生存率小于30%。对于食管癌患者需要采用手术治疗辅以放疗等治疗手段进行治疗,但其临床效果及其预后仍然不是很理想。细胞周期负性调控因子P16INK4A的表达及修饰异常在食管癌的发生中发挥重要作用,但其在肿瘤中转录水平调控的具体机制还不明确。有研究表明在原代成纤维细胞中CtBP可以通过抑制P16INK4A转录而调控肿瘤的衰老和再生[1]。同时一些前期的研究发现,一种转录阻碍物CtBP2在食管癌组织中高表达,并且可能通过抑制P16的表达影响食管癌细胞的增殖和凋亡,从而提出了CtBP2对P16INK4A转录抑制的负性调节作用参与食管癌的发生及发展的假说[2]。本文中,试图分析出CtBP2与P16INK4A在食管癌增殖的表达,并对其相关性进行分析,现报道如下:
1资料与方法
1.1研究对象:从2012年4月至2014年6月期间具有可行性的临床病例标本90例。其中,标本采集均得到患者或家属的知情同意。纳入标准:所有研究患者病例均通过术后病理学或者活检被确诊为食管癌,此前无食管癌相关放化疗史。排除有任何其他肿瘤诊断史。90例食管癌患者,其中男性51例,女性39例,患者年龄区间介于38~69岁,平均年龄48岁。通过查阅病史和病历记录的方法获得如下数据,病例组诊断年龄鳞癌69例,腺癌21例。临床分期Ⅰ期14例,Ⅱ期38例,Ⅲ期38例,Ⅳ期0例。出现淋巴结转移70例,无20例。患者术前均为接受放化疗,且无其他全身系统性疾病,对患者进行定期复查,并且有完整的随访资料记录。
1.2药品及仪器:药品:甲醛溶液(化学纯),国药集团;无水乙醇(分析纯),国药集团;过氧化氢(化学纯),国药集团;EDTA缓冲液,自配;磷酸缓冲盐溶液(PBS缓冲液),自配。仪器:电热恒温水浴箱,上海启前电子科技有限公司;微波炉,上海格兰仕有限公司;免疫组化检测系统,上海美轩生物科技有限公司。
1.3实验方法:P16INK4A以及CtBP2的检测采用免疫组化法(PV二步法)[3]。采用半数计量法,200倍纤维镜下选取8个视野,每个视野下选取200个计数细胞。细胞无显色0分,浅黄色1分,棕黄色2分,棕褐色3分。根据阳性细胞所占的比例数再按照其百分比进行分类:阳性细胞所占百分比<10%的记为1分,10%~75%记为2分,>75%记为3分。上述两项标准的评分相乘,1分以下为阴性,大于1分的为阳性。
1.4统计学处理:采用Stata7.0统计分析软件,SPSS13.0统计软件对免疫组化结果进行数据分析。
2结果
2.1P16INK4A在食管癌组织中的表达,见表1。
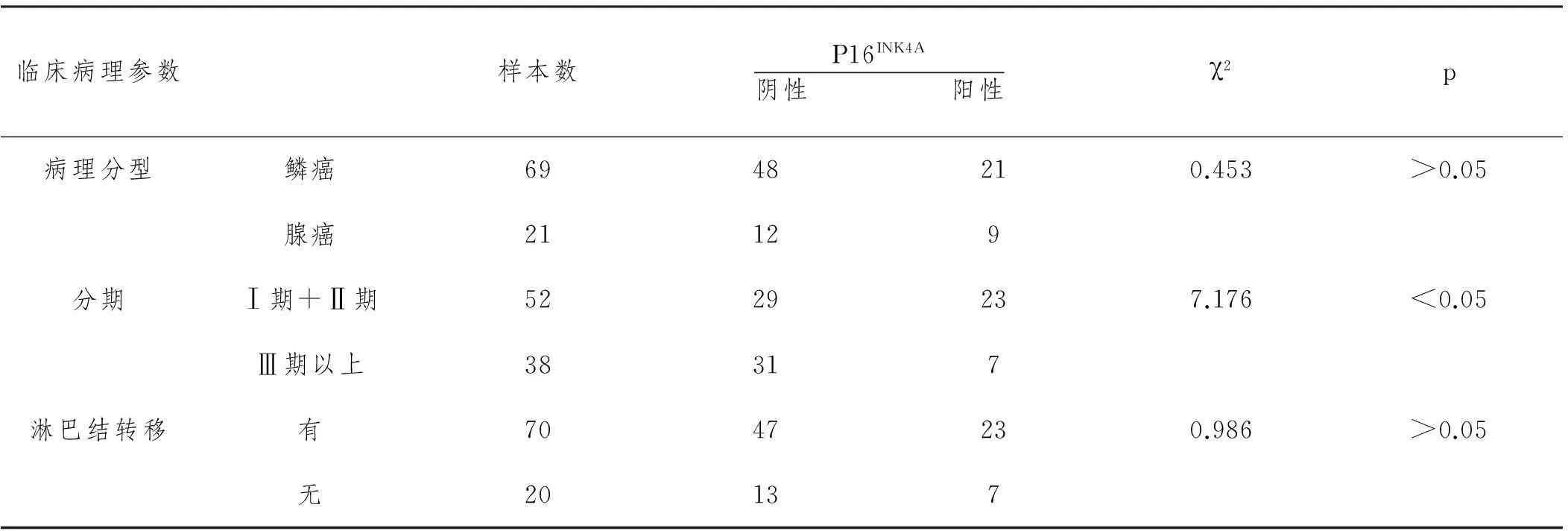
表1 P16 INK4A在食管癌组织中的表达
根据表1可以看出,P16INK4A在不同病理分型以及淋巴结是否转移两个方面的差异不是很显著,值分别为0.453,0.986,P值均大于0.05。但是,在不同分期中差异较为显著,Ⅰ期和Ⅱ期患者食管癌组织中的P16INK4A阳性率为55.77%,Ⅲ期以上为18.42%,P<0.05,差异较为显著。
2.2CtBP2在食管癌组织中的表达,见表2。

表2 CtBP2在食管癌组织中的表达
根据表2可以发现,CtBP2在病理分型以及病理分期两个方面的差异不显著,P值均大于0.05;CtBP2在淋巴结转移这个表中,阴性和阳性的差异比较大,值达到8.986,P<0.01。
2.3食管癌组织中P16INK4A与CtBP2的相关性分析,见表3。

表3 食管癌组织中P16 INK4A与CtBP2的相关性分析
根据表3可以发现,食管癌组织中,P16INK4A与CtBP2呈现典型的负相关关系,r=-0.417,P<0.01。
3讨论
真核生物基因的调控机制是当前分子生物学较为活跃的研究领域之一,而转录水平的调控是一个基因发挥功能的复杂过程。转录因子因其存在的广泛性和调控靶基因的多样性,与肿瘤细胞的生长、增殖、凋亡、浸润转移以及血管生成等各个环节密切相关。随着对转录因子及其作用机制的深入研究,针对转录因子活化与抑制从不同环节寻找药物作用的靶向治疗以及预防与转录因子调控相关的肿瘤疾病[4],已成为当今新的研究热点,有望成为研究新型抗肿瘤药物作用机制的有效途径。
P16INK4A被认为是一种调控细胞周期并抑制细胞分裂的重要基因,定位于人类第9号染色体短臂2区1带(9p21)。P16INK4A是作用于细胞分裂周期关键酶之一的CDK4的抑制因子,对CDk4有高度亲和性,与CDk4特异性结合后,能抑制CDk4激酶活性。P16INK4A的另一种功能是诱导细胞凋亡。它在人类50%的肿瘤中失活,其中家族性黑色素瘤、胆管瘤与P16INK4A基因突变有关,P16INK4A基因位点的同源性确实常发生在神经胶质瘤、间皮瘤、鼻咽瘤和急性淋巴细胞白血病,据报道许多其他恶性肿瘤也有P16INK4A的突变和缺失[5]。因此P16INK4A在细胞增殖、分化和凋亡等活动中扮演重要角色。P16INK4A蛋白功能异常导致细胞周期的紊乱,促进细胞的失控性生长或凋亡下降,最终导致肿瘤的发生。研究证明在食管癌中P16INK4A是一个重要的临床预后指标,食管癌中P16INK4A与肿瘤的大小、分化程度、侵袭能力及淋巴结转移等密切相关。大多数食管癌组织中P16INK4A呈低表达,导致细胞周期失调,引发细胞过度增殖。
CtBP(C-terminal binding protein)最初是因为与E1A蛋白的C末端五个氨基酸结构域(PLDLS)结合而命名,是进化上保守的转录抑制因子,能与一些DNA活性蛋白特异性结合[6],作为DNA结合蛋白与转录抑制酶之间的桥梁,进而抑制基因转录。近年来研究表明CtBP可以通过抑制上皮型钙黏蛋白E-cadherin表达而促进上皮间质转化(EMT),也可以通过发挥转录辅阻遏物的作用负性调节一些肿瘤抑制因子从而产生致癌作用,所以CtBP也被认为是一个抗凋亡因子。CtBP2被研究最多的功能是作为短距离的转录抑制物。一般认为其是通过直接与能够和DNA结合的转录因子或连接蛋白相互作用进而被募集至启动子来抑制基因的表达,然而其作用的具体机制还不清楚。
从本文成果来看,CtBP2作为一种转录抑制因子,能够成功抑制P16的活性,两者呈现典型的负相关现象,并且P<0.01,很显著。说明CtBP2可以通过抑制细胞周期抑制因子P16INK4A来实现细胞增殖。它和P16INK4A对细胞周期的调控是从两个相反的方向参与的。过高的CtBP2表达会严重影响P16INK4A启动子,对P16INK4A的表达产生下调作用,对P16INK4A的活性产生抑制。
参考文献:
[1]Kovi RC, Paliwal S, Pande S, et al. An ARF/CtBP2 complex regulates BH3-only gene expression and p53-independent apoptosis[J].Cell Death Differ, 2010,(3):53~58.
[2]吴新民.CtBP2在大鼠创伤性损伤脑中的表达及意义[J].南通大学学报,2010,(2):34~36.
[3]刘薇,王言奎,杨慧英,等.宫颈癌组织NDRG1与P16蛋白表达及其意义[J].齐鲁医学杂志,2012,27(4).309~313.
[4]Lee W, Swarup S, Chen J, et al. Homeodomain-interacting protein kinases (Hipks) promote Wnt/Wg signaling through stabilization of beta-catenin/Arm and stimulation of target gene expression[J].Development, 2009,(2):24~27.
[5]Yuchan Wang, Fang Liu, Feng Mao.Interaction with Cyclin H/Cyclin-dependent Kinase 7 (CCNH/CDK7) Stabilizes C-terminal Binding Protein 2 (CtBP2) and Promotes Cancer Cell Migration[J].Biol Chem,2013,(3):31~36.
[6]叶晓霞,石彦,霍克克,等.羧基末端结合蛋白CtBP2与泛素结合酶UBE2的相互作用[J].第三军医大学学报,2011,33(17).

