家用豆浆机制作胚芽豆浆
金子鑫 杨瑞金,2 朱生博 刘新娟 张文斌,2
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;3.杭州九阳小家电有限公司,浙江 杭州 310000)
豆浆作为传统食品,在亚洲多数地区消费广泛,因其含有丰富的蛋白质、矿物元素、维生素以及卵磷脂、异黄酮等功能性成分[1],成为 “乳糖不耐症”人群的良好牛奶替代品。长期以来,豆浆一直在中国人的早餐中占有重要的一席之地。从1994年九阳公司发明第一台家用豆浆机以来,豆浆机逐渐走进千家万户,经过20年的发展,家用豆浆机的功能和程序得到了不断的改进和提升,为人们带来了自制丰富多彩、方便健康的豆浆食品的乐趣。
大豆发芽不仅可使脂肪氧合酶、胰蛋白酶抑制剂、植酸等抗营养因子的水平降低,同时还可使水溶性维生素、氨基酸、大豆异黄酮、γ-氨基丁酸(GABA)等物质富集[2]而大大提高其营养价值。GABA是一种非蛋白质氨基酸,广泛分布于动植物体内,具有降血压、降血糖、抗抑郁、安定精神、改善更年期综合症等多种生理功能[3]。近些年,随着GABA的生理功能不断被证实,GABA的富集、生产和应用成为新的热点。2009年,卫生部批准GABA为新资源食品,可用于食品的生产加工。大豆在发芽过程中内源谷氨酸脱羧酶(GAD)被激活利用生物体的内源谷氨酸脱羧酶的脱羧作用将谷氨酸(L-Glu)转化为 GABA[4],使 GABA 得到富集。氨基酸不仅是蛋白质的基本组成单位,而且其本身具有促进胰岛素分泌、作用于消化和神经系统、提高机体免疫功能及解毒功能等特殊的生理功能[5]。蛋白质或多肽经水解成小分子的氨基酸和寡肽后,才被人体小肠黏膜所吸收,更易为机体所利用[6,7]。大豆中胰蛋白酶抑制剂有 Kunitz型(KSTI)和Bowman-Birk型(BBI)两种。大豆在发芽过程中,由于蛋白酶水解作用,KSTI和BBI两种胰蛋白酶抑制剂含量均有所下降[8]。其中,KSTI型较容易失活,pH 7的体系中,100 ℃加热1min即可将其灭活到10%以下,而较难灭活的BBI型,100℃加热360min仍可存活80%左右[9]。
目前中国对胚芽豆浆的煮浆工艺研究较少,且市面上尚无针对发芽大豆为原料制作胚芽豆浆的豆浆机程序。本试验利用九阳工装机平台(经改装后可调整豆浆机制浆工艺的豆浆机),拟研究不同制浆工艺条件下游离氨基酸、γ-氨基丁酸、胰蛋白酶抑制剂的变化,从而优化出最佳胚芽豆浆程序,并在此基础上对胚芽豆浆和干豆豆浆上述考察指标进行对比,以期为豆浆机新程序开发和胚芽豆浆加工工艺提供一定参考,也为普通家庭用户提供更为丰富的食谱选择。
1 材料与方法
1.1 原料与试剂
大豆:品种中黄57,收获于2012年秋;
N-苯甲酰-DL-精氨酸-对硝基苯胺盐酸盐(BAPNA):纯度98%,美国Sigma-Aldrich公司;
胰蛋白酶:酶活≥10 000BAEE U/mg,美国 Sigma-Aldrich公司;
氯化钙、盐酸、三羟甲基氨基甲烷、乙酸、二甲基亚砜、三氯乙酸等:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器设备
豆浆机:D58SG型,杭州九阳小家电有限公司;
豆浆机工装平台:D58SG型,杭州九阳小家电有限公司;
豆芽机:DYJ-S6365型,广东小熊电器有限公司;
数显电热恒温水浴锅:HH-2型,江苏金坛市荣华仪器制造有限公司;
分析天平:MA110型,上海第二天平仪器厂;
紫外—可见分光光度计:722型,尤尼柯上海仪器有限公司;
高效液相色谱仪:Ag1100型,美国安捷伦公司;
冷冻离心机:Allegra25R型,美国贝克曼库尔特有限公司。
1.3 不同豆浆的制作工艺
(1)胚芽豆浆:称取85g无虫害、健康、颗粒饱满的大豆,清水冲洗去除表面杂质和灰尘,然后用去离子水冲洗。于3倍体积水中浸泡6h,后于豆芽机(24±3℃)中发芽16h后取出。加水至1 100g,于D58SG豆浆机或工装机平台中制作豆浆,过30目滤网后取样测定各项指标。
(2)干豆豆浆:将85g大豆清洗后,加水至1 100g,用D58SG程序直接制作豆浆,完成后过30目滤网并取样测定各项指标。
1.4 胚芽豆浆制作的单因素试验设计
(1)粉碎温度:在豆浆机程序基础上,调整粉碎温度分别为50,60,70,80,90℃,其他参数保持不变,在工装平台上运行新程序,豆浆制作完成后过滤取样,测定γ-氨基丁酸、胰蛋白酶抑制剂、游离氨基酸。
(2)煮浆时间:在豆浆机程序基础上,调整煮浆时间分别为2,3,4,6,8min,其他参数保持不变,在工装平台上运行新程序,豆浆制作完成后过滤取样,测定γ-氨基丁酸、胰蛋白酶抑制剂、游离氨基酸。
1.5 γ-氨基丁酸及游离氨基酸含量的测定
(1)γ-氨基丁酸(GABA)及游离氨基酸的提取:称取10 g左右豆浆加入10mL的10%三氯乙酸,用5%三氯乙酸定容至25mL;超声提取30min;后用双层滤纸过滤,将滤液以10 000r/min离心10min,取上清液用于测定。
(2)测定方法:邻苯二甲醛—氯甲酸芴甲酯(OPA—FMOC)柱前衍生化。色谱柱:ODS HYPERSIL(250mm×4.6mm,5μm);柱温:40℃;流动相A相:称取8.0g结晶乙酸钠于烧杯中,加1 000mL水搅拌至所有结晶水溶解,再加入225mL三乙胺,搅拌并滴加5%的醋酸,将pH调到7.20±0.05,加入5mL四氢呋喃,混合后备用;流动相B相:称取8.0g结晶乙酸钠于烧杯中,加入400mL水搅拌至所有结晶溶解,滴加5% 醋酸将pH调到7.20±0.05,将此溶液加入800mL乙腈和800mL甲醇,混合后备用;紫外检测器:发射波长338nm,激发波长262nm;梯度洗脱程序见表1。
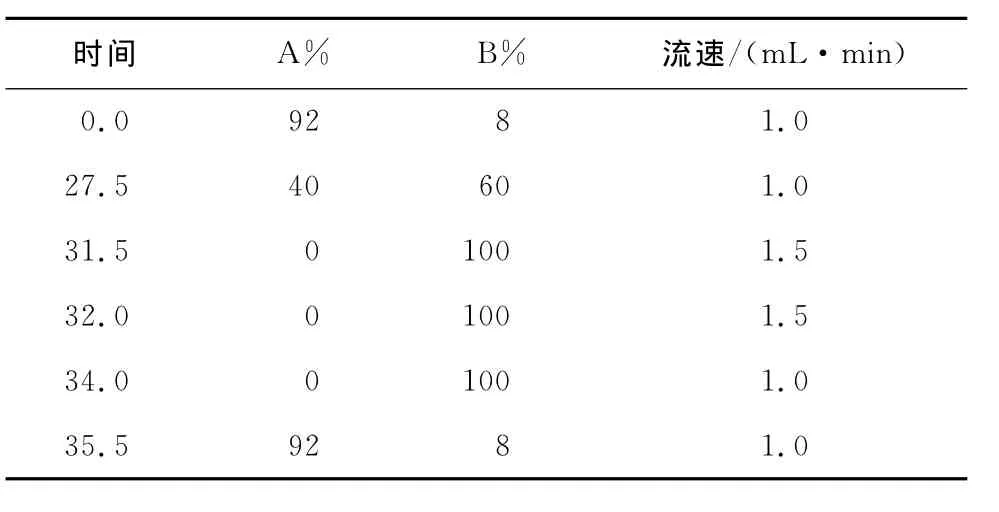
表1 高效液相分析γ-氨基丁酸所用梯度洗脱程序Table 1 Gradient elution procedures for HPLC analysis ofγ-aminobutyric acid
1.6 胰蛋白酶抑制剂活性的测定
参考王韧[10]报道的方法并作微调,具体如下:
(1)试剂配制:① 酶液的配制:0.02mg/mL胰蛋白酶液,称取4mg胰蛋白酶,溶解于0.001mol/L盐酸中,定容至200mL,4℃保存备用;② 底物溶液的配制:40mg BAPNA溶于1mL二甲基亚砜中,用37℃的Tris—HCl缓冲液(pH 8.2)稀释至100mL;③30%乙酸溶液:量取30mL乙酸加水至100mL。
(2)胰蛋白酶抑制剂的提取:待豆浆冷却后于6 000r/min冷冻离心25min,取5mL上清液,加45mL 0.01mol/L NaOH,磁力搅拌2h,稀释后用于测定。
(3)酶活测定:① 标准管(Ar):5mL底物与2mL水混合后于37℃保温10min,之后加2mL胰蛋白酶溶液继续于37℃保温10min,最终用1mL 30%乙酸中止反应;② 标准空白管(Abr):5mL底物与2mL水及1mL 30%乙酸混匀后,于37℃保温10min,之后加2mL胰蛋白酶溶液,继续于37℃保温10min;③ 样品管(As):5mL底物与2mL豆浆稀释液混匀,于37℃保温10min,之后加入2mL胰蛋白酶溶液37℃保温10min,用1mL 30%乙酸中止反应;④ 样品空白管(Abs):5mL底物与2mL豆浆稀释液及1mL 30%乙酸混匀,于37℃保温10min,之后加入2mL胰蛋白酶溶液,继续于37℃保温10min;⑤ 反应后将标准管、标准空白管、样品管、样品空白管中溶液过滤后,在410nm下比色。调整胰蛋白酶浓度使标准管与标准空白管之间的吸光值之差在0.38~0.42。调整豆浆稀释倍数,使样品管和样品空白管吸光值之差在0.19~0.21。
活性的表示:定义每10mL反应体系在波长410nm处所减少的0.01吸光度值为1个胰蛋白酶抑制剂活性单位(TIU)。则胰蛋白酶抑制剂的活性计算如下:

式中:
TIU——胰蛋白酶抑制剂活性单位;
c——豆浆稀释倍数;
Ar——标准管吸光值;
Abr——标准空白管吸光值;
As——样品管吸光值;
Abs——样品空白管吸光值。
1.7 数据处理
试验得到的数据用SPSS 17.0统计软件中的方差分析(ANOVO)程序进行分析。用LSD检验判别数据之间的差异性,显著差异水平P<0.05。重复试验所得数据以均值±标准差表示。
2 结果与讨论
2.1 粉碎温度和煮浆时间对豆浆中γ-氨基丁酸的影响
不同粉碎温度对豆浆中γ-氨基丁酸含量的影响见图1。由图1可知,在50℃粉碎时,由于低温煮浆糊底,可能损失了部分GABA;而90℃粉碎时,由于豆浆体系在90℃以上高温维持了较长时间,可能由于美拉德反应造成了GABA损失[11];因此,在60~80℃对大豆进行粉碎得到了较高含量的GABA胚芽豆浆。很多研究[12-14]表明,豆谷类在浸泡和发芽过程中,GABA含量有所提升,这主要是由于大豆在发芽过程中内源酶被激活,L-谷氨酸在谷氨酸脱羧(GAD)的作用下产生GABA[15]。GABA在酸性条件下对热敏感,中性条件下耐热性较好,pH 7条件下,100℃加热15min仍有较好的稳定性[16]。

图1 粉碎温度对胚芽豆浆中GABA含量的影响Figure 1 Effect of pulverizing time on GABA content of germinated soybean milk
煮浆时间对豆浆中γ-氨基丁酸的影响见图2。由图2可知,煮浆时间2~6min对GABA含量影响不大,煮浆4min时 GABA含量最高,达1.37mg/100mL;4min之后 GABA含量呈下降趋势,加热8min时含量仅为1.26mg/100mL。
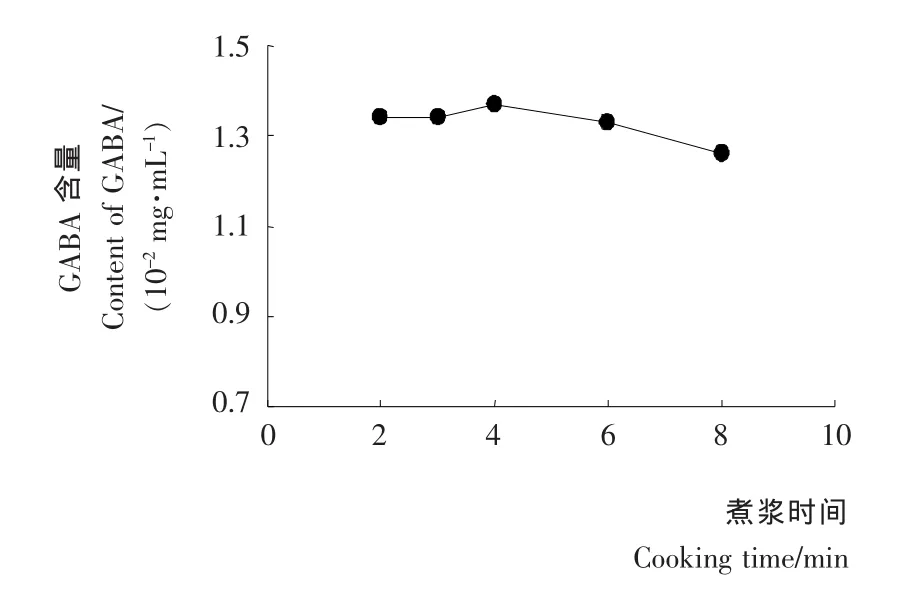
图2 煮浆时间对胚芽豆浆中GABA含量的影响Figure 2 Effect of cooking time on GABA content of germinated soybean milk
2.2 粉碎温度和煮浆时间对豆浆中游离氨基酸含量的影响
粉碎温度对豆浆中游离氨基酸的影响见表2。由表2可知,在胚芽豆浆游离氨基酸中,半胱氨酸和苏氨酸为主要氨基酸,分别占氨基酸总量的25.70%和26.55%。在70℃粉碎时总游离氨基酸含量最高,高于80℃后总氨基酸含量明显下降。除色氨酸外,其余7种必需氨基酸在低温粉碎(50,60,70℃)时含量较高,80,90℃之后下降较为明显,这可能是因为过高的粉碎温度会造成氨基酸的破坏,使其更易于与豆浆中的还原糖发生美拉德反应。
煮浆时间对豆浆中游离氨基酸的影响见表3。由表3可知,随煮浆时间延长,氨基酸含量略有增加,煮浆8min,总氨基酸含量最高,达0.505 5mg/mL;煮浆6min时,必需氨基酸含量最高,为0.248 5mg/mL。
2.3 粉碎温度和煮浆时间对豆浆中胰蛋白酶抑制剂含量的影响
胰蛋白酶抑制剂为豆浆中较难去除的抗营养因子,对豆浆的蛋白质利用率有较大影响。豆浆中胰蛋白酶抑制剂残留率降至10%~15%以下时可使豆浆中的蛋白得到最大利用[17]。
粉碎温度对豆浆中胰蛋白酶抑制剂含量的影响见图3。由图3可知,粉碎温度越高,豆浆中胰蛋白抑制剂含量越低。70℃及以上温度粉碎,豆浆中胰蛋白酶抑制剂含量明显减少,这主要由于高温粉碎使豆浆处于高温状态的时间较长,对胰蛋白酶抑制剂的灭活程度较高。高温粉碎类似于对豆种的热烫,使胰蛋白抑制剂在豆种细粉碎前得到了一定灭活[18],也减少了胰蛋白抑制剂后续煮浆阶段向浆液中的溶解。因此,高粉碎温度有利于减少豆浆中胰蛋白抑制剂的含量。

表2 粉碎温度对胚芽豆浆中游离氨基酸含量的影响Table 2 Effect of pulverizing temperature on free amino acid content of germinated soybean milk
煮浆时间对豆浆中胰蛋白酶抑制剂含量的影响见图4。由图4可知,煮浆时间越长,胰蛋白酶抑制剂含量越低。煮浆2~4min条件下,随煮浆时间延长,胰蛋白酶抑制剂活性降低较明显,煮浆4~8min条件下变化较为平稳,主要由于较易灭活的KSTI部分已灭活,而继续的短时加热对BBI部分影响不大。
在粉碎温度方面,60~80℃时粉碎可得到GABA含量较高的胚芽豆浆,但70~90℃时粉碎对胰蛋白抑制剂有较好的灭活作用,且70℃时胚芽豆浆有较高的氨基酸含量,在风味和豆浆机适用上均有一定优势,因此选择70℃作为最佳粉碎温度。在煮浆时间上,煮浆4min时GABA含量最高,且4min后胰蛋白抑制剂无明显下降,故选择4min为最佳煮浆时间。
2.4 胚芽豆浆与干豆豆浆相关指标的对比
采用上述程序所制得的胚芽豆浆中GABA含量为(1.37±0.20)mg/100mL,为干豆豆浆(0.37mg/100g±0.09 mg/100mL)的3.68倍。大豆在浸泡发芽过程中,种子吸胀,酶活性增加,L-谷氨酸在谷氨酸脱酸酶的作用下生成GABA。尤其在浸泡和发芽初期,GABA急剧增加[19]。此外,豆种在浸泡发芽过程中的质构变化,使其更容易破碎,更有利于各种营养物质向浆液中的溶出。

表3 煮浆时间对胚芽豆浆中游离氨基酸含量的影响Table 3 Effect of cooking time on free amino acid content of germinated soybean milk

图3 粉碎温度对胚芽豆浆中胰蛋白酶抑制剂含量的影响Figure 3 Effect of pulverizing time on TIA content of germinated soybean milk
胚芽豆浆和干豆豆浆中游离氨基酸含量见表4。由表4可知,胚芽豆浆在总游离氨基酸和必需氨基酸方面均有明显提高,分别为干豆豆浆的1.34倍和8.87倍。必需氨基酸中,苏氨酸和蛋氨酸含量明显提高,分别为干豆豆浆的31倍和21倍,缬氨酸、亮氨酸、苯丙氨酸、赖氨酸也有不同程度的提升。

图4 煮浆时间对胚芽豆浆中胰蛋白酶抑制剂含量的影响Figure 4 Effect of cooking time on TIA content of germinated soybean milk
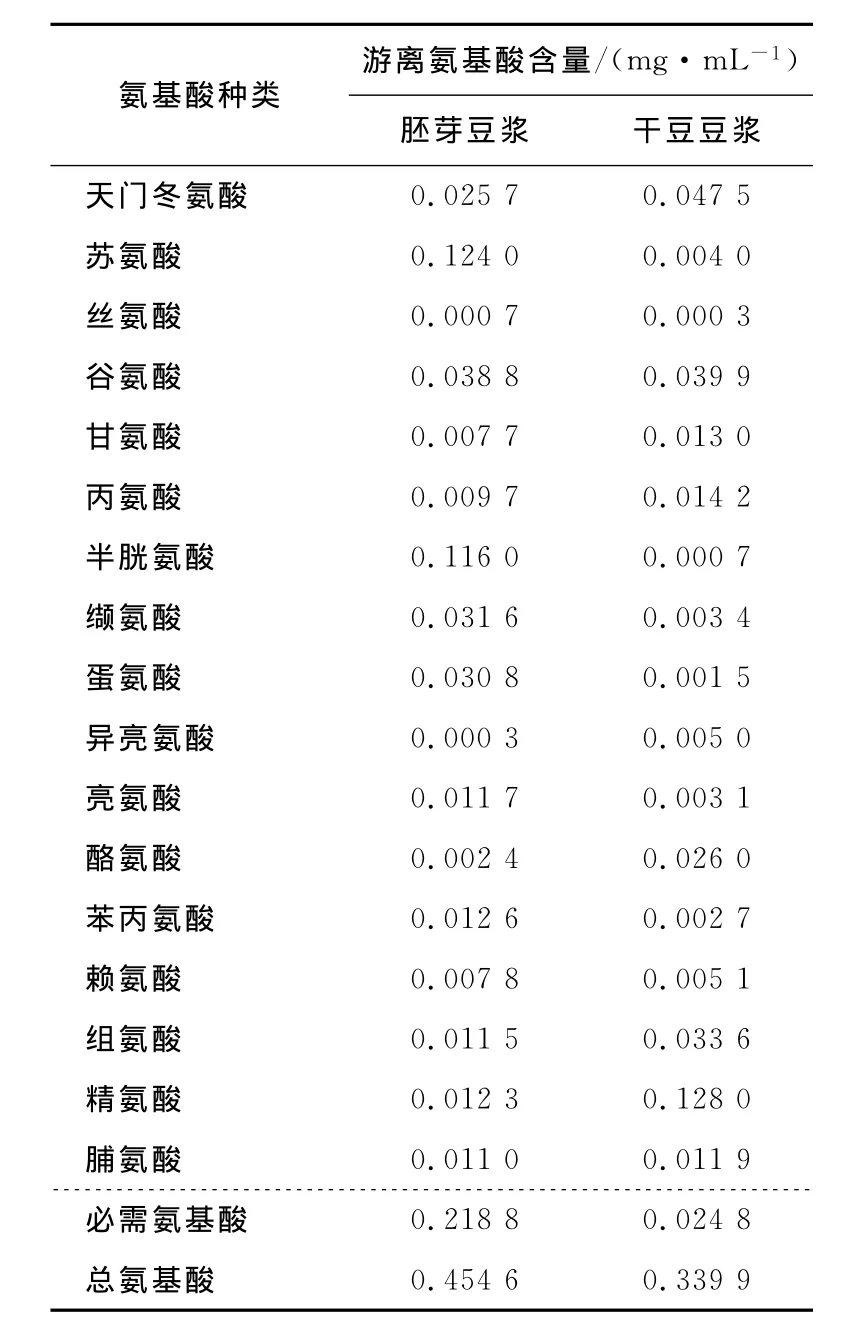
表4 胚芽豆浆和干豆豆浆中游离氨基酸含量对比Table 4 Free amino acid content of germinated soy milk and unsoaked soy milk
胚芽豆浆胰蛋白酶抑制剂活力为(938.00±28.28)TIU,相比于干豆豆浆的酶活(737.75±95.80)TIU略高。尽管在发芽过程中使胰蛋白酶抑制剂含量有所下降,但其质构在发芽过程中变软,更有利于蛋白质的溶出,因此也更易于胰蛋白酶抑制剂向豆浆中溶出。
3 结论
大豆在浸水发芽过程中,质构发生变化,理化性质、营养成分、抗营养因子均有一定改变。以氨基酸、GABA、胰蛋白酶抑制剂为优化目标,得到的胚芽豆浆最佳制浆工艺为:粉碎温度70℃,煮浆时间4min。与干豆豆浆相比,胚芽豆浆在胰蛋白酶抑制剂含量上略高,这可能是由于发芽导致豆种质构变得松软,易于粉碎,利于胰蛋白酶抑制剂溶出。但是,胚芽豆浆的氨基酸含量和GABA含量远远大于干豆豆浆。此外,胚芽豆浆在异黄酮、植酸、总酚方面也有较大优势[20]。因此,胚芽豆浆仍有较大的开发与应用空间。
1 Giri S K,Mangaraj S.Processing influences on composition and quality attributes of soymilk and its powder[J].Food Engineering Reviews,2012,4(3):149~164.
2 Bau H M,Villaume C,Nicolas J P,et al.Effect of germination on chemical composition,biochemical constituents and antinutritional factors of soya bean (Glycine max)seeds[J].Journal of the Science of Food and Agriculture,1997,73(1):1~9.
3 Ko C Y,Lin H T V,Tsai G J.Gamma-aminobutyric acid production in black soybean milk byLactobacillus brevisFPA 3709 and the antidepressant effect of the fermented product on a forced swimming rat model[J].Process Biochemistry,2013,48(4):559~568.
4 郝文静,张晓鸣,黄汉荣.发芽绿豆生物转化法富集γ-氨基丁酸[J].食品与机械,2012,28(5):34~38.
5 Erickson R H,Kim Y S.Digestion and absorption of dietary protein[J].Annual Review of Medicine,1990,41:133~139.
6 Collier K,Barber L,Lott J N A.A study of indigestible protein fractions of rice(Oryzasativa,L.)endosperm fed to mice(Musmusulus)and sheep(Ovismusimon):aqualitative and quantitative analysis[J].Journal of Cereal Science,1998(27):95~101.
7 龚婷,赵思明,熊善柏,等.蒸煮工艺对米饭蛋白质及氨基酸的影响[J].中国粮油学报,2008,23(4):14~17.
8 Dia V P,Gomez T,Vernaza G,et al.Bowman-birk and Kunitz protease inhibitors among antinutrients and bioactives modified by germination and hydrolysis in Brazilian soybean cultivar BRS 133[J].Journal of Agricultural and Food Chemistry,2012,60(32):7 886~7 894.
9 Osman M A,Reid P M,Weber C W.Thermal inactivation of tepary bean(Phaseolus acutifolius),soybean and lima bean protease inhibitors:effect of acidic and basic pH[J].Food Chemistry,2002,78(4):419~423.
10 王韧.超高压对大豆脂肪氧合酶、营养抑制因子和蛋白质的影响[D].无锡:江南大学,2008.
11 陈聪,赵建新,范大明,等.熟浆工艺豆浆煮浆和分离环节的研究[J].食品工业科技,2012,33(19):259~262.
12 Kim S L ,Lee J E,Kwon Y U,et al.Introduction and nutritional evaluation of germinated soy germ[J].Food Chemistry,2013,136(2):491~500.
13 Komatsuzaki N,Tsukahara K,Toyoshima H,et al.Effect of soaking and gaseous treatment on GABA content in germinated brown rice[J].Journal of Food Engineering,2007,78(2):556~560.
14 Li Y,Bai Q,Jin X,et al.Effects of cultivar and culture conditions onγ-aminobutyric acid accumulation in germinated fava beans(Vicia fabaL.)[J].Journal of the Science of Food and Agriculture,2010,90(1):52~57.
15 郭元新,杨润强,顾振新,等.采用生物转化技术富集大豆制品γ-氨基丁酸研究进展[J].食品与发酵工业,2011,37(11):154~157.
16 王向阳,仝义超,施青红,等.γ-氨基丁酸的检测方法和热杀菌稳定性研究[J].食品开发与研究,2009,30(4):13~16.
17 Rackis J J.Biological and physiological factors in soybeans[J].Journal of the American Oil Chemists Society,1974,51(1):163~164.
18 Yuan S,Chang S C,Liu Z,et al.Elimination of trypsin inhibitor activity and beany flavor in soy milk by consecutive blanching and ultrahigh-temperature(UHT)Processing[J].Journal of Agricultural and Food Chemistry,2008,56(17):7 957~7 963.
19 Matsuyama A,Yoshimura K,Shimizu C,et al.Characterization of glutamate decarboxylase mediatingγ-amino butyric acid increase in the early germination stage of soybean(Glycine max[L.]Merr.)[J].Journal of Bioscience and Bioengineering,2009,107(5):538~543.
20 Jiang S,Cai W,Xu B.Food quality improvement of soy milk made from short-time germinated soybeans[J].Foods,2013,2(2):198~212.

