萃取湿藻油脂及CO2切换溶剂的应用
杜 莹 , 常蓝天
(1.中国矿业大学 化工学院 煤炭加工与高效洁净利用教育部重点试验室 , 江苏 徐州 221116 ; 2.特文特大学 科学与技术学院 荷兰 7500 AE)
萃取湿藻油脂及CO2切换溶剂的应用
杜莹1,2, 常蓝天2
(1.中国矿业大学 化工学院 煤炭加工与高效洁净利用教育部重点试验室 , 江苏 徐州221116 ; 2.特文特大学 科学与技术学院 荷兰7500 AE)
藻类被认为是油脂提取的一种重要的可持续的原料来源,提取的油脂可用于生产食品、化妆品、药物和生物燃料。除去种植成本,这一过程尤其受萃取前干燥微藻和之后溶剂回收的能量消耗所限制。本文综述了传统的从微藻(特别是湿藻)中萃取油脂的技术(有机溶剂萃取和超临界二氧化碳萃取)以及CO2切换溶剂的研究进展,并指出了CO2切换溶剂在藻类油脂萃取中的应用前景。
微藻 ; 萃取 ; 超临界CO2; 切换溶剂 ; 油脂
0 引言
随着人类社会的发展,化石燃料已经成为人们日常生活中不可或缺的一部分,然而这种能源不可再生,在未来的几十年中面临着枯竭的危机。因此寻找新的可持续的能源代替化石燃料已成为人类至关重要的使命。近几十年世界各国都在加强对于可持续能源的开发利用。Lam和Lee[1]通过研究预测,在不久的将来,生物燃料作为一种可再生的替代能源将在世界能源结构中起到更加关键的作用。在众多生物燃料中,生物柴油目前被公认为是一种很有前途的柴油替代物,它具有能显著减少温室气体排放、不需改动柴油发动机可直接添加使用等优点[2-3]。
生物燃料的来源广泛,目前主要包括玉米、大豆、亚麻籽、油菜籽、稻草、秸秆等,和以上生物质相比,微藻作为生物能源原料具有显著的优势。这些优势主要表现在:①藻类单位面积产量高,繁殖速度快,是陆地植物生长速度的100倍以上,一天内就可以使种群数量翻倍[4];②藻类可以在淡水、海水、中水甚至废水中培养,可以充分利用盐碱地等不适于传统农作物生长的恶劣环境进行培养,不占用耕地,
从而减少了和传统农业对资源的竞争[5-6];③藻类可以耐受高浓度CO2环境,可以快速吸收发电厂及其他工业中排放的CO2,有利于CO2固定[7];④藻类养殖不需要除草剂、杀虫剂等[8];⑤藻类中的油脂含量可以通过优化生长条件而大幅提高,比如一些微藻在营养限制条件下油脂含量可达到30%~70%[8]。
从藻到燃料要经过若干步骤,如藻类培养、收获、脱水、萃取、转化、副产物的开发处理等。要想使藻油成为高效节能、经济上可行并能广泛应用的新能源,尚需在技术方面进行大量研究。比如,目前大部分从藻中萃取油脂的技术,都要经历藻采收、干燥、破碎、萃取这些过程,而藻类脱水是油脂萃取过程中最耗能的一步。尽管利用太阳能进行干燥也并非不可能,但这种方法完全依赖于阳光。在Sander和Murthy的研究中,从藻到油这一过程总能量消耗的69%都被用于藻的干燥[9]。因此,选用湿藻直接萃取可以避免藻类干燥的高能耗处理步骤,为实现微藻制油工业化提供新的参考方法。本文将对传统从湿藻中萃取油脂的技术以及CO2切换溶剂在藻类油脂萃取中的应用做简单综述。
1 传统湿法萃取技术
理想情况下,以生产生物柴油为目的的油脂萃取技术要求油脂有高度的特异性,尽量减少非油脂类污染物的共萃取,如蛋白质、碳水化合物等。为了减少下游的分离、纯化,油脂萃取技术也应该对甘油酯有更高的选择性,而不是其他不容易转化为生物柴油的脂类,如极性脂和非甘油酯的中性脂(游离脂肪酸、烃类、甾醇类、酮类、胡萝卜素和叶绿素)。此外,选择的萃取技术要高效节能,不与脂类发生反应,价格相对便宜,并且要安全。由于藻类脱水是一个高能耗的过程,如果所选择的技术可以直接从湿藻萃取油脂,将在经济上有很大的竞争力。常用的油脂萃取技术包括有机溶剂萃取和超临界二氧化碳萃取。
1.1有机溶剂萃取
有机溶剂从藻类中萃取油脂依据的是“相似相容”原理。有很多混合溶液均被报道可以从藻中萃取油脂,比如甲醇/氯仿、正己烷/异丙醇、正己烷/乙醇、二氯甲烷/乙醇,等等。此外也有学者尝试用一些纯溶液如1-丁醇、乙醇、己烷等从藻中萃取油脂。
有机溶剂萃取被广泛应用,因为化学试剂相对便宜,而且油脂萃取产率较高。Lee等[10]对五种不同有机溶剂从破碎的Botryococcus braunii浓缩藻液中萃取油脂的能力进行了比较研究。研究结果表明,氯仿∶甲醇为2∶1(体积比)时的萃取效率最高,总脂产量占藻干质量的28.6%。值得注意的是,这种方法不需要将藻完全干燥,在这一体系中,藻细胞中残留的水作为三元组分之一使中性脂和极性脂得到了完全萃取。在除去藻细胞之后,更多的氯仿和甲醇被加入到体系中,以促进两相分离。下层有机相(氯仿)包含了大部分的脂质(包括中性脂和极性脂),而上层水相(水和甲醇)包含了大部分的非脂类(蛋白质和碳水化合物)。有机溶剂萃取虽然速度快、萃取率高,但所用溶剂有毒、易燃,而且溶剂回收能耗高[11],所以这种方法并不十分可取。
1.2超临界CO2萃取
近年来,利用超临界流体进行萃取的方法引起越来越多人的关注。很多种超临界流体都被研究用于从藻中萃取油脂,如CO2、甲醇、乙醇和水[12-15]。由于超临界CO2具有无毒性、不易燃、相对化学惰性以及生产的粗油无溶剂等特点,被认为是油脂萃取一个重要的替代方法。选择CO2还因为它的低临界温度(31.2 ℃)可以防止产物的热降解,适度的临界压力(7.29 MPa)在一定程度上压缩了设备成本[16]。
近几十年,不断有学者对利用超临界CO2从藻中萃取油脂用于生产生物柴油进行研究。一项研究显示,超临界CO2可以在40 ℃和55 ℃,35 MPa条件下从干藻Chlorella vuluaris中萃取油脂,油脂产率随压强增大而增加[17]。Couto等[18]发现由于超临界CO2从C cohnii萃取出的油脂中DHA含量很高,这可以用于以制药为目的的高附加值产品萃取。但是超临界CO2的萃取产率还不到B&D方法萃取产率的三分之一,这表明超临界CO2萃取的选择性更强。Cheng等[19]研究了有机溶剂和超临界CO2对Pavlova sp.的萃取效率,尽管有机溶剂比超临界CO2萃取出更多的粗脂,但超临界CO2萃取的脂肪酸甲酯(FAME)产量更高,这表明有机溶剂萃取了较多的杂质。由于FAME是生物柴油的主要成分,所以以FAME萃取产率作为评价指标比粗脂产率更准确。
以上提到的研究都是以冻干藻或干燥的藻粉为初始原料,除此之外,还有一些学者研究了超临界CO2对湿藻的萃取。Soh和Zimmerman[20]通过在冻干的微藻Scenedesmus dimorphus中加入不同量的水,研究了藻含水量对萃取效率的影响。结果显示超临界CO2可以对湿藻进行萃取,萃取的FAME总量和成分都没有改变。Halim[21]对超临界CO2萃取Chlorococcum sp藻泥(占干质量的30%,质量百分比)的表现进行了研究,在温度60 ℃压强30 MPa时油脂产率最大(占藻干质量的7.1%,质量百分比)。其中一个值得注意的重要问题就是用湿藻萃取的产率比用干藻粉萃取产率还要高(占藻干质量的5.8%,质量百分比),这说明利用超临界CO2进行萃取,可以减少在藻干燥这一步骤的能量消耗。水作为极性共溶剂提高了萃取效率,同时也因为水对细胞基质具有溶胀作用。超临界CO2萃取虽然耗时短、使用溶剂无毒、不易燃,被认为是一种绿色方法,引起了众多研究者的兴趣,但由于其运营成本高,而且需要使用高压设备,很难实现规模化生产[22]。
2 CO2切换溶剂萃取
2005年Philip G Jessop及其同事首次报道了“切换溶剂”[23]。切换溶剂是一种可以在物理性质不同的两种形式间进行转化的液体,这些物理性质可能是导电性、极性、溶解性或黏度。作为反应、萃取或分离过程的一种介质,切换溶剂比传统的溶剂有更多优势。比如在一个多步的化学过程中,往往每一个步骤都需要一个特定的最佳活性溶剂,因此,每一步都必须用一种新的溶剂,并且在进行下一步之前必须彻底清除,这会增加整个过程的生产成本和环境废物[24]。切换溶剂是一种可以通过改变性质而用于若干连续工艺步骤的溶剂。将切换溶剂应用于从藻浓缩液中萃取油脂时,首先利用切换溶剂对非极性物质的高亲和力从藻中萃取出油脂,之后通入CO2使切换溶剂极性升高,从而实现油脂和切换溶剂的分离,通过加热或通入N2再将切换溶剂极性降低以便重复利用。
目前,已有报道的切换溶剂有很多种,如醇/脒(胍)混合物、胺/脒(胍)混合物、脒、亚胺、叔胺等,本文将着重讨论应用于从藻中萃取油脂的切换溶剂。Jessop等[23]首次报道的切换溶剂是由醇和脒(DBU,1,8-diazabicyclo-[5.4.0]-undec-7-ene)组成的等物质的量混合物,其反应机理如图1所示。
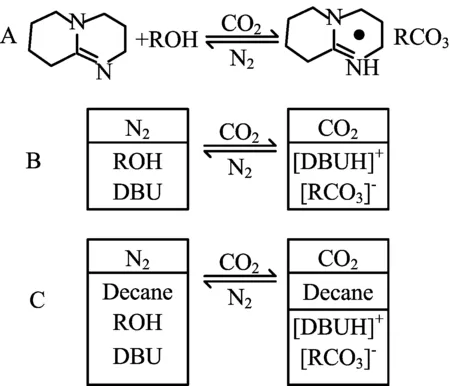
图1 醇/脒混合物的切换机理
A:在醇和CO2存在条件下DBU发生质子化反应,去除CO2时,反应逆向进行。B:A中所示反应的极性变化,通入CO21 h后己醇/DBU混合溶液由非极性(蓝色)变为极性(红色),通过通入氮气去除溶液中的CO2使反应逆向进行。C:在N2和CO2环境下由癸烷在溶液中溶解性的变化显示出己醇/DBU混合溶液极性的变化,通入CO2后溶液极性升高,癸烷析出,通入氮气后反应逆向进行。
常温、常压下向己醇/DBU等物质的量的混合物中通入CO2会使其转换为离子液体(如图1 A所示),极性、黏度、溶解性和导电性都发生了显著改变。逆反应可以通过在常温下向溶液中通入氮气或氩气来实现,升温至50 ℃可以加速反应。通过检测非极性物质癸烷在己醇/DBU混合溶液中的溶解性,证明了溶液极性的变化(如图1 C所示)。
该反应会导致液体的黏度显著增加,因此醇的选择是至关重要的。在室温下将CO2通入DBU和乙醇、甲醇和水的等物质的量混合物会生成固体的DBU烷基酯盐,但是碳链稍长些的DBU盐在室温下是液体,因此可以适用于萃取过程。切换溶剂的极性也在很大程度上取决于碳链的长度。选用碳链较短的醇会使切换溶剂极性和非极性状态下的极性差异更大[24]。
研究证明切换溶剂可以简化某些化学反应和分离的过程。在Phan等[24]的研究中已经实现了在不加入其它溶剂纯化分离化合物的情况下苯乙烯聚合反应的多次循环。Samorì等[25]通过研究发现,不管对干藻还是藻液进行萃取,DBU/辛醇体系都比传统溶剂具有更好的萃取效率。在60 ℃用DBU/辛醇等物质的量的混合物萃取冻干的藻4 h得到的结果最好(总烃产率16%±2%)。他们还在室温下对藻液(藻干质量0.8 g /L)进行了萃取,DBU/辛醇等物质的量混合物300 r/min萃取24 h后得到的烃产率为8.2%±1%。虽然这些切换溶剂可以从藻中萃取油脂,并且不需要用蒸馏的方法来回收,但是在萃取之前切换溶剂和藻都必须进行严格的干燥,以防止生成不需要的DBU碳酸氢盐。
叔胺被认为是另一种类型的切换溶剂,比之前提到的脒/醇混合溶液更容易制备和购买。叔胺在常态下是一种与水互溶性很低的疏水性溶液,但在常压CO2条件下又完全与水互溶。CO2与水和叔胺发生化学反应生成了叔胺的水溶性碳酸氢盐。反应如下所示[26]。
向体积比1∶1的水和叔胺溶液中通入CO2,一段时间后两相变为一相,向[NR3H+][O2COH-]/水的混合物中通入氮气、氩气或空气,混合溶液又分为两相。这一相分离过程也可以通过加热单相混合物来实现,而不需要通入气体。
有报道显示,叔胺N,N-二甲基环己胺(DMCHA)可以被用于从藻中萃取油脂。Jessop等[27]的实验选用了冻干的Botryococcus braunii和DMCHA进行萃取,在60 ℃或80 ℃时用DMCHA 萃取,从中分离的粗脂可达细胞干质量的22%(质量百分比),萃取物中残余胺的含量在18%~24%(质量百分比)。在室温下萃取,粗脂产率可达到19%,萃取物中残余胺的含量在4%~8 %。Samorì等[28]用DMCHA直接从三种藻( Nannochloropsis gaditana、Tetraselmis suecica和Desmodesmus communis)的浓缩液(含水量约为80%)和普通培养液(藻含量约为2 g/L)中萃取油脂。他们的萃取系统首次实现了从未经细胞破碎处理的稀藻液中萃取油脂,避免了使用挥发性有机溶剂及其在油脂回收蒸发过程中的能源消耗。DMCHA萃取Nannochloropsis gaditana、Tetraselmis suecica和Desmodesmus communis浓缩液24 h,得到的油脂产率分别为29.2%±0.9%,57.9%±1.3%和31.9%±1.5%。
除叔胺之外,亚胺也是一种切换溶剂,比脒价格便宜,常态下极性更低,而且不像DBU/醇混合溶液对水那样敏感。亚胺与CO2反应生成氨基甲酸,进一步反应生成氨基甲酸酯盐,反应如下所示[29]。
对亚胺切换溶剂来讲,氨基甲酸酯盐和胺都必须是液体,并且在通入CO2前后极性变化明显。比如伯胺生成的盐是固体,就不能用于切换溶剂。一些相对分子质量较低的亚胺,如乙基甲基胺、二乙胺和甲基丙胺,虽然它们可以生成液态盐,但由于这些胺太易挥发而且高度易燃,不适合作为切换溶剂使用。有报道指出[29]以下四种亚胺可以被用作切换溶剂,分别是N-乙基正丁胺、N-乙基-N-正丙胺、二丙胺和苄基甲胺。在Du等[30]的研究中利用N-乙基正丁胺和二丙胺为切换溶剂从微藻Desmodesmus sp的浓缩液中萃取油脂,所得油脂产量与有机溶剂Bligh & Dyer萃取的油脂产量相当。由此证明,用切换溶剂从微藻浓缩液中萃取油脂的方法切实可行。
3 总结
微藻作为生物能源的原料,在生产化石燃料替代能源的产业中具有重要的地位。从微藻浓缩液中萃取油脂可以大大减少干燥过程的能源消耗。传统的有机溶剂萃取虽然速度快、效率高,但所用溶剂有毒、易燃,而且溶剂回收能耗高;超临界二氧化碳萃取虽被认为是一种绿色方法,但运营成本高,这两种方法各有弊端,都很难实现规模化生产。将切换溶剂应用于微藻油脂萃取,为这一过程提供了新的思路,不仅微藻不再需要干燥,而且可以通过改变溶剂性质实现和油脂的分离,降低了整个过程的能耗。
[1]Lam M K,Lee K T.Microalgae biofuels:a critical review of issues, problems and the way forward[J].Biotechnology Advances,2012,30(3):673-690.
[2]Tica S,et al.Test run of biodiesel in public transport system in Belgrade[J].Energy Policy,2010,38(11):7014-7020.
[3]Nanaki E A,Koroneos C J.Comparative LCA of the use of biodiesel,diesel and gasoline for transportation[J].Journal of Cleaner Production,2012,20(1):14-19.
[4]Chisti Y.Biodiesel from microalgae[J].Biotechnology Advances,2007,25(3):294-306.
[5]Mulbry W,Kondrad S,Pizarro C,et al.Treatment of dairy manure effluent using freshwater algae:algal productivity and recovery of manure nutrients using pilot-scale algal turf scrubbers[J].Bioresource Technology,2008,99(17):8137-8142.
[6]Godos I d,Blanco S,Garcia-encina P A,et al.Long-term operation of high rate algal ponds for the bioremediation of piggery wastewaters at high loading rates[J].Bioresource Technology,2009,100(19):4332-4339.
[7]Packer M.Algal capture of carbon dioxide; biomass generation as a tool for greenhouse gas mitigation with reference to New Zealand energy strategy and policy[J].Energy Policy,2009,37(9):3428-3437.
[8]Rodolfi L,Zittelli G C,Bassi N,et al.Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J].Biotechnology and Bioengineering,2009,102(1):100-112.
[9]Sander K,Murthy G S.Life cycle analysis of algae biodiesel[J].International Journal of Life Cycle Assessment,2010,15(7):704-714.
[10]Lee S J,Yoon B D,Oh H M.Rapid method for the determination of lipid from the green alga Botryococcus braunii[J].Biotechnology Techniques,1998,12(7):553-556.
[11]Greenwell H C,Laurens L M L,Shields R J,et al.Placing microalgae on the biofuels priority list: A review of the technological challenges[J].Journal of the Royal Society Interface,2010,7(46):703-726.
[12]Guan Q, Savage P E,Wei C.Gasification of alga Nannochloropsis sp. in supercritical water[J].The Journal of Supercritical Fluids,2012,61(0):139-145.
[13]Patil P D,Gude V G,Mannarswamy A,et al.Comparison of direct transesterification of algal biomass under supercritical methanol and microwave irradiation conditions[J].Fuel,2012,97(0):822-831.
[14]Santana A,Jesus S,Larrayoz M A,et al.Supercritical carbon dioxide extraction of algal lipids for the biodiesel production[J].Procedia Engineering,2012,42(0):1755-1761.
[15]Patil P D,Reddy H,Muppaneni T,et al.Microwave-mediated non-catalytic transesterification of algal biomass under supercritical ethanol conditions[J].The Journal of Supercritical Fluids,2013,79(0):67-72.
[16]Herrero M,Cifuentes A,Lbaez E.Sub- and supercritical fluid extraction of functional ingredients from different natural sources:plants,food-by-products,algae and microalgae-a review[J].Food Chemistry,2006,98(1):136-148.
[17]Mendes R L,Fernandes H L,Coelho J,et al.Supercritical CO2extraction of carotenoids and other lipids from Chlorella vulgaris[J].Food Chemistry,1995,53(1):99-103.
[18]Couto R M,Simões P C,Reis A,et al.Supercritical fluid extraction of lipids from the heterotrophic microalga Crypthecodinium cohnii[J].Engineering in Life Sciences,2010,10(2):158-164.
[19]Cheng C H,Du T B,Pi H C,et al.Comparative study of lipid extraction from microalgae by organic solvent and supercritical CO2[J].Bioresource Technology,2011,102(21):10151-10153.
[20]Soh L,Zimmerman J.Biodiesel production: The potential of algal lipids extracted with supercritical carbon dioxide[J].Green Chemistry,2011,13(6):1422-1429.
[21]Halim R,Glodman B,Danquah M K,et al.Oil extraction from microalgae for biodiesel production[J].Bioresource Technology,2011,102(1):178-185.
[22]Pawliszyn J.Kinetic model of supercritical fluid extraction[J].Journal of Chromatographic Science,1993,31(1):31-37.
[23]Jessop P G,Heldebrant D J,Li x,et al.Green chemistry:reversible nonpolar-to-polar solvent[J]. Nature,2005,436(7054):1102.
[24]Phan L,Chiu D,heldebrant D T,et al.Switchable solvents consisting of amidine/alcohol or guanidine/alcohol mixtures[J].Industrial and Engineering Chemistry Research,2008,47(3):539-545.
[25]SamorìC,Torri C,Samori G,et al.Xtraction of hydrocarbons from microalga Botryococcus braunii with switchable solvents[J].Bioresource Technology,2010,101(9):3274-3279.
[26]Jessop P G.Tertiary amine solvents having switchable hydrophilicity[J].Green Chemistry,2011,13(3):619-623.
[27]Boyd A R,Champagne P,Mcginn P J,et al.Switchable hydrophilicity solvents for lipid extraction from microalgae for biofuel production[J].Bioresource Technology,2012,118:628-632.
[28]Samorì C,Lopez Barreiro D,Vet R,et al.Effective lipid extraction from algae cultures using switchable solvents[J].Green Chemistry,2013,15(2):353-356.
[29]Phan L,Andreatta J R,Horvey L K,et al.Switchable-polarity solvents prepared with a single liquid component[J].Journal of Organic Chemistry,2008,73(1):127-132.
[30]Du Y,Schuur B,Samori C,et al.Secondary amines as switchable solvents for lipid extraction from non-broken microalgae[J].Bioresource Technology,2013,149:253-260.
Lipid Extraction from Wet Algae and The Application of CO2Switchable Solvent
DU Ying1,2, CHANG Lantian2
(1.School of Chemical Engineering and Technology, Key laboratory of Coal Processing and Efficient Utilization of Ministry of Education , China University of Mining & Technology, Xuzhou221116 , China ; 2.Science and Technology , University of Twente , Enschede7500 AE , Netherlands)
Algae be considered as an important sustainable feedstock for lipid extraction to produce food, cosmetics, pharmaceutical products and advanced biofuels. Apart from the costs for cultivation, this process is especially hindered by the energy consumption of drying algae prior to extraction and solvent recovery afterwards. In this work, the traditional lipid extraction method (organic solvent extraction and supercritical CO2extraction) and the newly developed CO2switchable solvents are reviewed. The potential applications of the switchable solvent in the lipid extraction from algae are discussed as well.
microalgae ; extraction ; supercritical CO2; switchable solvent ; lipid
TQ203
A
1003-3467(2015)03-0016-05
2014-12-16
杜莹(1986-),女,博士研究生,从事切换溶剂萃取微藻油脂的研究,E-mail:y.du@utwente.nl。

