山核桃内生真菌对山核桃干腐病抑制作用初步研究
朱诚棋,周 乐,苏 秀
山核桃内生真菌对山核桃干腐病抑制作用初步研究
朱诚棋,周 乐,苏 秀*
(浙江农林大学林业与生物技术学院,浙江 临安,311300)
采用PDA培养基分离了不同感病等级山核桃(Carya cathayensis)树组织中的内生真菌,共得到28种内生真菌,用两点对峙法测定这28种内生真菌对山核桃干腐病(Canker disease of Carya cathayensis)的生长抑制作用。结果表明:有3株内生真菌(编号分别为X-5、X-7和H-3)对山核桃干腐病有明显抑制作用;在对峙培养的72 h内,X-5对山核桃干腐病的抑制作用分别为45.32%、34.98%、28.61%,X-7抑制作用分别为10.73%、23.03%、12.01%,H-3抑制作用分别为49.72%、44.30%、32.03%;其余内生真菌对山核桃干腐病均无抑制作用或在对峙培养的后期出现比较弱的抑制作用。
山核桃干腐病;内生真菌;生物防治
山核桃(Carya cathayensis)为胡桃科(Juglandaceae)山核桃属(Carya)落叶乔木,主要分布在浙、皖交界的天目山区、昌北区,为我国特有的著名干果和木本油料树种,是集生态和经济效益为一体的生态经济树种[1]。近年来,山核桃干腐病发生非常严重,在主产区临安、淳安、桐庐、宁国,株发病率高达80%~100%,病株上少则几个病斑,多则几十个病斑,最严重的可达数百个病斑,造成枝枯或株枯,严重影响了山核桃林生长发育和山核桃品质[2]。目前,山核桃干腐病的防治主要采用化学农药喷洒法和物理刮除病斑法[3~5]。直接刮除病斑会人为造成树体新的伤口,易再度引发病菌侵入,且防治效果不持久,生产上不提倡使用;适当的化学防治对于控制山核桃干腐病非常必要[6~8],但是从长远考虑,山核桃是一种高档干果,对食品安全性要求很高,应选择生物防治的方法。利用植物内生菌及其代谢产物防治病虫害是生物防治的一个重要方向,是目前研究的热点之一[9],但山核桃内生真菌资源及其生物防治作用尚未见研究报道。本文初步研究了山核桃内生真菌对山核桃干腐病的抑制作用,为山核桃干腐病的生物防治方法提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验样地自然概况 山核桃组织样品采自浙江省临安市横路镇和安徽省宁国市仙霞镇。
横路样地GPS定位:30° 20′ 02.3″ N,119° 18′ 16.5″ E,精度3 m,海拔256 m,坡度45°,坡向东南,周围环境为纯林,有少量松树、竹子并有红薯间作,树龄为15~20 a。
仙霞样地GPS定位:30° 24′ 48.7″ N,119° 16′ 29.9″ E,精度4 m,海拔175 m,坡度40°,坡向西,周围环境为纯林,周围有毛竹、雷竹,树龄为25~30 a。
1.1.2 试验材料与仪器 山核桃干腐病病原菌茶藨子葡萄座腔菌(Botryosphaeria dothidea)由浙江农林大学森林保护学科实验室提供[10]。山核桃树干和枝条组织采自以上两个样地,采集时间是2012年4月12日上午。试验试剂主要有5%的NaClO溶液、75%的乙醇溶液等。仪器主要有三洋超净工作台MCV-B131F(T)、三洋全自动高压蒸汽灭菌锅MLS-3750、MfⅡ全自动菌落计数仪、电子天平BS-224S、电热恒温水浴锅、生化培养箱等。
1.2 试验方法
1.2.1 样品采集 在每个样地用无菌剪刀和刮皮刀分别采集健康的枝条、树干(树皮),感病的枝条、树干(树皮)和感病严重的枝条若干,分别装入灭菌纸袋内并进行编号。感病等级根据树干或枝条上的病斑数量判断,病斑数量≤10个,且树木长势正常的为“感病”的;病斑数≥15,树木长势弱的为“感病严重”的。
1.2.2 内生真菌的分离
1.2.2.1 山核桃枝条内生真菌的分离方法 将山核桃枝段组织切成段,混合后随机取10支,先用清水洗净,然后将枝段切成长1.0~1.5 cm的短段,再进行表面消毒:用5%次氯酸钠液处理5 min,无菌水冲洗,75%酒精处理2 min,无菌水冲洗,无菌吸水纸吸干,75%酒精处理1 min,无菌水冲洗3~5次,最后用无菌吸水纸吸去表面水,取最后1次无菌水洗液涂于三块平板上培养,在恒温培养箱中25℃培养3~4d,观察有无菌落产生,若发现皿中无菌落生成,则证明该材料表面消毒彻底,否则,不能使用。随机选取组织块接入PDA平板培养基上,每皿接3块,每样接3皿,将培养皿放在28℃恒温箱内培养。依据菌落形态特征,依据参考文献[10]进行鉴定。
1.2.2.2 山核桃树干(树皮)内生真菌的分离方法 将山核桃树干组织切成块,混合后随机取10块,先用清水洗净,然后将树干组织分割为0.5 cm×0.5 cm的组织块。表面消毒方法同上,将消毒后的干皮组织纵剖为4~6份,随机选取接入PDA平板培养基上,每皿接3块,每样接3皿,将培养皿放在28℃恒温箱内培养。依据菌落形态特征,依据参考文献[10]进行鉴定。
1.2.3 山核桃内生真菌对山核桃干腐病的抑制作用 采用对峙培养法研究山核桃内生真菌与干腐病之间的相互关系。选取几种优势内生真菌活化培养5 d后,取直径为0.5 cm内生真菌和山核桃干腐病病原菌的菌丝块接种于PDA平板上距中心2 cm处同一直线的两点上,同时设接种病原菌为对照,每处理3个重复,于25℃恒温培养,逐日观察抑菌作用。病原菌与拮抗菌落相交之后,观察记录拮抗菌对病原菌的包围、抑制、寄生及侵入病菌菌落,占领其营养空间的过程,挑取相交界面处的菌丝镜检观察,并且每日用MfⅡ全自动菌落计数仪测量内生真菌的菌落直径、病原菌的菌落直径以及只接病原菌的对照直径比较。按以下公式计算病菌的生长抑制率。

2 结果与分析
2.1 内生真菌分离结果
在实验过程中,前期对各个样品进行了内生真菌的分离及培养,其中仙霞样品分离出了13种内生真菌,横路样品分离出了15种内生真菌。从两地分离到的内生真菌编号如表1。
从表1可以看出,山核桃内生真菌的种类在感病与不感病植株以及同一植株的不同部位呈现一定的差异性,感病树干(枝条)上的内生真菌数相对要高一些;横路采集到的样品中内生真菌数量比仙霞样品稍多。

表1 仙霞和横路样地分离到的内生真菌Table 1 Fungal endophytes isolated from hickory collected in Zhejiang and Anhui
2.2 两点对峙培养结果
采用两点对峙法测定了上述内生真菌对山核桃干腐病的生长抑制作用。其中,仙霞样品中X-1、X-2、X-4、X-6、X-8、X-10这6种内生真菌以及横路样品中H-1、H-2、H-7、H-9这4种内生真菌在对峙实验中明显比山核桃干腐病病原菌生长慢,对病原菌无抑制作用,故不予进行下一步实验及分析。其余内生真菌的对峙培养中,山核桃干腐病病原菌的生长情况见表2。

表2 对峙培养中山核桃干腐病病原菌直径Table 2 Diameter of B. dothidea during face-to-face culture
由表2可知,仙霞样品中X-5、X-7在72 h内均对山核桃干腐病病原菌有抑制作用;横路样品中H-3在72 h内对山核桃干腐病有明显抑制作用,而H-6、H-10、H-11的生长速度与山核桃干腐病差不多,其余内生真菌对山核桃干腐病均无抑制作用。
2.3 内生真菌对山核桃干腐病菌的生长抑制作用
病菌生长抑制率,见表3。
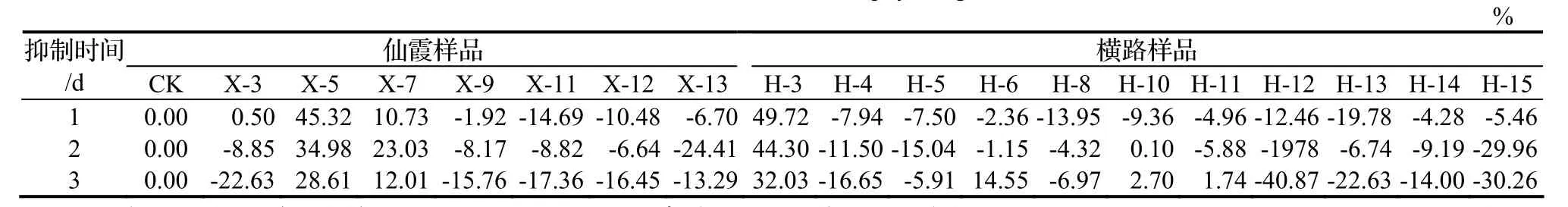
表3 内生真菌山核桃干腐病病菌的生长抑制效果Table 4 Inhibitive effect of isolated endophytes agaist B. dothidea
由表3可知,仙霞样品中X-5对山核桃干腐病的抑制作用分别为45.32%、34.98%、28.61%,X-7对山核桃干腐病的抑制作用分别为10.73%、23.03%、12.01%;横路样品中H-3对山核桃干腐病的抑制作用分别为49.72%、44.30%、32.03%,H-10、H-6、H-11在对峙培养的后期出现比较弱的抑制作用。
3 讨论
本研究对山核桃主产地临安和宁国的两个山核桃干腐病高发区不同感病等级的山核桃树组织中内生真菌进行分离,研究发现,感病山核桃枝条、树干的内生真菌种类略大于健康山核桃植株中的内生真菌数量。但这一结果可能具有随机性,因为本试验在山核桃内生真菌的分离过程中,仅采用了一种PDA培养基去分离培养山核桃内生真菌,这就导致不能在 PDA培养基上很好的真菌无法分离到;同时,5%次氯酸钠液处理材料时间的长短以及温度,湿度等都有可能影响内生真菌的分离率。因此,多季节、多地点、多植株采样、多种方式纯化分离有助于得到更多抑制作用明显的山核桃内生真菌。
本研究采用两点对峙法测定了山核桃内生真菌对山核桃干腐病的生长抑制作用,发现有3种内生真菌对山核桃干腐病有明显抑制作用。这是首次报道山核桃内生真菌资源及其生物防治作用,为探索山核桃干腐病的生物防治方法提供了理论依据。这3种内生真菌具体的分类地位、对山核桃干腐病起抑制作用的活性物质及抑制作用机理有待进一步研究。
[1] 宋朝枢. 自然保护区工作手册[M]. 北京:中国林业出版社,1988. 41-43.
[2] 张璐璐,贾桂民,叶建丰,等. 浙江临安山核桃干腐病发生发展规律[J]. 浙江农林大学学报,2013,30(1):148-152
[3] 王丽臻,陈继红,楼君芳,等. 山核桃干腐病防治试验[J]. 浙江林业科技,2008,28(4):51-53.
[4] 任安芝,高玉葆. 植物内生真菌——一类应用前景广阔的资源微生物[J]. 微生物学通报,2001,28(6):90-93.
[5] CARROLG. Fungal endophytes in stems and leaves: from latent pathogen to mutualistic symbiont[J]. Ecology,1998(69):2-9.
[6] 戴胜利. 山核桃枝枯原因及防治[J]. 安徽林业,2004(2):23.
[7] 杨淑贞,丁立忠,楼君芳,等. 山核桃干腐病发生发展规律及防治技术[J]. 浙江林学院学报,2009,26(2):228-232.
[8] 张传清,徐志宏,孙品雷,等. 基于侵染特性的山核桃干腐病防治技术[J]. 中国森林病虫,2011,30(3):43-46.
[9] 李明. 植物内生真菌[J]. 生物学教学,2003,28(5):1-3.
[10] 王璇,马良进,吕全,等. 山核桃干腐病病原菌的鉴定[J]. 浙江农林大学学报,2014,31(2):238-245.
Preliminary Research on Fungal endophytes Inhibition of Canker Disease of Carya cathayensis
ZHU Cheng-qi,ZHOU Le,SU Xiu*
(School of Forestry & Biotechnolog, Zhejiang A & F University, Lin’an 311300, China)
PDA medium was used for isolating fungal endophytes from different diseased organs of hickory (Carya cathayensis) collected from Lin’an of Zhejiang and Ningguo of Anhui province on April 12, 2014. Total of 28 strains fungal endophytes were isolated. Determinations of inhibition of isolated endophytes against canker disease (Botryosphaeria dothidea) were conducted by face-to-face culturing on PDA medium. The result demonstrated that 3 strains of endophytes (numbered X-5, X-7 and H-3) had significant inhibition effect against B. dothidea. In the first three days of culturing, the inhibition rate of X-5 was 45.32%, 34.98%, 28.61% per day, that of X-7 was 10.73%, 23.03%, 12.01% per day, and that of H-3 was 49.72%, 44.30%, 32.03%.
canker disease of Carya cathayensis; fungal endophytes; biological control
S763.15
B
1001-3776(2015)02-0058-04
2014-06-06;
2015-01-25
浙江农林大学科研发展基金项目(2013FK019);浙江农林大学创新创业训练计划项目(201302013)
朱诚棋(1992-),男,浙江桐乡人,从事森林保护学研究;*通讯作者。

