bFGF经鼻给药对大鼠缺血再灌注脑损伤的保护作用
姜义娜,田福荣,林倩,姚锐,赵应征
(1.温州医科大学 药学院,浙江 温州 325035;2.北京老年医院 医保办,北京 100095)
·论 著·
bFGF经鼻给药对大鼠缺血再灌注脑损伤的保护作用
姜义娜1,田福荣1,林倩1,姚锐2,赵应征1
(1.温州医科大学 药学院,浙江 温州 325035;2.北京老年医院 医保办,北京 100095)
目的:探索碱性成纤维细胞生长因子(bFGF)经鼻给药这一新途径对脑缺血神经元的保护作用。方法:用颈外动脉线栓法(ECA法)制备大脑中动脉栓塞的局灶性脑缺血再灌注(I/R)动物模型,于术后24 h进行神经功能评分检验建模成功与否。对造模成功大鼠经鼻给予bFGF治疗后,分别通过神经功能评分、TTC染色测定脑梗死体积、HE染色以及免疫组织化学法来评价其疗效。结果:大鼠经bFGF治疗后,脑梗死体积显著减少(P<0.05);染色结果显示治疗后大鼠的神经细胞数目增加,并且p-Akt阳性细胞表达量增加。结论:bFGF通过鼻腔给药这一新途径能够显著减少缺血脑组织神经细胞的死亡,对缺血神经元具有较好的保护作用。
碱性成纤维细胞生长因子;缺血再灌注脑损伤;颈外动脉线栓法;鼻腔给药;大鼠
临床上脑血管病中缺血性者约占80%,而其中大脑中动脉(MCA)栓塞又占43%[1],但迄今为止,能够预防和治疗缺血再灌注引起的脑损伤的治疗方案或者药品几乎没有,这就使很多病人在缺血再灌注后丧失劳动能力和生活自理能力,严重影响其生存质量。因此在对症治疗脑缺血中风的同时,亟待建立一个对缺血再灌注引起的脑损伤有保护和预防作用的治疗方案。根据已有研究[2-4]表明,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)对大脑神经元具有促进存活并且能够刺激神经生长、突触形成及神经再生。利用注射给药的大分子的多肽药物较难透过血脑屏障(bloodbrain barrier,BBB),而鼻腔给药则提供了一个沿着嗅觉途径到脑内室的直接通道,可使药物绕过BBB并同时减少药物的全身性分布,从而具有高效靶向入脑及降低全身性不良反应。因此本研究旨在通过建立一种与临床缺血性中风相接近的局灶性脑缺血再灌注模型,并探索经由鼻腔给药治疗后,bFGF对缺血神经元的保护作用,拟为临床治疗缺血再灌注引起的脑损伤提供一种可行的方案。
1 材料和方法
1.1 实验动物 健康雄性SD大鼠(SPF级)52只,体质量(280±20)g,购自上海斯莱克实验动物公司。饲养于温度为(22±2)℃、相对湿度为(55±15)%的动物房鼠笼里,12 h光照/12 h黑暗周期变化,并且保证大鼠能够自由取食及饮水。所涉及的动物实验均得到了温州医科大学伦理委员会的批准。52只大鼠随机分组,16只用于模型制备方法的比较与优化:颈总动脉线栓法(CCA法)与颈外动脉线栓法(ECA法)各8只;余下36只分成3组:假手术组(A组,n=12)、缺血再灌注组(B组,n=12)和bFGF经鼻治疗组(C组,n=12)。
1.2 仪器和试剂 MCAO栓线(2636-50,北京沙东生物技术有限公司);大鼠脑切片模具[ZH-003,东西仪(北京)科技有限公司];数字显微镜(OLYMPUS,MODEL CX31RTSF);图像分析系统(QUESTAR,DT-500 DigiCAM);石蜡包埋机(Leica EG1150C,德国徕卡仪器公司);石蜡切片机(Leica RM2235,德国徕卡仪器公司);移液枪(720080-10 μL/20 μL,上海精密仪器公司);分析天平(BS110S,北京赛多利斯天平有限公司);bFGF冻干粉(广州暨南大学生物技术研究开发中心);HE染色试剂盒(碧云天生物技术有限公司);Anti-phospho-Akt(p-Akt,Ser473)抗体(Abcam,Cambs,UK);山羊兔IgG-HRP二抗(Abcam,Cambs,UK);组织细胞固定液(4%多聚甲醛)(北京赛驰生物技术有限公司);2,3,5-氯化三苯基四氮唑(上海玉博生物科技有限公司);0.9%氯化钠溶液(河南太龙药业股份有限公司);水合氯醛(上海西塘生物科技有限公司);PBS缓冲液(上海易利生化试剂有限公司);枸橼酸缓冲液(武汉博士德生物工程有限公司);无水乙醇(宁波新之源化工有限公司)。
1.3 CCA法制备模型 用10%水合氯醛4 μL/g对术前12 h禁食不禁水的8只大鼠腹腔注射麻醉,并仰卧位固定于在手术台上。将颈部与下颌之间2 cm范围内的毛发剃除,皮肤消毒后于颈正中开口,剪开浅筋膜,钝性分离颈前肌群,分离并暴露颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用手术线结扎CCA远心端以及ECA近分叉的地方,在CCA近分叉处用眼科剪剪一小切口,将线栓从CCA插入ICA,直到有轻微阻力,插线深度约为18 mm,说明线栓已经达到MCA的起始部,固定后,缝合切口并消毒。缺血2 h后将线栓轻轻从ECA退出,拔出约1 cm左右,恢复血流灌注,完成脑缺血再灌注模型建立。整个手术过程以电热毯维持大鼠体温,控制肛温在(37±0.5)℃。
1.4 ECA法制备模型 根据Longa等[5]提出来的大脑中动脉栓塞方法(MCAO)为基础,并略作改良,具体线栓过程见图1。具体操作如下:用10%水合氯醛4 μL/g对术前12 h禁食不禁水的另外8只大鼠腹腔注射麻醉,仰卧位固定在手术台上。将颈部与下颌之间2 cm范围内毛发剃除,皮肤消毒后于颈正中开口,剪开浅筋膜,钝性分离颈前肌群,分离并暴露CCA、ECA和ICA。于远心端用5号手术缝合线将ECA及翼颚动脉结扎,手术线活结阻断CCA血流,用动脉夹夹闭ICA。在ECA结扎线近端做小三角切口,将栓线通过切口插入到ICA,松开ICA上的动脉夹,继续将线栓往里约深入18 mm左右,阻断MCA入口,结扎ECA近心端,缝合伤口并用碘伏消毒。缺血2 h后将线栓轻轻从ECA退出,松开CCA上活结,恢复血流灌注,完成脑缺血再灌注模型建立。整个手术过程以电热毯维持大鼠体温,控制肛温在(37±0.5)℃。

图1 大鼠脑血管分布及线栓插入位置
1.5 实验动物处理和给药方法
1.5.1 实验动物分配:A组、B组、C组3组实验大鼠各取4只用于TTC染色计算梗死体积,4只用于HE染色观察脑组织梗死情况,4只用于免疫组织化学法检测p-Akt的表达。B组与C组选择ECA法来构建模型。
1.5.2 鼻腔给药具体操作:10%水合氯醛4 μL/g腹腔注射麻醉大鼠,取仰位平躺固定,10 μL移液枪吸取5 μL药液滴入一侧鼻腔。经5 min吸收,采用相同的方法于另一侧鼻孔给药,每5 min交替鼻孔给药,共持续30 min。C组给予bFGF溶液,总给药量为0.33 μg/g,A、B组给予相同体积0.9%氯化钠溶液。首次给药时间为术后立即给药,之后每天给药1次,连续给药3 d。
1.6 神经功能评分统计 根据改良的Bederson评分表[6],对两种方法制备的缺血再灌注模型是否成功建立进行检验。此外,分别在给药治疗后1 d、2 d、3 d对各组进行神经功能评分,观察药物治疗后神经功能改善状况。
神经功能缺损评分参照Bederson评分标准并稍作修改,具体等级评分见表1。其中,0分者(无神经功能损伤)和5分者(过度损伤)剔除实验,1~3分者纳入实验范围。

表1 神经损伤评分表
1.7 TTC染色 术后24 h,分别将两种建模方法制备的缺血再灌注模型大鼠麻醉,灌注0.9%氯化钠溶液。开颅取脑,取大鼠脑组织置-20 ℃冰冻20 min后,去除小脑嗅脑和低位脑干。将大脑自额叶由前往后作冠状切成2 mm的脑片,将脑片置于1% TTC的染液中,在37 ℃避光染色约20 min,数码相机拍照并作图像处理,观察各组大鼠脑组织梗死情况。此外,在第3次给药24 h后也按上述方法对各组进行TTC染色并进行相关处理。
1.8 脑组织处理
1.8.1 灌注:对大鼠进行神经功能评分后,排除无神经功能损伤的和损伤过度的术后大鼠,避免手术因素干扰bFGF治疗效果。将大鼠腹腔注射麻醉,仰卧位固定,打开胸腹部,暴露出心脏,心尖穿刺灌注,快速灌注0.9%氯化钠溶液冲洗。
1.8.2 取脑:灌注成功后,由枕骨大孔处用剪刀横断大鼠头部,在枕骨大孔斜插入手术剪刀剪开顶骨,用止血钳瓣钳断旁边的顶骨[11],注意嗅球上的顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,将整块的脑组织翘起。仔细剥离颅骨,以4%多聚甲醛于4 ℃下固定24 h。PBS缓冲液洗3次,每次10~20 min,然后分别在30%、50%乙醇中浸泡10~20 min,浸置于70%乙醇放入4 ℃冰箱保存。1.8.3 石蜡包埋:新鲜脑组织在进行HE染色和免疫组织化学染色法检测之前需要先进行石蜡包埋。取出保存于4 ℃下70%乙醇中的组织样品,分别浸在80%乙醇15 min,95%乙醇15 min,100%乙醇30 min,50%乙醇和50%二甲苯各15 min,二甲苯透明5~10 min,50%二甲苯和50%石蜡30 min,硬蜡1.5 h,软蜡1.5~2.5 h,最后置4 ℃冰箱保存。
1.9 HE染色观察神经元形态变化 脑组织石蜡切片进行HE染色,切片经过恒温烘箱脱蜡,再用递减梯度乙醇水化,苏木素染色后经水返蓝,再用伊红复染,中性树胶封片后,在光学显微镜下观察病理学变化。
1.10 免疫组织化学法观察p-Akt表达的变化
1.10.1 脱蜡水化:脑组织切片置于60 ℃烘箱中烘烤30 min,取出后置于二甲苯溶液I浸20 min、二甲苯溶液 II浸10 min,依次在无水乙醇、95%乙醇、75%乙醇各浸泡5 min,PBS洗涤2次各5 min。
1.10.2 抗原修复、封闭:将脱蜡水化的脑组织切片在3% H2O室温封闭10 min,蒸馏水洗3次各2 min,枸橼酸液高压加热5 min,自然冷却,PBS洗涤2次各5 min,5% BSA室温封闭10 min,甩去多余液体。
1.10.3 抗体孵育:在抗原修复、封闭后的脑组织切片中滴入I抗(适当稀释的IgG)50 μL,37 ℃恒温孵育2 h或4 ℃过夜,PBS洗涤3次各5 min。
1.10.4 显色反应:将经抗体孵育后的脑组织切片分别在75%乙醇、95%乙醇、无水乙醇中各浸泡5 min,二甲苯浸泡10 min,更换新鲜二甲苯再浸泡10 min,使用中性树胶封片,晾干后在显微镜下观察。
1.11 统计学处理方法 采用SPSS 16.0统计软件进行统计学处理。计量资料以表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两种制备局灶性脑缺血再灌注模型方法的比较
2.1.1 神经功能评分统计:两种线栓法制备的局灶性脑缺血再灌注模型神经功能评分结果显示(见表2),CCA法大鼠神经功能损伤严重,接近死亡的数量较多,ECA法大鼠神经功能较稳定,损伤严重程度符合后期实验的要求。

表2 两种造模方法的神经功能评价结果(只)
2.1.2 TTC染色观察脑组织梗死情况:TTC结果显示,CCA法大鼠梗死体积过大,梗死部位没有ECA法梗死部位准确,同时未见伤及另侧脑半球组织(见图2)。两种制备方法梗死体积经独立样本t检验,P<0.01,差异有统计学意义(见图3)。

图2 TTC染色观察脑组织梗死情况
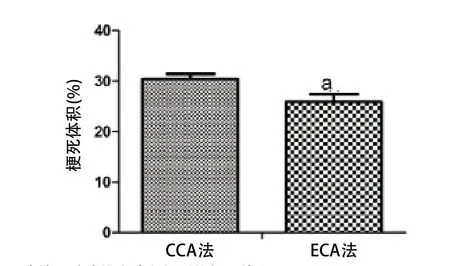
图3 比较两种造模方法所得到的梗死体积
2.2 bFGF对ECA法制备缺血再灌注大鼠治疗作用的评价
2.2.1 神经功能评分统计:手术后,A组无神经损伤症状;B组表现不能直线行走,向病灶对侧偏转,与A组对比,神经功能损伤严重(P<0.05);而C组神经功能评分比B组降低(P<0.05)(见表3)。
表3 神经功能评分(n=4,)

表3 神经功能评分(n=4,)
与A组比:aP<0.05;与B组比:bP<0.05
组别术后24 h术后48 h术后72 h A组000 B组3.14±0.123.09±0.22a3.02±0.17bC组2.71±0.192.43±0.20b2.26±0.18b
2.2.2 TTC染色观察梗死情况:经过TTC染色后,A组脑组织没有梗死,颜色正常。B组可见明显的白色梗死区域(见图4),梗死体积约占大脑总体积的26.95%;C组梗死体积缩小,梗死体积约占大脑总体积的16.61%,与B组比较,差异有统计学意义(P<0.05),见表4、图5。
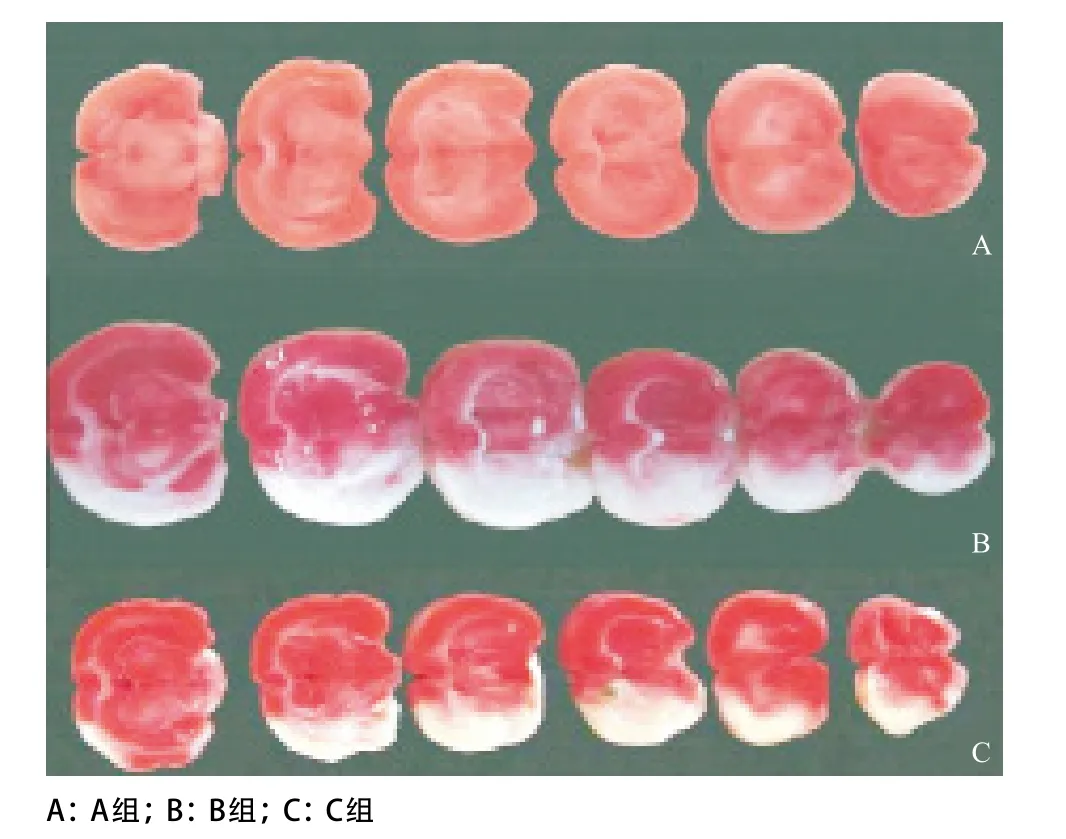
图4 TTC染色梗死区域观察
表4 脑梗死体积百分比(n=4,)

表4 脑梗死体积百分比(n=4,)
与B组比:aP<0.05
组别梗死体积百分比(%)A组0 B组26.95±1.73aC组16.61±2.15a

图5 比较3组大鼠的脑梗死体积
2.2.3 受损神经元HE染色情况:苏木素将细胞核染成蓝紫色,伊红将细胞质染成红色。B组大鼠的手术侧(右侧)脑组织在低倍镜下均可见梗死灶,A组大鼠未见有梗死灶。再以高倍镜观察可见A组大鼠脑神经细胞形态基本正常,胞膜核膜清晰,核仁明显(见图6)。B组可见稳定梗死灶,梗死灶中心区域神经细胞脱失明显,残存细胞多无完整的细胞结构,细胞核固缩深染,核仁消失。梗死区周围神经细胞数目减少,且肿胀坏死脱失,分布不均匀,细胞周围间隙增宽,水肿明显。C组梗死灶中心神经细胞脱失相对亦较明显,但较B组已有明显改善,细胞肿胀坏死数目减少,神经细胞数目增多。
2.2.4 免疫组织化学法检测p-Akt表达:A组有丰富的p-Akt阳性细胞(细胞质为棕黄色,细胞核染成深蓝色),且细胞结构完整。B组与A组比较,神经元的染色均变淡。C组与B组相比,染色明显加深(见图7)。说明大鼠脑梗死2 h再灌注72 h后,缺血的海马区脑组织p-Akt表达降低,而用bFGF治疗后,明显增强了p-Akt的表达。
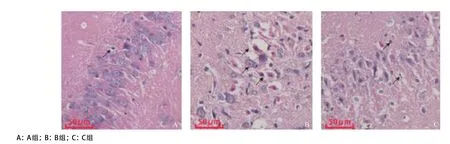
图6 海马区组织HE染色结果(×400)

图7 海马区脑组织免疫组织化学法检测p-Akt表达(×400)
3 讨论
3.1 脑缺血动物模型的确立 近年来人们对脑缺血动物模型的制作方法进行了大量研究,建立了很多模拟人类各种脑缺血状态的动物模型,如开颅物理阻断血流法、自体血栓栓塞脑缺血模型、微栓子栓塞法、线栓法等[7]。线栓法制备的局灶性脑梗死模型与人类脑缺血、中风的病理过程相似,适用于临床脑缺血治疗药物的研究。其中,大鼠是较理想的模型动物,优点在于它的脑血管解剖接近人类,血管性损伤部位恒定,实验重复性较好[8]。在线栓法制备局灶性脑缺血再灌注模型时,插入线栓的长短直接关系着造模的成功与否。因大鼠大脑血管中动脉长度和直径与其体质量呈正相关,因此栓线的长度、直径要与大鼠的体质量相互匹配。Holland等[9]使用重约300 g的大鼠,进线的深度约18.0 mm,复制了Longa的模型是比较成功,所以本实验延用了此方法。造模完成后,大鼠不会立即苏醒,此时大鼠体温的保持很重要。一般在动物实验时用肛表监测,使用恒温加热毯将动物的体温维持在37 ℃,如果有条件监测脑温则更可靠[10]。
本研究中,由神经功能评分及梗死情况作出判定,与CCA法的建模方式相比较,ECA法更稳定,并且梗死区域符合实验所需,即ECA法优于CCA法。
3.2 bFGF经鼻给药成为bFGF有效发挥脑神经保护功能的可行途径 虽已有文献证明bFGF对急性脑卒中动物模型的神经元具有保护作用[11-13],但bFGF作为大分子蛋白类药物难以透过BBB,因此全身性给药方式(静脉注射、腹腔注射,或皮下给药)入脑效率极低,而且加大给药剂量可导致全身性不良反应,这使得其保护作用难以通过传统的途径实现。
嗅觉系统提供了一个直接联系脑和外周环境的桥梁,正是由于嗅黏膜与脑存在直接转运通路,使得一些外源性的物质可以绕过BBB、避开肝脏的首过效应及胃肠道中代谢酶作用而直接入脑,这一特点赋予了鼻腔给药入脑的独特优势[14]。本研究中,经bFGF鼻腔给药治疗的脑缺血再灌注后的大鼠神经功能得到一定的恢复,梗死体积小于非给药组。HE染色和免疫组织化学结果也显示,经bFGF鼻腔给药治疗,脑缺血再灌注后的大鼠神经元的损伤程度明显降低,并且上调了p-Akt蛋白的表达。综上各指标,bFGF可以通过鼻腔给药改善局灶性缺血的脑组织,减少缺血脑组织神经细胞的凋亡,对缺血的脑组织具有保护作用。
因此,bFGF经鼻给药为临床治疗脑梗死所致的脑神经损伤修复提供了一种可行的医疗方案。然而经鼻给药也存在一些局限,如何将bFGF更进一步高效地递送入脑并同时提高bFGF的稳定性成为我们日后研究的关键。
参考文献:
[1] 马宁, 蔡继福, 姜卫剑. 局灶性脑缺血动物模型的制备[J].神经损伤与功能重建, 2010, 5(1): 53-55.
[2] Noda M, Takii K, Parajuli B, et al. FGF-2 released from degenerating neurons exerts microglial-induced neuroprotection via FGFR3-ERK signaling pathway[J]. J Neuroinflammation, 2014, 11(76): 1176-1186.
[3] Enevoldsen MN, Kochoyan A, Jurgenson M, et al. Neuroprotective and memory enhancing properties of a dual agonist of the FGF receptor and NCAM[J]. Neurobiol Dis, 2012, 48(3): 533-545.
[4] Zechel S, Werner S, Unsicker K, et al. Expression and functions of fibroblast growth factor 2(FGF-2) in hippocampal formation[J]. Neuroscientist, 2010 16(4): 357-373.
[5] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[6] 程发峰, 宋少婷, 郭少英, 等. 神经功能损伤评分在大鼠脑缺血实验中的应用[J]. 中国比较医学杂志, 2011, 21(3): 43-48.
[7] 王桥生, 符晖, 曾红科. 线栓法大鼠局灶脑缺血模型的改进与评价[J]. 中南医学科学杂志, 2012, 40(3): 291-294.
[8] 陈茉弦, 敖丽娟, 李琦, 等. 脑卒中动物模型的建立与比较[J]. 中国康复医学杂志, 2011, 26(8): 779-782.
[9] Holland JP, Sydserff SG, Taylor WA, et al. Rat models of middle cerebral artery ischemia[J]. Stroke, 1993, 24(9): 1423-1424.
[10] 于奎营, 韩江全, 张海霞. bFGF对大鼠脑缺血再灌注侧皮质区细胞凋亡及p-Akt(Ser473)表达的影响[J]. 广东医学, 2010, 31(23): 3035-3037.
[11] 韩江全, 于奎营, 何敏, 等. 葛根素对大鼠脑缺血再灌注侧皮质区细胞凋亡及p-Akt(Ser473)表达的影响[J]. 中国中西医结合杂志, 2012, 32(8): 1069-1072.
[12] 邢雪松, 吕威力, 赵海, 等. bFGF对局灶性脑缺血大鼠脑组织GRP78表达的影响[J]. 解剖学研究, 2012, 34(4): 290-292.
[13] 袁凤刚, 郝艳玲, 张春平, 等. MK801对大鼠全脑缺血/再灌注ASK1信号通路影响以及神经元的保护[J]. 中国药理学通报, 2014, 30(2): 179-185.
[14] 朱红霞. 经鼻腔给药靶向中枢神经系统的研究进展[J]. 中国医药指南, 2012, 109(23): 105-106.
(本文编辑:吴昔昔)
Neruoprotective effect of bFGF on ischemic-reperfusion injury in SD rats via intranasal administration
JIANG Yina1, TIAN Furong1, LIN Qian1, YAO Rui2, ZHAO Yingzheng1. 1.School of Pharmacy, Wenzhou Medical University, Wenzhou, 325035; 2.Medical Insurance Office, Beijing Geriatric Hospital, Beijing, 100095
Objective: To investigate the neuroprotective effects of bFGF (basic fibroblast growth factor) via intranasal administration for ischemic neurons of brain. Methods: The transient focal cerebral ischemia-reperfusion model of adult male SD rats was established with a method of line-plugging to the external carotid artery. Twenty-four hours after the reperfusion, behavioral test (neurologic deficit scoring) was carried out to evaluate the neurological deficiency. The neuroprotective effects of bFGF via intranasal administration to the model rats were evaluated with neurologic deficit score, infarct volume, histology and immunohistochemistry staining. Results: The transient focal cerebral ischemia-reperfusion model were established successfully. Comparing with the ischemia-reperfusion group, the level of infarction volume was significantly decreased (P<0.05), the number of nerve cells were increased and the expression of p-Akt positive cells were significantly up-regulated via intranasal administration of bFGF group. Conclusion: By the new pathway of nasal administration, bFGF can decrease the infarction volume and protect neurons from cerebral ischemic injury.
bFGF; cerebral ischemia-reperfusion injury; external carotid arterial line plug method; intranasal administration; rats
R743.3
A
10.3969/j.issn.2095-9400.2015.08.004
2014-12-22
国家自然科学基金资助项目(81272160)。
姜义娜(1978-),女,山东威海人,讲师,硕士。

