咖啡酸修饰笃斯越橘花色苷的实验分析
朱良玉,张 悦
(黑龙江省科学院自然与生态研究所,黑龙江哈尔滨150040)
咖啡酸修饰笃斯越橘花色苷的实验分析
朱良玉,张 悦*
(黑龙江省科学院自然与生态研究所,黑龙江哈尔滨150040)
应用超声波萃取法提取大兴安岭笃斯越橘花青素,通过提纯、上柱、浓缩得到纯化后的花色苷,以空白花色苷为对照,设计将其与咖啡酸、咖啡酸加酶两组酰化反应,比较分析花色苷的稳定性。结果表明,50℃持续加热状态下96 h后花色苷对照组保存率77.26%、不加酶组81.00%、加酶组84.96%。咖啡酸在酶的催化下可以明显提高笃斯越橘花青素的稳定性。
笃斯越橘;咖啡酸;酰化;花色苷
笃斯越橘(Vaccinium uliginosum)属杜鹃花科越橘属植物,起源于北美,为多年生灌木小浆果果树。因果实呈蓝色,故称为蓝莓。其含有的大量水溶性色素花色苷,具有抗氧化、抗突变、降血糖、软化血管、清除自由基等作用,有极高的药用、保健和营养价值,从食品添加剂角度又具有较高的市场和商业价值。近年来,天然食品添加剂越来越受到人们的关注,花色苷的稳定性是食品加工业应用的关键,因此提高花色苷稳定性的研究始终是花色素研究的热点,目前该研究方法主要是分子修饰法,而酰基化法是分子修饰法的一种。
花色苷酰化的途径主要有化学酰化、酶促酰化。化学酰化需要各种酰基供体,主要有酸类、酯类以及酸酐等。有研究报道表明,添加一定量筛选出的肉桂酸、咖啡酸和阿魏酸后,剌葡萄皮花色素的吸光度值明显增加,最大吸收波长红移,对温度、光照的耐受性增强[1]。卢锋波[2]通过实验发现,咖啡酸对黑莓酒具有辅色作用,表现为可见光范围内最大吸收值13.51%~19.19%的增加。董楠等[3]研究表明,咖啡酸的添加能明显提高色素溶液在光(自然和紫外)、热以及不同金属离子条件下的稳定性,且随咖啡酸浓度的增加其稳定效果加强。
酶促酰化因酶对于催化底物良好的专一性和选择性,反应条件温和,催化作用高效,因而酶促法分子修饰发展非常迅速。有报道表明,以保存率为评价指标,通过时间、比例、温度和pH的单因素试验及响应面优化,选择对羟基苯甲酸作为酰基供体,进行酶促酰化工艺研究可使蓝靛果花色苷保存率达93.51%[4]。赵垒[5]研究表明,将花色苷样品与酰基供体在非水环境中以Novozyme435酶(固定化脂肪酶435)为催化剂进行酰化反应可提高平阴玫瑰花花色苷稳定性。
该实验应用超声波方法提取大兴安岭笃斯越橘花青苷,上柱纯化后对花青苷进行分子修饰,采用咖啡酸作为酸供体,加入Novozyme435酶促进其酰化,有效提高花色苷的稳定性,为笃斯越橘花色苷分子修饰和花色苷稳定性提高的研究和生产,提供相关技术、实验数据及理论参考。
1 材料与方法
1.1 材料与试剂
笃斯越橘:采自大兴安岭;
咖啡酸(分析纯)、无水乙醇(分析纯)、Novozym435脂肪酶(活力10 000 PLU/g)、X-5树脂:南京化学试剂有限公司。
1.2 仪器与设备
KQ-5200超声波破碎仪:北京益植康生物科技有限公司;T6紫外可见分光光度计:北京普析通用公司;R-205B旋转蒸发仪:上海申胜仪器公司;FD-1A-50冻干机:上海申胜仪器公司;NDJ-1电热恒温水浴锅:北京医疗电子仪器厂;FJ-200高速万能粉碎机:天津泰斯特仪器公司;DHG-9240电热恒温鼓风干燥箱:上海一恒科技有限公司。
1.3 试验方法
1.3.1 花色苷材料的制备
正常室温环境中,将准确称量的50 g大兴安岭笃斯越橘打碎成汁液,用体积分数为70%乙醇1 000 m L浸提;温度30℃、超声波功率80 W条件下超声萃取20 min,4层纱布过滤后,澄清液旋转蒸发,用X-5树脂上柱,用蒸馏水洗脱至无色后,用体积分数为70%乙醇洗脱得到澄清深红色液体,旋转蒸发,得到花色苷浓缩液,冻干备用。
1.3.2 实验设计与操作
咖啡酸修饰花色苷酰化实验:精确称量0.005 g花色苷冻干样品,花色苷与咖啡酸以质量比1∶5混合,溶于10 m L无水乙醇中,室温条件下振荡20 min充分溶解,加入0.1 g Novozyme435酶(固定化脂肪酶435),在45℃条件下水浴6 h进行酰化反应,反应中止后4层纱布过滤脂肪酶,记为咖啡酸加酶组A 1。在以上步骤中去除加酶环节,未加酶记为咖啡酸组A2,以不加咖啡酸为空白组A3。
花色苷老化试验:将以上3组实验样品分别置于10 m L试管内,于50℃水浴锅内加热96 h。用紫外-可见分光光度法测定样品吸光度值,每24 h测定一次。
1.3.3 花色苷稳定性分析
提高花色苷的稳定性是通过减缓花色苷分解速率来实现的,花色苷分解速率越慢说明其稳定性越高,花色苷分解速率可以通过其保存率来体现,设咖啡酸与花色苷酰化反应结束时为测量始期,花色苷保存率计算公式如下:
保存率=(An/A0)×100%
式中:A0为花色苷溶液的初始吸光度值;An为加热n小时后花色苷溶液的吸光度值。
2 结果与分析
2.1 各实验组花色苷吸光度值的变化
咖啡酸与花色苷酰化反应结束时为测量始期,同一环境、加温条件下的咖啡酸加酶组A1、咖啡酸组A2和空白组A3在96 h内,各实验组花色苷吸光度值的变化结果见图1。
由图1可知,在50℃加热状态下,各组花色苷的吸光度值随着加热时间的增长而减小,48 h后吸光度值下降相对变得平缓,花色苷吸光度值大小与加热时间成反比,随时间的延长吸光度值呈逐渐下降趋势。A 1组花色苷吸光度值较A3组大幅度减小,A2组吸光度值最高。结果表明,咖啡酸对大兴安岭笃斯越橘花色苷具有辅色作用,Novozyme435酶的加入对花色苷的吸光度值有一定抑制作用,可能是产生了其他化学反应。
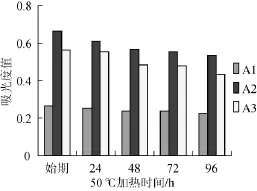
图1 各组花色苷96 h内吸光度值变化比较Fig.1 Absorbance values comparison of anthocyanins in 96 h
2.2 各实验组花色苷保存率的变化
根据50℃加热状态下96 h的吸光度值计算3组的保存率,结果见表1。

表1 花色苷保存率结果Tab le1 Results o f anthocyanin preservation rate
由表1可知,同一环境、50℃加热状态下,24 h A1组保存率高于A2组低于A3组,之后保存率一直比其他两组高,96 h达到84.96%,比A3组高7.7%;A2组保存率介于其他两组中间,96 h后达到81.00%;A 3组24 h保存率最高98.22%,96 h后下降至77.26%。结果表明,咖啡酸的加入提高了大兴安岭笃斯越橘的花色苷的稳定性,加入Novozyme435酶后花色苷的保存率有进一步的提升。
3 结论
本项实验研究验证了咖啡酸修饰花色苷时,在酶的催化作用下提高花色苷稳定性效果较为显著,在50℃加热状态下96h后保存率为84.96%,稳定性高于不加酶组和空白组。
50℃加热状态下通过时间的增加测试花色苷的吸光度值和保存率主要是考察时间对花色苷的稳定性影响,在加速花色苷分解的同时考察花色苷对50℃温度的抗性,实验证明在加入咖啡酸后花色苷稳定性提高,但是酶的加入减少了花色苷的吸光度值。
酶对于花色苷的分子修饰具有选择性,咖啡酸加酶提高了花色苷的稳定性却降低了其吸光度值,可能是因为酶与花色苷生成了其他物质,减少或遮蔽了花色苷的某些基团,其抗氧化功能是否也有所变化有待于化学结构、成分分析等方面的深入研究。本实验加酶修饰后的花色苷稳定性明显增高,证明了酶促法可以有效的提高花色苷稳定性。
[1]田小燕.刺葡萄花色苷有机酸及黄酮辅色效果研究[D].长沙:湖南农业大学硕士论文,2013.
[2]卢锋波.黑莓花色苷提取及其辅色研究[D].南京:南京农业大学硕士论文,2010
[3]董楠,宋会歌,刘嘉,等.咖啡酸对胭脂萝卜红色素辅色作用及稳定性的影响[J].食品科学,2011,32(7):61-64.
[4]臧云.蓝靛果花色苷酶促衍生物的稳定性及抗氧化研究[D].哈尔滨:东北林业大学硕士论文,2013.
[5]赵垒.平阴玫瑰花花色苷纯化工艺优化、分子修饰及应用研究[D].济南:山东师范大学硕士论文,2011
[6]张智,宋静,王振宇,等.辅色素对蓝靛果花色苷稳定性的影响[J].食品工业科技,2011,32(4):320-323.
[7]王维茜,邓洁红,魏一枝,等.葡萄花色苷的合成及稳定性研究进展[J].中国酿造,2014,33(5):15-19.
[8]热合满·艾拉、迪丽娜尔·买买提.江石榴汁色素稳定性的研究[J].保鲜与加工,2012,12(4):21-24.
[9]李梦莎.响应面法优化超声提取黑果腺肋花楸花色苷工艺的研究[J].中国酿造,2014,33(9):129-133.
[10]周丽萍,朱良玉,张悦.北方主要越橘栽培品种果实品质及抗氧化能力比较[J].中国林副特产,2012,120(5):4-6.
[11]孙婧超,刘玉田,赵玉平.示差法测定蓝莓果酒中的花色苷条件的优化[J].中国酿造,2011,30(11):171-174.
[12]石映红.酶催化技术在现代工业中的应用[J].科技资讯,2011,4(10):96-97.
[13]WANG L,ALBERT N W,ZHANG H B.Temporal and spatial regulation of anthocyanin biosynthesis provide diverse flower colour intensities and patterning in Cymbidium orchid[J].Planta,2014,240(5):983-1002.
[14]DIMITROVSKA M.Anthocyanin composition of Vranec,Cabernet Sauvignon,Merlotand Pinot Noir grapesas indicator of their varietal differentiation[J].Eur Food Res Technol,2011,232(4):591-600.
[15]HOLZWARTH M,KORHUMMEL S.Impact of enzymatic mash maceration and storage on anthocyanin and color retention of pasteurized strawberry purées[J].Eur Food Res Technol,2012,234(2):207-222.
[16]SAKUTA M.Diversity in plant red pigments:anthocyanins and betacyanins[J].Plant Biotechnol Rep,2014,8(1):37-48.
[17]AZUMA A,YAKUSHIJI H,KOSHITA Y,et al.Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J].Planta,2012,236(4):1067-1080.
[18]方忠祥,倪元颖.花青素生理功能研究进展[J].广州食品工业科技,2001,17(3):60-62.
[19]李卫业,李群.辐射及活性氧对DNA的损伤以及芥子碱的保护作用[J].植物生理学报,1997,23(4):319-323.
[20]WANG H,CAO G,PRIOR R L.Oxy radical absorbing capacity of anthocyanins[J].J Agr Food Chem,1997,45(2):304-309.
[21]格日勒,亓伟,刘淑娟.原花青素HPLC测定方法研究进展[J].中国酿造,2014,33(4):13-16.
[22]王锋,邓洁红,谭兴和.花色苷及其共色作用研究进展[J].食品科学,2008,29(1):472-476.
酱油背后的秘密
最近十年,鸡精、酱油、醋、酱、复合调味料等行业都得到了快速发展,催生酱油行业急速成长的原因总结下来可能主要是以下几点:
1不以价格为局限,以品质提升、消费者口感为追求
市场启动前,传统酱油4~5元/瓶的产品就算高档产品,市场大量的袋装、散装及2~3元左右产品是主流。可是这些酱油企业几乎都没有被原有的市场价格所局限,通过分析,发现消费者对酱油功能的关注已经从调色转移到增加鲜味、提升口感上。而满足这些要素生产出来的酱油往往在上市初期都是走高档路线,在得到消费者初步认可后,慢慢走向大众化,渐渐成为常规性产品。海鲜酱油是当时很多企业积极尝试的一个新产品,这是酵母抽提物和其他鲜味剂进入酱油的一个起步。
2勇于接受并使用新技术、新设备
传统酱油生产大多使用缸或池,生产的稳定性、大规模复制性都受到局限。为了稳定品质、便于大规模扩张,大罐发酵成为必然选择,日式高盐稀态工艺的大罐精准控制优势显现无疑。此外伴随高盐稀态工艺进入酱油工厂的是酱油酵母等有益功能微生物的使用。其实酱油酵母在工厂的应用并不陌生,只是一直没有得到明确的行业内宣传,存在很多认识上的误区。
为了结合市场需求和行业发展趋势,研发出酱油活性干酵母,其开发历程可以划为四个阶段:
第一阶段:2010年初国内首次生产出酱油活性干酵母时,对于菌种的性能都尚未完全了解。伴随着工厂的应用摸索,对酵母的耐温、耐盐等性能有了进一步掌握。
第二阶段:由于缺乏可以借鉴的经验,酱油活性干酵母的添加时间、用量以及酵母之间拮抗反应等问题通过反复的应用,最终摸索出来适宜的应用工艺。
第三阶段:大批酱油工厂的发酵验证,为不同酵母菌种的代谢产物分析做了充分验证,浓郁风格、淡雅风格等差异化需求日渐凸显。
第四阶段:很多酱油酵母并非常规酿酒酵母属,是鲁氏酵母,该类酵母在制备成为干酵母后,常温条件下无法进行长时间的存储,酵母活力下降快,这直接影响了酱油酵母的使用效果。研究人员尝试使用包埋技术、鲜酵母、半干酵母、冷冻干燥等,都没有得到理想效果。直到研究人员找到酵母激活因子解决生长问题,用干酵母冷冻储存才彻底消除了酱油酵母应用通路上的最后一个瓶颈。
摘自安琪酵母股份有限公司信息
Experimental analysis of blueberry anthocyanins modified with caffeic acid
ZHU Liangyu,ZHANG Yue*
(Institute of Nature Resources,Heilongjiang Academy of Sciences,Harbin 150040,China)
The anthocyanin of Vaccinium uliginosum from Greater Khingan was extracted by ultrasonic,and then it was purified by purification, column,and concentration.Using blank anthocyanin as control,the anthocyanin was added with caffeic acid and caffeic acid enzyme respectively to conduct acylation reaction,and the stability of anthocyanins was compared.Results showed that after heating at 50℃for 96 h,the anthocyanin preserving rate of the control group,without enzyme group and enzyme group was 77.26%,81.00%and 84.96%,respectively.Caffeic acid can obviously improve the stability of blueberry anthocyanins catalyzed by enzymes.
blueberry;coffee acid;acylation;anthocyanin
Q946.5
A
0254-5071(2015)03-0130-03
10.11882/j.issn.0254-5071.2015.03.031
2015-01-13
黑龙江省科学院青年创新基金(ZRS20120531);黑龙江省财政厅应用技术研究专项(kxy20121220)
朱良玉(1984-),女,助理研究员,硕士,研究方向为植物化学。
*通讯作者:张悦(1962-),男,研究员,本科,研究方向为植物资源。

