超高效液相色谱-二极管阵列检测-串联质谱法测定茶叶中15 种黄酮醇糖苷类化合物
王智聪 , 沙跃兵, 余笑波, 梁月荣
(1. 浙江省计量科学研究院,浙江 杭州310018;2. 浙江大学茶叶研究所,浙江 杭州310058)
我国具有丰富的茶叶资源,饮茶及茶文化已有数千年的历史。茶不仅具有提神解渴的功效,而且具有良好的医药保健功效,有“茶医百病”之说。茶叶中含有丰富的黄酮醇糖苷类化合物。现代研究表明,黄酮醇糖苷类化合物具有显著的抗氧化、抗癌、抗动脉硬化、预防心血管疾病和保护肝脏等多种生理功能[1,2]。茶叶中的黄酮糖苷类化合物主要包括杨梅素糖苷、槲皮素糖苷和山柰素糖苷等[3,4],在黄酮醇母体结构C 环3 位连接的糖链可以是单糖,如葡萄糖、半乳糖、鼠李糖、阿拉伯糖等,也可以是由其组成的二糖或三糖等(见图1)。
黄酮醇糖苷类化合物是茶汤苦涩味和色泽形成的重要因子,对茶叶品质非常重要[5]。Scharbert等[5]研究指出,黄酮醇糖苷类化合物不仅是红茶涩味的主要呈味物质,对咖啡因的苦味也有一定的增效作用;黄酮醇糖苷类化合物虽然在茶叶中含量相对较低,但其呈味阈值非常低,如槲皮素-3-葡萄糖-鼠李糖二糖糖苷(Q-GRh)的呈味阈值是表没食子儿茶素没食子酸酯的一万九千分之一,是茶黄素的一万六千分之一。
黄酮醇糖苷类化合物的定量分析主要有液相色谱-紫外检测和液相色谱-质谱检测等方法[6-10],而定性主要通过液相色谱-紫外检测-质谱联用以及核磁共振检测等方法进行结构确认[11-21]。如Wu等[7,11]采用常规色谱柱测定了茶叶中的黄酮醇糖苷类化合物,分析时间大于60 min;Jiang 等[6]采用超高效液相色谱法测定,分析时间缩短,分离能力也增强,如常规液相色谱无法分离的Q-GRh 和山柰素-3-葡萄糖-鼠李糖-葡萄糖三糖糖苷(K-GRhG)得到了较好的分离,但仅分析了茶叶中的8 种黄酮醇糖苷类化合物。采用液相色谱-紫外检测-质谱联用方法不仅能提供紫外光谱信息,还可以测定化合物的相对分子质量和质谱碎片离子,综合进行结构解析;同时,质谱具有灵敏度高、抗干扰能力强等特点,已成为复杂基质组分测定的重要方法。本文采用超高效液相色谱-二极管阵列检测-串联质谱(UPLCPDA-MS/MS)方法,结合紫外光谱、质谱参数以及色谱保留规律等鉴定了茶叶中的15 种黄酮醇糖苷类化合物,其结构如图1 和表1 所示。

图1 黄酮醇糖苷类化合物的结构Fig.1 Structures of flavonol glycosides
1 实验部分
1.1 仪器、试剂与材料
ACQUITY 超高效液相色谱-质谱系统,配二极管阵列检测器和串联四极杆质谱检测器(美国Waters公司);AG285 型精密电子天平(瑞士Mettler Toledo 公司);5810R 型高速冷冻离心机(德国Eppendorf 公司);Milli-Q 超纯水系统(美国Millipore 公司);KQ-100DE 型数控超声波清洗器(昆山超声仪器有限公司)。
甲醇和乙腈为色谱纯,购自德国Merck 公司;甲酸为分析纯,购自Sigma-Aldrich 公司;实验用水为Milli-Q 制备的超纯水;绿茶(西湖龙井,杭州茶厂有限公司)和红茶(滇红茶,云南省凤庆县佰艺茶厂)购自当地超市;标准品槲皮素-3-葡萄糖-鼠李糖二糖糖苷(Q-GRh)、槲皮素-3-半乳糖糖苷(Q-Ga)、槲皮素-3-葡萄糖糖苷(Q-G)、山柰素-3-葡萄糖-鼠李糖二糖糖苷(K-GRh)、山柰素-3-葡萄糖糖苷(KG)购自Sigma-Aldrich 公司。
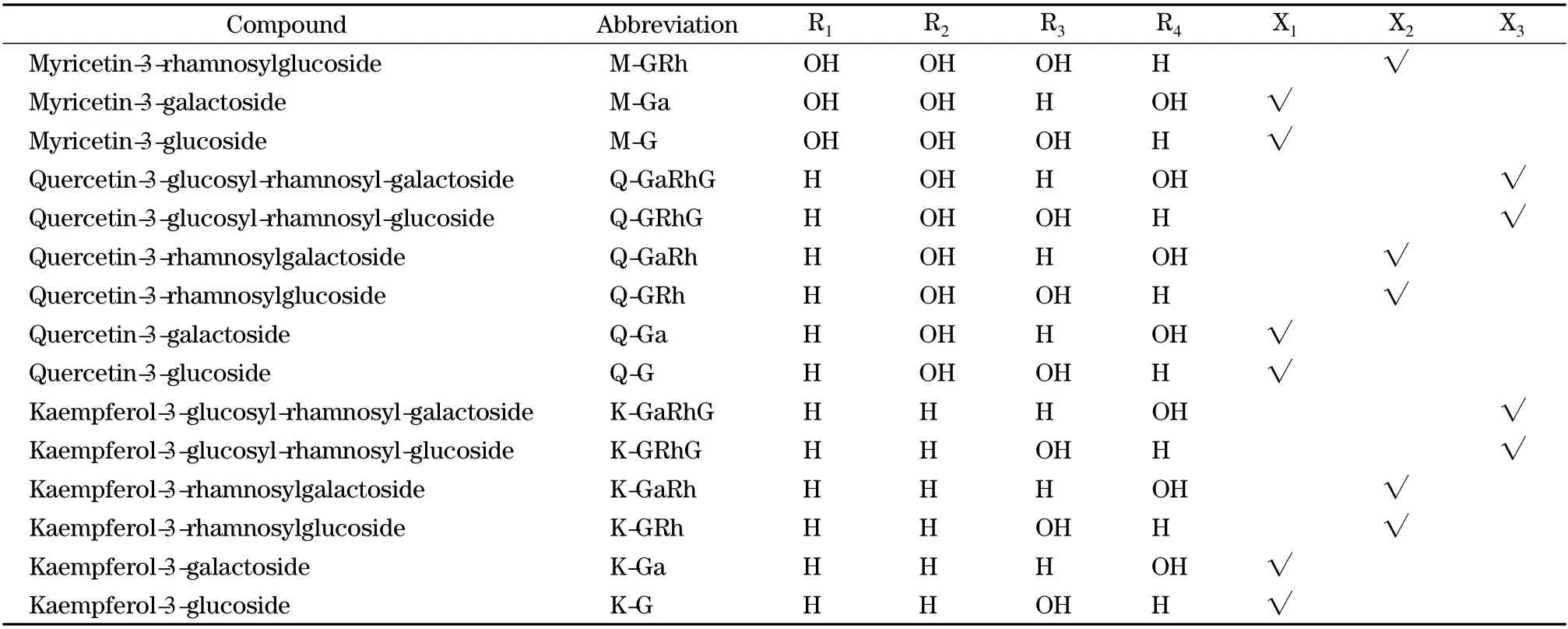
表1 绿茶和红茶中的15 种黄酮醇糖苷类化合物Table 1 Fifteen flavonol glycosides in green and black teas
1.2 实验条件
1.2.1 标准溶液的配制
准确称取Q-GRh 标准品,加入甲醇超声溶解,配制1 000 mg/L 的母液;用50% (v/v)甲醇水溶液稀释上述母液,配制质量浓度分别为0.1、0.2、0.5、1.0 和2.0 mg/L 的系列标准工作溶液。
1.2.2 供试样品的制备
取适量绿茶及红茶,粉碎,过筛(筛孔尺寸:0.9 mm×0.9 mm),精确称取筛下物1.5 g 于50 mL 带盖螺口玻璃试管中,分别加入30 mL 80% (v/v)甲醇水溶液,超声萃取15 min,以4 000 r/min 离心15 min,取上清液1 mL,加入4 mL 水稀释,稀释液用0.22 μm 聚四氟乙烯(PTFE)针式过滤器过滤后供UPLC-PDA-MS/MS 分析,每个样品平行制备两份。
1.2.3 色谱条件
Waters ACQUITY UPLC HSS T3 色谱柱(150 mm×2. 1 mm,1.7 μm);柱温为35 ℃;自动进样器温度为15 ℃;紫外检测波长为370 nm;进样体积为2 μL;流动相A 为含0.1% (v/v)甲酸的水溶液;流动相B 为含0.1% (v/v)甲酸的乙腈;流速为0.3 mL/min。梯度洗脱程序:0 ~1 min,0.1% B;1 ~2 min,0.1% B ~0.3% B;2 ~3 min,0.3% B ~0.5%B;3 ~4 min,0.5% B ~2% B;4 ~5 min,2% B ~5% B;5 ~8 min,5% B ~15% B;8 ~12 min,15%B ~17% B;12 ~15 min,17% B ~24% B;15 ~17 min,24% B ~26% B;17 ~20 min,26% B ~35% B;20 ~21 min,35% B ~60% B;21 ~22 min,60% B~95% B;22 ~23 min,95% B;23 ~23.1 min,95% B ~0.1% B;23.1 ~26 min,0.1% B。
1.2.4 质谱条件
采用电喷雾离子(ESI)源,正离子模式;毛细管电压为3.0 kV,离子源温度为150 ℃;脱溶剂气(氮气)温度为400 ℃;雾化气(氮气)流速为600 L/h,锥孔气(氮气)流速为50 L/h,碰撞气(氩气)流速为0.13 mL/min;在化合物的定性识别中,对各目标组分进行子离子扫描,扫描范围为m/z 100 ~900,碰撞电压为35 V,裂解电压为12 V;在化合物的定量分析中,采用多反应监测(MRM)方式,母离子均为加氢离子[M+H]+,子离子均为脱糖苷的苷元离子,杨梅素糖苷类化合物的子离子均为m/z 319,槲皮素糖苷类化合物的子离子均为m/z 303,山柰素糖苷类化合物的子离子均为m/z 287。
2 结果与讨论
2.1 色谱分离
茶叶成分复杂,对茶汤滋味和色泽起重要作用的非挥发性组分包含糖类、氨基酸类、有机酸类、儿茶素类、黄酮醇糖苷类、茶黄素类等化合物,为了有效地进行组分分离,应当选择较长的色谱柱。实验中采用粒径为1.7 μm、柱长为150 mm 的色谱柱,各组分得到了较好的分离;实验也比较了流动相的有机相分别为甲醇和乙腈的洗脱情况,对选定的色谱柱,使用甲醇洗脱时系统压力超过69 MPa,因此实验中采用乙腈进行洗脱。在优化的色谱条件下,选定的黄酮醇糖苷类化合物在12 ~18.5 min 之间全部洗脱出来,对应的色谱图见图2,各组分的保留时间见表2。

图2 绿茶和红茶中15 种黄酮醇糖苷类化合物的色谱图(检测波长:370 nm)Fig.2 UPLC chromatograms of the 15 flavonol glycosides in green tea and black tea (detection wavelength:370 nm)

表2 绿茶和红茶中黄酮醇糖苷类化合物的含量(n=2)Table 2 Contents of flavonol glycosides in green tea and black tea (n=2)
2.2 茶叶中黄酮醇糖苷类化合物的识别
对茶叶中黄酮醇糖苷类化合物的识别尽量通过相应的标准品进行比对确认,如色谱保留时间、一级和二级质谱等参数;对无法得到市售标准品的一些化合物,参考紫外吸收光谱,通过相对分子质量及二级质谱碎片离子进行结构解析,与其结构相似的化合物进行比较,并与参考文献进行比对确认。
如峰7、9、10、13 和15,其色谱保留时间、相对分子质量和二级质谱碎片离子在相同的实验条件下,均与其对应的标准品相似,因此可分别识别为Q-GRh、Q-Ga、Q-G、K-GRh 和K-G。
峰1、2 和3,其对应的分子离子峰[M+H]+分别为m/z 627、481 和481,初步判断为M-GRh、M-Ga和M-G,测定的相对分子质量与其理论相对分子质量相匹配;峰1 的特征子离子碎片为m/z 465 和319,分别为失去葡萄糖的碎片离子[M-G]+和失去芸香糖(葡萄糖+鼠李糖)的碎片离子[M-G-Rh]+;峰2 和峰3 的特征子离子碎片为m/z 319,为失去半乳糖的碎片离子[M-Ga]+或失去葡萄糖的碎片离子[M-G]+。对黄酮醇糖苷化合物中含有葡萄糖或半乳糖的异构体,在反相液相色谱分离中,一般含半乳糖的黄酮醇糖苷化合物的色谱保留时间小于含葡萄糖的黄酮醇糖苷化合物的保留时间[4,12,13,15-17],因此可识别峰2 和3 分别为M-Ga 和M-G。
采用SPSS 16.0软件包进行统计分析,计量资料采用均数±标准差表示,组间比较采用t检验,计数资料采用频数及百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
峰14 的分子离子峰[M+H]+为m/z 449,初步判断为K-Ga,且测定的相对分子质量与其理论相对分子质量相匹配;其特征子离子碎片m/z 287,为失去半乳糖的碎片离子[M-Ga]+,且一级和二级质谱参数与其异构体K-G 一致,色谱保留时间小于KG,由此得到确认。相应的,峰12 和6 的分子离子峰[M+H]+分别为m/z 595 和611,其特征的子离子碎片分别为m/z 449/287 和m/z 465/303,分别为失去鼠李糖的碎片离子[M-Rh]+(m/z 449/465)和失去半乳糖及鼠李糖的碎片离子[M-Ga-Rh]+(m/z 287/303),并且二级质谱参数与其异构体K-GRh/G-GRh 极其相识,初步判断峰12 和峰6分别为K-GaRh 和G-GaRh,且测定的相对分子质量与其理论相对分子质量相匹配。
峰4/5 和8/11,其对应的分子离子峰[M+H]+分别为m/z 773/773 和757/757,初步判断为槲皮素三糖糖苷(Q-GaRhG/Q-GRhG)和山柰素三糖糖苷(K-GaRhG/K-GRhG),且测定的相对分子质量分别与其理论相对分子质量相匹配;峰4/5 和8/11,其特征的子离子碎片为m/z 611/465/303 和595/449/287,其中碎片m/z 611 和595 分别为槲皮素三糖糖苷及山柰素三糖糖苷失去一分子葡萄糖的碎片离子[M-G]+或失去一分子半乳糖的碎片离子[MGa]+;碎片m/z 465 和449 分别为槲皮素三糖糖苷及山柰素三糖糖苷失去一分子葡萄糖和一分子鼠李糖的碎片离子[M-GRh]+或失去一分子半乳糖和一分子鼠李糖的碎片离子[M-GaRh]+;碎片m/z 303和287 分别为槲皮素三糖糖苷及山柰素三糖糖苷失去两分子葡萄糖和一分子鼠李糖的碎片离子[MGRhG]+或失去一分子半乳糖、一分子鼠李糖和一分子葡萄糖的碎片离子[M-GaRhG]+。以QGRhG 为例,其对应的二级子离子谱图如图3 所示,m/z 773 为分子离子峰[M+H]+,m/z 611 为[MG]+碎片离子,m/z 465 为[M-GRh]+碎片离子,m/z 303 为[M-GRhG]+碎片离子。
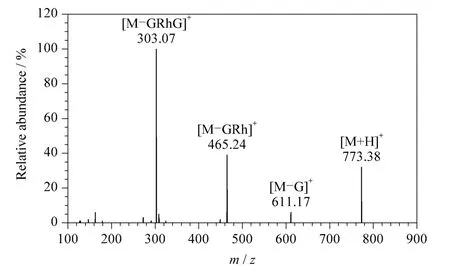
图3 Q-GRhG 的二级质谱图Fig.3 MS/MS spectrum of Q-GRhG
如表1 所示,黄酮醇糖苷类化合物连接不同种类及数量的糖苷,因此其色谱保留差异显著。由于糖链中的羟基具有极性,三糖糖苷类化合物的极性最大,在反相液相色谱中其保留最弱,其次为二糖糖苷,最后为单糖糖苷类化合物。对杨梅素、槲皮素及山柰素糖苷类化合物,均有类似的色谱保留规律,如M-GRh<M-Ga<M-G,Q-GaRhG<Q-GRhG<Q-GaRh<Q-GRh<Q-Ga<Q-G,K-GaRhG<K-GRhG<K-GaRh<K-GRh<K-Ga<K-G。另外,在黄酮醇母体结构的B 环中,杨梅素有3 个羟基,槲皮素有2 个羟基,山柰素有1 个羟基,因此,总体来讲,杨梅素、槲皮素及山柰素糖苷类化合物的保留时间递增;同时,对于糖苷类型相同的3 种黄酮醇糖苷化合物,其保留时间有如下规律:M-G(M-Ga)<Q-G(M-Ga)<K-G(MGa),M-GRh <Q-GRh<K-GRh,Q-GaRh<K-GaRh,Q-GRhG(Q-GaRhG)<K-GRhG(K-GaRhG)。其次,如前所述,含有葡萄糖或半乳糖的黄酮醇糖苷异构体化合物,含半乳糖的黄酮醇糖苷异构体的保留时间小于含葡萄糖的黄酮醇糖苷异构体的保留时间,可由槲皮素单糖糖苷的标准品进行证明,即Q-Ga<Q-G;因此,在同分异构体化合物,如峰2/3、4/5、6/7、8/11、12/13 以及峰14/15 的识别过程中,均认定保留时间较小的为含半乳糖的黄酮醇糖苷化合物。
2.3 茶叶中黄酮醇糖苷类化合物的定量方法
由于不易获得市售的黄酮醇糖苷类标准品,文献中对其定量多数采用相对定量的方法,如Price等[4]采用紫外检测方法,以黄酮醇苷元槲皮素和山柰素为标准品,对其他黄酮醇糖苷进行相对定量。由于茶叶组成化学成分复杂,各黄酮醇糖苷类化合物之间以及与其他干扰成分之间不能完全分离,并且茶叶中黄酮醇糖苷类化合物含量较低,特别是槲皮素和山柰素等游离苷元的含量非常低,在紫外检测方法定量中以此作为标准品对其他黄酮醇糖苷的定量会造成较大的误差。鉴于质谱的高灵敏度和高选择性,同时由于本文研究的几种黄酮醇糖苷的同分异构体化合物均具有良好的色谱分离性能,因此,本文采用MRM 方式进行定量,母离子均采用加氢离子峰[M+H]+,子离子均为脱糖苷的苷元离子。
由于一些黄酮醇糖苷化合物无市售的标准品,本文采用相对定量的方法,即以Q-GRh 为标准品,配制不同浓度的标准工作溶液,外标法准确定量茶叶中的Q-GRh 含量;茶汤中其他黄酮醇糖苷类化合物的含量根据各自的峰面积和茶叶中Q-GRh 的峰面积和含量进行确定(见式(1))。

式(1)中,Cj表示茶汤中其他黄酮醇糖苷化合物的含量,Ci表示茶汤中Q-GRh 的含量;Aj表示茶汤中其他黄酮醇糖苷化合物的峰面积,Ai表示茶汤中QGRh 的峰面积;Mj表示其他黄酮醇糖苷化合物的相对分子质量,Mi表示Q-GRh 的相对分子质量;Fj表示其他黄酮醇糖苷化合物相对于Q-GRh 的摩尔响应系数。由于无法得到所有黄酮醇糖苷类化合物的标准品,无法准确测定黄酮醇糖苷类化合物的质谱响应差异,因此本文均假定其他黄酮醇糖苷化合物的质谱响应与Q-GRh 一致,即各黄酮醇糖苷类化合物的Fj均等于1。
同时考虑茶汤样品制备及稀释的影响,茶叶中黄酮醇糖苷类化合物的含量按式(2)进行计算。

2.4 茶叶中黄酮醇糖苷类化合物的含量及分布
对1.2.2 节制备的绿茶及红茶样品,采用1.2.3 节及1.2.4 节的色谱-质谱方法进行分析,采用2.3 节的定量方法进行计算,绿茶及红茶中黄酮醇糖苷类化合物的含量如表2 所示,结果以两次测定的平均值及标准偏差(SD)来表示。
由表2 可知,绿茶和红茶中黄酮醇糖苷类化合物的含量并不一致,其含量分布如图4 所示。绿茶中黄酮醇糖苷类化合物的总量为8 048.6 mg/kg,红茶中黄酮醇糖苷类化合物的总量为4 628.3 mg/kg,绿茶中的黄酮醇糖苷总量是红茶的1.7 倍。Wu 等[7]指出,除茶叶品种外,茶叶生长环境、采摘时间、加工工艺、贮藏条件等都会对茶叶中黄酮醇糖苷类化合物的分布和含量有一定的影响。绿茶中含量较高的黄酮醇糖苷类化合物是M-Ga、M-G、Q-GaRhG、Q-GRhG、K-GaRhG 和K-GRhG,其含量占总黄酮类化合物的72.2%,而红茶中含量较高的黄酮醇糖苷类化合物是Q-GRh、Q-G、K-GRh 和K-Ga,其含量占总黄酮的70.6%。
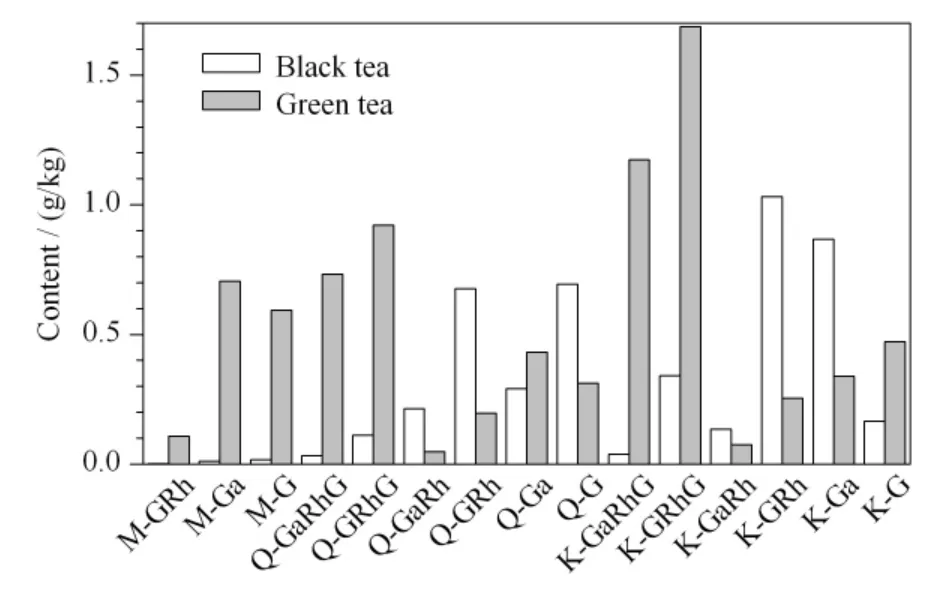
图4 绿茶和红茶中黄酮醇糖苷化合物的含量分布Fig.4 Content distributions of flavonol glycosides in green tea and black tea
绿茶和红茶中杨梅素总糖苷、槲皮素总糖苷和山柰素总糖苷的含量分布也不尽相同。在绿茶中,杨梅素总糖苷、槲皮素总糖苷和山柰素总糖苷的含量分别占总黄酮醇糖苷含量的17. 5%、32. 8% 和49.7%;在红茶中,其比例分别为0.7%、43.6% 和55.7%。结果如图5 所示。
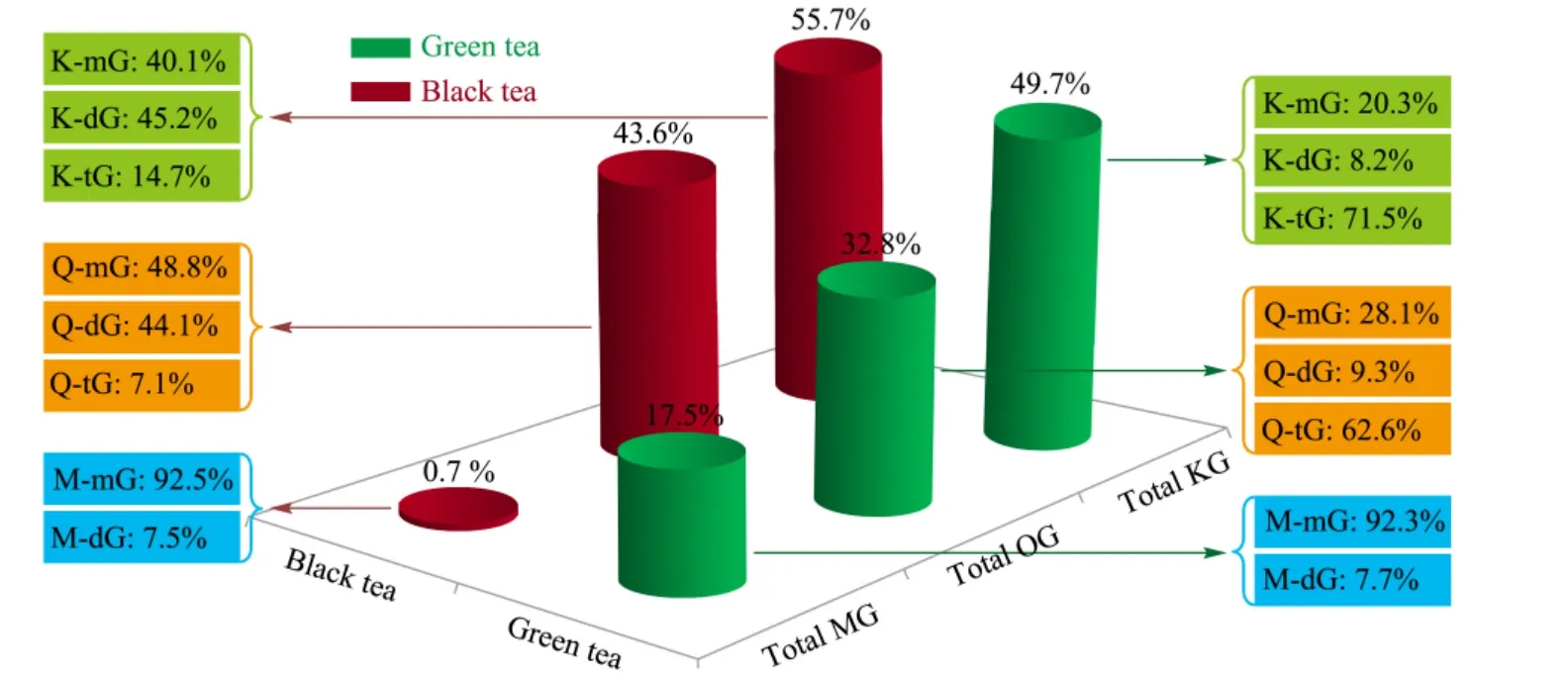
图5 绿茶和红茶中杨梅素、槲皮素及山柰素单糖糖苷、二糖糖苷及三糖糖苷总量的分布Fig.5 Distributions of mono-glycosides (mG),di-glycosides (dG)and tri-glycosides (tG)of myricetins (M),quercetins (Q)and kaempferols (K)in green tea and black tea
绿茶和红茶中黄酮醇单糖糖苷、二糖糖苷及三糖糖苷以及各种黄酮醇糖苷类化合物的含量分布也有差异。绿茶和红茶中杨梅素黄酮醇单糖糖苷总量占其杨梅素总糖苷的比例基本一致,均为92.5% 左右;绿茶和红茶中二糖糖苷占其杨梅素总糖苷的比例也大致相同,约占7.5%。对于槲皮素黄酮醇糖苷,绿茶和红茶中单糖糖苷总量、二糖糖苷总量及三糖糖苷总量分别占其槲皮素总糖苷的比例相差较大,如绿茶中,二糖糖苷总量占到槲皮素总糖苷的9.3%,三糖糖苷总量占62.6%;而红茶中,两者的比例分别为44.1% 和7.1%;显示出较大的差异。对于山柰素黄酮醇糖苷,绿茶和红茶中单糖糖苷总量、二糖糖苷总量及三糖糖苷总量的分布也有相似的特点。虽然黄酮醇类化合物的个体含量差异巨大,但在绿茶或红茶中,槲皮素单糖糖苷总量占其槲皮素总糖苷的比例以及山柰素单糖糖苷总量占其山柰素总糖苷的比例基本一致,在绿茶中其比例分别为28.1% 和20.3%,在红茶中其比例分别为48.8% 和40.1%;槲皮素和山柰素二糖糖苷总量及三糖糖苷总量占其总糖苷的比例在绿茶或红茶中的分布也有类似的规律,如槲皮素和山柰素二糖糖苷总量占糖苷的比例在绿茶中分别为9.3% 和8.2%,在红茶中分别为44.1% 和45.2%;槲皮素和山柰素三糖糖苷总量占糖苷的比例在绿茶中分别为62.6% 和71.5%,在红茶中分别为7.1% 和14.7%。
3 结论
本文建立了超高效液相色谱-二极管阵列检测-串联四极杆质谱测定茶叶中黄酮醇糖苷类化合物的方法。通过与标准品比对、色谱保留规律的探讨以及一级和二级质谱碎片离子的结构解析,鉴定了绿茶和红茶中的15 种黄酮醇糖苷类化合物,包括3 种杨梅素糖苷、6 种槲皮素糖苷和6 种山柰素糖苷类化合物。含量测定采用串联四极杆质谱检测方法,以Q-GRh 为标准品外标法进行定量,其他黄酮醇糖苷以Q-GRh 为标准品进行相对定量。结果表明绿茶和红茶中黄酮醇糖苷类化合物的含量和分布差异显著,所建立的方法可以快速鉴定和测定茶叶中的黄酮醇糖苷类化合物,对茶叶化学成分研究、制茶工艺改进、茶汤滋色研究、黄酮醇糖苷类化合物的制备及其功效研究等具有重要意义。
[1] Senanayake N J. Funct Foods,2013,5(4):1529
[2] Pinto M S. Food Res Int,2013,53(2):558
[3] Peterson J,Dwyer J,Bhagwat S,et al. Food Compos Anal,2005,18(6):487
[4] Price K R,Rhodes M J,Barnes K A. J Agric Food Chem,1998,46(7):2517
[5] Scharbert S,Hofmann T. J Agric Food Chem,2005,53(13):5377
[6] Jiang H Y,Engelhardt U H,Thrane C,et al. Food Chem,2015,183(1):30
[7] Wu C Y,Xu H R,Heritier J,et al. Food Chem,2012,132(1):144
[8] Zhang W B,Wang Z C,Zhang L Y. Chinese Journal of Analytical Chemistry (张维冰,王智聪,张凌怡. 分析化学),2014,42(3):415
[9] Zhang L Y,Wang Z C,Zhang W B. Chinese Journal of Chromatography (张凌怡,王智聪,张维冰. 色谱),2013,31(2):122
[10] Souza L M,Cipriani T R,Serrato R V,et al. J Chromatogr A,2008,1207(1/2):101
[11] Zhang L,Li N,Ma Z Z,et al. J Agric Food Chem,2011,59(16):8754
[12] Hooft J J,Akermi M,Yelda F,et al. J Agric Food Chem,2012,60(36):8841
[13] Dou J,Lee V S,Tzen J T,et al. J Agric Food Chem,2007,55(18):7462
[14] Yang Z Y,Tu Y Y,Baldermann S,et al. Food Sci Technol Int,2009,42(8):1439
[15] Zhao Y,Chen P,Lin L Z,et al. Food Chem,2011,126(3):1269
[16] Lin L Z,Harnly J M. J Agric Food Chem,2007,55(4):1084
[17] Lin L Z,Chen P,Harnly J M. J Agric Food Chem,2008,56(17):8130
[18] Zhang W B,Wang Z C,Zhang L Y. Chinese Journal of Analytical Chemistry (张维冰,王智聪,张凌怡. 分析化学),2013,41(12):1851
[19] Chen H,Zuo Y Y. Food Chem,2007,101(4):1357
[20] Vrhovsek U,Masuero D,Palmieri L,et al. J Food Compos Anal,2012,25(1):9
[21] Zhang R T,Chen J H,Shi Q,et al. Food Res Int,2014,56(1):47

