低共熔溶剂——新型亲水作用色谱流动相改性剂
谭 婷, 乔 鑫, 万益群, 邱洪灯*
(1. 中国科学院兰州化学物理研究所,甘肃 兰州730000;2. 南昌大学,食品科学与技术国家重点实验室,江西 南昌330047)
亲水作用色谱(HILIC)在1990 年由Alpert 提出并命名,所采用的为强极性固定相,通常以水和高含量的有机溶剂(通常是乙腈)为流动相。由于强极性化合物在高含量有机溶剂的流动相体系中有合适的保留和分离性能,HILIC 也因此成为反相液相色谱(RPLC)的补充,因此HILIC 近年来受到了广泛的关注和重视[1,2]。有机相的比例是影响样品在固定相上保留行为的最主要因素,例如乙腈含量的增加会显著增加组分的保留因子。一般采用乙腈-水体系作为流动相,其中水相的比例为5% ~40%,以保证其显著的亲水作用。在HILIC 分离模式中,流动相中的水是强洗脱溶剂。
低共熔溶剂(deep eutectic solvents,DESs)是一类具有比单个纯组分更低熔点的离子型溶剂,与离子液体有很多相似的性质,具有更为绿色环保、不易挥发、可降解、价格低廉、材料易于制备等特点[3]。低共熔溶剂作为具有良好溶解性能的溶剂被广泛应用于有机合成、电化学、色谱分离分析以及复杂样品前处理等方面,并展现了很好的应用前景[3-5]。Abbott 等[6-8]最早开始并深入系统地研究了一系列胆碱类低共熔溶剂的性质及应用。Xu等[9]将DESs 用于双水相体系中的蛋白质萃取。我们课题组建立了基于DESs 的超声辅助单滴微萃取方法并应用于模拟油中酚类化合物的萃取[10]。Tang 等[11,12]对DESs 在化学学科及萃取分离的应用方面做了详细的综述。Zhao 等[13,14]就DES 在生物柴油的制备和应用方面有详细的阐述。DESs 还可以用作色谱固定相制备新方法中的反应媒介[15]。
目前我们未见DESs 在HILIC 中的应用研究报道。基于DESs 优异的物理化学性质,本文将其用作HILIC 流动相的改性剂,建立了一个新型的无水条件下的HILIC 模式,并考察了不同比例的DES-乙腈条件下,几种碱基与核苷的色谱行为。与传统水相流动相条件相比,将DESs 用作HILIC 的流动相改性剂,可显著提高目标分析物的色谱分离效果,为DESs 应用领域的拓展提供新的思路。
1 实验部分
1.1 仪器和试剂
仪器:Agilent 1260 高效液相色谱仪(美国Agilent 公司),配备G1311C 型四元梯度泵、G1315D 型二极管阵列检测器、带有20 μL 定量环的手动进样器和Revision B.04.03 色谱工作站;Direct-Q 3UV纯水系统(美国Millipore 公司)。
试剂:氯化胆碱(纯度98%,国药集团化学试剂有限公司);乙二醇(分析纯,天津医药化学有限公司);乙酸铵(纯度98%,西陇化工有限公司);甲醇、乙腈(ACN)(色谱纯,美国MREDA 公司);配制流动相及溶液均采用Millipore 纯水系统制备的超纯水。尿嘧啶、6-氯脲嘧啶、腺苷、次黄嘌呤、胞嘧啶和胞苷均为生化试剂(上海国药集团化学试剂有限公司),结构式见表1。
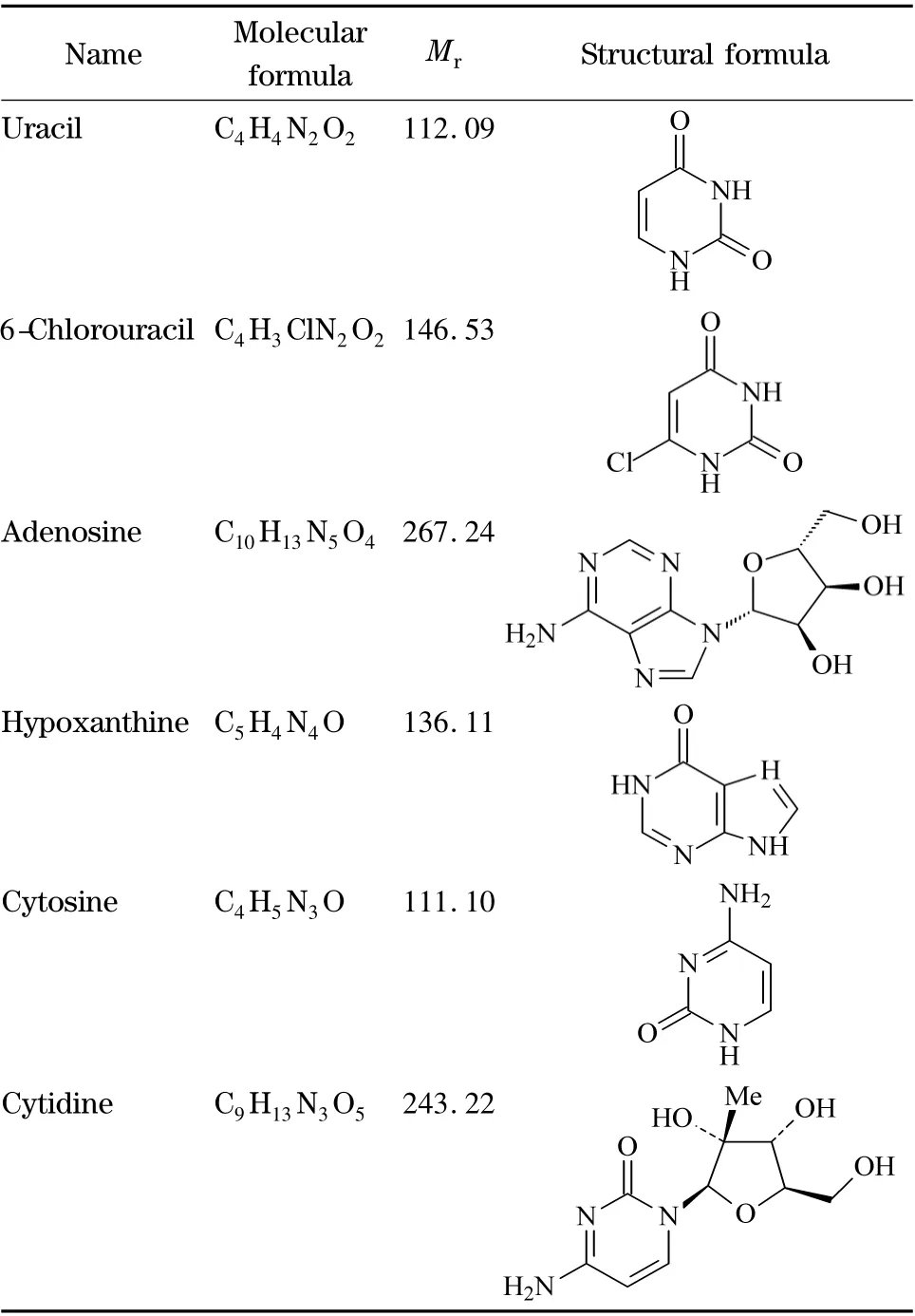
表1 碱基与核苷的结构式Table 1 Structural formulae of nucleobases and nucleosides
1.2 实验方法
1.2.1 DES 的制备
称取适量的氯化胆碱和乙二醇(摩尔比为1 ∶3),置于250 mL 圆底烧瓶中,在80 ℃油浴中磁力搅拌0.5 h,直至形成均一、澄清、透明的溶液,即得到由氯化胆碱和乙二醇组成的DES,在室温下为无色透明液体。
1.2.2 流动相的配制
分别量取一定体积的DES 和乙腈,混合均匀后经0.22 μm 微孔有机滤膜过滤,再超声脱气,得到分别为2.5%、5.0%、7.5% 和10% (v/v)的DES 乙腈溶液,作为亲水作用色谱的新型流动相体系。
1.2.3 分离条件
色谱柱:实验室自制硅胶柱(150 mm×4.6 mm),其中硅胶(粒径3 μm,比表面积400 m2/g)产自兰州化学物理研究所;柱温:25 ~50 ℃,如没有特殊说明,则控制在25 ℃;流动相为1.2.2 节配制的不同比例的DES-乙腈混合溶液;检测波长:254 nm;流速:1.0 mL/min;进样体积:5 μL。
2 结果与讨论
2.1 分离效果
以4 种碱基和2 种核苷为分析物,考察了DES用作流动相改性剂后的色谱分离效果,并与传统水相流动相条件下的分离效果进行了对比,结果如图1 所示。当采用乙腈-20 mmol/L 乙酸铵水溶液(95 ∶5,v/v)为流动相时,尿嘧啶与6-氯脲嘧啶、胞嘧啶与胞苷均不能有效分离(见图1b);当乙腈中加入5% (v/v)DES 后,6 种分析物在60 min 内分离效果有显著的提高(见图1a),尤其是胞嘧啶与胞苷能达到完全分离,有效解决了传统水相流动相的分离困难。

图1 (a)DES 改性流动相与(b)传统水相流动相条件下色谱分离效果的比较Fig.1 Comparison of the separations between (a)DES based mobile phase and (b)water-based mobile phase
2.2 DES 浓度的影响
在常规的亲水作用色谱中,由于水是强洗脱溶剂,水或水溶液的比例直接影响极性化合物在色谱柱中的分离效果与保留因子。在本研究中,采用DES 代替水相应用到亲水作用色谱中。改变流动相中DES 的比例,考察了6 种碱基和核苷在硅胶柱中的色谱保留能力。如图2 所示,当DES 的体积分数为2.5% 时,6 种碱基和核苷有较好的分离效果;随着DES 比例的增加,6 种碱基和核苷的保留都有所降低,其中尿嘧啶的降低幅度最小,胞苷的降低幅度最大。说明在采用DES-乙腈作流动相时,核苷和碱基在硅胶柱中的保留符合亲水作用色谱保留模式,而且DES 是该色谱模式中的强洗脱溶剂。
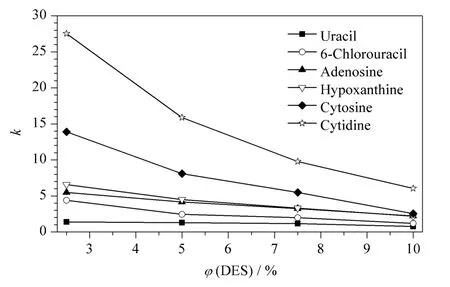
图2 流动相中DES 的体积分数对分离效果的影响Fig.2 Effect of volume percentage of DES in mobile phase on the separation
2.3 柱温的影响
DES 的黏度往往比常规的有机溶剂和水的黏度要大,柱温的改变会对流动相的黏性、分析物的溶解性及保留特性有一定的影响。以5% (v/v)DES乙腈溶液为流动相,考察了柱温的变化对6 种碱基和核苷保留效果的影响。如图3 所示,柱温在25 ~50 ℃范围内,6 种碱基和核苷能在60 min 内有较好的保留和分离效果;但随着柱温的增加,其保留均有不同程度的减小,其中对尿嘧啶的保留影响最小,而胞苷保留时间的减小最为显著。
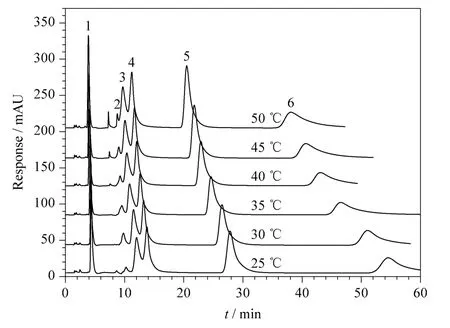
图3 柱温对分离效果的影响Fig.3 Effect of column temperature on the separation
3 结论
本文尝试了在亲水作用色谱模式中,以低共熔溶剂和乙腈体系为流动相,考察了6 种碱基和核苷在硅胶柱中的色谱行为,并初步考察了DESs 的浓度和柱温对分析物的分离效果和保留因子的影响,证实低共熔溶剂可作为亲水作用色谱流动相的改性剂。其保留机理和详细工作还有待进一步的研究,但是以低共熔溶剂作为流动相改性剂的亲水作用色谱有望在未来得到一定的特殊应用,可解决某些分离难题。
[1] Zhu W X,Yang J Z,Yuan P,et al. Chinese Journal of Chromatography (祝伟霞,杨冀州,袁萍,等. 色谱),2013,31(10):934
[2] Wang H,Xue Y,Lu Y F,et al. Chinese Journal of Chromatography (汪慧,薛芸,鲁阳芳,等. 色谱),2015,33(3):215
[3] Zhang Q,De Oliveira Vigier K,Royer S,et al. Chem Soc Rev,2012,41(21):7108
[4] Carriazo D,Serrano M C,Gutiérrez M C,et al. Chem Soc Rev,2012,41:4996
[5] Guo W J,Hou Y C,Wu W Z,et al. Green Chem,2013,15:226
[6] Abbott A P,Capper G,Davies D L,et al. Chem Commun,2003,1:70
[7] Abbott A P,Boothby D,Capper G,et al. J Am Chem Soc,2004,126:9142
[8] Smith E L,Abbott A P,Ryder K S. Chem Rev,2014,114:11060
[9] Xu K,Wang Y,Huang Y,et al. Anal Chim Acta,2015,864:9
[10] Gu T,Zhang M,Tan T,et al. Chem Commun,2014,50:11749
[11] Tang B K,Row K H. Monatsh Chem,2013,144:1427
[12] Tang B K,Zhang H,Row K H. J Sep Sci,2015,38:1053
[13] Zhao H,Zhang C,Crittle T D. J Mol Catal B-Enzym,2013,85/86:243
[14] Zhao H,Baker G A. J Chem Technol Biot,2013,88:3
[15] Gu T,Zhang M,Chen J,et al. Chem Commun,2015,51:9825

