苹果树内生真菌抗腐烂病和炭疽病活性菌株的筛选
邓振山, 陈 苗, 张伟民, 贺晓龙
(延安大学 生命科学学院,陕西 延安 716000)
苹果树内生真菌抗腐烂病和炭疽病活性菌株的筛选
邓振山, 陈 苗, 张伟民, 贺晓龙
(延安大学 生命科学学院,陕西 延安 716000)
为了明确苹果树中内生真菌的种类及其对苹果树腐烂病菌和苹果树炭疽病菌的抑制作用, 对健康富士苹果树茎部和根部中的内生真菌进行了分离和初步鉴定,并采用组织块分离法和平板对峙法筛选出对苹果树腐烂病菌和炭疽病菌有明显抑制效果的拮抗菌,进一步研究了其发酵液对病原菌的抑制效果。结果表明,从筛选出的49株内生真菌中,8株对苹果树腐烂病和炭疽病病原菌有明显抑制效果,最高抑菌率达到83.93%;拮抗菌发酵液的平均抑菌率均在89%以上,最高达98.81%。且在同等条件下,拮抗菌对病原菌抑菌率比化学药剂高50%左右。该研究为新型生物农药的开发和利用提供参考。
苹果树;内生真菌;苹果树腐烂病;苹果树炭疽病;拮抗活性
苹果树腐烂病和炭疽病是危害果园的两大病害。苹果树腐烂病是由苹果黑腐皮壳菌(ValsamaliMayabeetYamada)引起的一种苹果树枝干皮层腐烂病害[1]。该病病原菌主要侵染果树枝干、主干、果实等部位,造成树势衰弱,苹果品质和产量下降,严重时甚至可造成毁园[2]。苹果树炭疽病病原菌(Glomerellacingulata)主要危害果实,也侵染果苔和枝条。果实受侵时,在果面出现淡褐色至红褐色小斑,扩展后变褐色或黑褐色圆斑,凹陷,边缘清晰,剖切后可见病斑下面变褐呈锥形向果肉内腐烂,病斑下果肉局部坏死,病果易脱落成为黑色僵果[3]。枝条发生较少,在弱枝或病虫枝的基部寄生,最初在皮层下形成不规则的褐色病斑,后扩大成溃疡,严重时溃疡部以上枝条干枯[4]。果苔受侵后,从顶部开始发病,病部呈暗褐色,并逐渐扩大,果苔常不能抽出副稍而枯死[4]。目前,我国苹果树腐烂病和炭疽病的防治主要依靠喷施化学杀菌剂,但现今使用的化学药剂均因难以渗透进入果树木质部而不能有效控制病害[5],且长期使用化学杀菌剂,会引起病原菌抗药性增强、环境污染和果品农药残留等严重问题。植物内生菌是指其生活史的某一段时期生活在健康植物组织内部,不引起植物组织明显侵染及症状改变的一类菌[6]。内生菌防病机制有拮抗作用、与病菌竞争生态位和营养物质、寄生作用、促进寄主植物生长、提高寄主植物的抗逆能力、诱导植物产生抗性等[7]。有关研究表明,从植物根、茎、叶、果实等分离到的植物内生菌,存在普遍的抗菌活性[8]。植物内生菌能促进寄主植物生长,增强其抗病能力,并通过与病原菌争夺营养物质和空间来抑制病原菌的生长,甚至产生一些抗生素类和水解酶类等物质影响病原菌的正常生长,最终导致其死亡。所以利用内生拮抗菌防治植物病害已成为一种有效且绿色环保的病害防治途径。赵增峰等[9]建议通过试验各种新型低毒药剂,研制内吸性治疗药剂,使苹果树腐烂病的防治有根本性转变。利用内生菌防治苹果树腐烂病和炭疽病已有报道,王彩霞[10]、张淑颖[11]、郜佐鹏[12]等先后从苹果树根际土壤、剑麻叶片组织、黄瓜和辣椒根部等部分分离获得内生菌,研究内生菌及其无菌发酵滤液对苹果树腐烂病菌的防治作用;邓振山等[13]研究了银杏内生真菌对苹果树腐烂病菌的抑制作用,发现分离到的16株内生真菌中有4株与病原菌之间的抑菌带非常明显。但利用健康苹果树内生真菌来同时防治苹果树腐烂病和炭疽病的研究尚鲜有报道,鉴于此,本文主要从健康苹果树的茎部和根部筛选出对苹果树腐烂病与炭疽病有明显抑制效果的拮抗真菌,并研究其次生代谢物的抑制作用,以期为抑制苹果树腐烂病与炭疽病研究新药物和寻找新方法提供依据。
1 材料与方法
1.1 材料
1.1.1 植株样品采集 于2013年在延安市枣园苹果示范区采集样品,采集健康果树的根部和茎部,样品用灭过菌的牛皮纸袋收集,置于4 ℃冰箱保存备用。
1.1.2 供试指示病原菌 苹果树腐烂病病原菌(Valsaceratosperma)和苹果树炭疽病病原菌(Glomerellacingulata)均由延安大学生命科学学院微生物实验室鉴定并提供。
1.1.3 供试培养基及药剂 培养基:①PDA培养基;②马丁氏琼脂培养基(Martin);③高氏一号培养基;④30%ABA培养基:苹果树树皮300 g(树皮煮沸取汤汁),琼脂20 g,水1 000 mL。化学药剂:农得益辛菌胺醋酸盐400 g(山东济南章丘刁镇工业园生产)购自延安市马家湾农科所。
1.2 方法
1.2.1 内生菌的分离和纯化 将新鲜苹果树的根部和茎部样品清洗干净,晾干后用无菌刀片栽成0.5 cm×0.5 cm 的小块,置于75%乙醇中浸泡30 s,再用4%次氯酸钠表面消毒3~5 min后,放入灭菌水中冲洗4次,每次至少1 min,用灭菌滤纸吸干多余水分后,分别置于PDA培养基、30% ABA培养基、高氏一号培养基和马丁培养基制成的平板中,每个平皿3块,每个处理3次重复,28 ℃黑暗条件下恒温静置培养5~6 d,采用菌丝尖端挑取法分离长出的内生真菌。根据菌丝颜色、形态以及长出的先后顺序,挑取组织切口处长出的菌丝转接到新的各培养基上培养,反复纯化直至获得单一菌株,斜面保存并编号备用。为了验证材料表面消毒是否彻底,以最后一次冲洗的灭菌水涂布在相应的各培养基上置于同样条件下培养,验证组织表面消毒情况。
1.2.2 拮抗菌株的筛选 采用平板对峙法在平板上筛选对苹果树腐烂病和炭疽病有拮抗作用的内生菌。以苹果树腐烂病和炭疽病病原菌为靶标,分别在含有25 mL PDA的平板(直径90 mm)中央放置直径为6 mm的生长旺盛的腐烂病菌和炭疽病菌菌饼,在其四周接种筛选出的生长旺盛的内生菌菌饼,每个菌饼距离中央2.8 cm,每个处理3次重复,以平板中央仅放6 mm病原菌饼圆盘为对照,28 ℃恒温培养72 h后,采用十字交叉法测量对照组直径(D)和处理组直径(d),计算抑菌率。
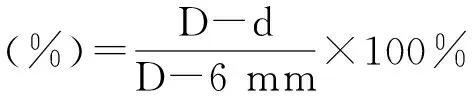
1.2.3 拮抗菌发酵液对病原菌的抑菌作用 选择在平板对峙法试验中抑菌效果较好的拮抗内生菌培养72 h后,用直径为6 mm的打孔器打取一个菌饼,接种环挑至100 mL PDA液体培养基中,置于旋转式摇床上180 r/min、28 ℃ 培养72 h制备拮抗菌发酵液。发酵液经5 000 r/min离心 10 min后,取上清液用0.22 μm滤膜过滤。将融化的PDA与收集的拮抗菌发酵液分别混合,摇匀,配成培养滤液含量为2%的混合液,倒入培养皿中制成平板,待其凝固后,在中央放置1个直径6 mm的病原菌菌饼,以无菌水与PDA制成的平板为对照,每处理3次重复,放入28 ℃培养箱中培养72 h后,采用十字交叉法测量对照组直径(D)和处理组直径(d),计算抑菌率(公式同上)。
1.2.4 化学杀菌剂对病原菌的抑制效果 将化学杀菌剂在药剂建议使用倍数下,分别稀释50、60、70、80、90和100倍。采用改良平板对峙法[14]研究化学药剂对苹果树病原菌的抑制效果。将灭菌后稍冷却的30 mL PDA培养基倒入培养皿中制成平板,用6 mm打孔器在平板中央打孔,将所配制的不同浓度梯度化学药剂倒入孔中与平板持平,在孔四周分别接种4个生长旺盛的直径为6 mm苹果树腐烂病菌和炭疽病菌菌饼,每个菌饼与孔中心相距2.8 cm,放入28 ℃培养箱中培养,以加灭菌水的处理为对照,每个处理重复3次,28 ℃恒温箱中培养72 h后,采用十字交叉法测量对照组直径(D)和处理组直径(d),计算抑菌率,根据统计学直线回归方程,求出供试化学药剂的毒力方程。平板法混合化学药剂参照1.2.3中拮抗菌发酵液对病原菌抑制作用的方法,将不同稀释倍数的化学药剂与PDA培养基混合制成平板,无菌水与PDA培养基混合作为对照,研究化学药剂对苹果树病原菌的抑制效果,计算抑菌率(公式同上)。
1.2.5 数据处理 实验数据采用SPSS 21.0进行统计学分析。
2 结果与分析
2.1 内生菌株的分离与筛选
利用4种不同的培养基,从苹果树健康部位的根系和茎中经分离和纯化,共筛选到49株内生真菌。不同培养基分离到的内生真菌的种类有明显差异,ABA和马丁氏培养基分离得到的内生真菌的种类多于PDA,ABA培养基不同部位真菌的种类和数量也存在差别,其中茎部分离的菌株数最多为29株,其次是根部为20株。通过形态学对内生真菌进行了初步鉴定,分离得到的内生真菌分属3个属:链格孢属(Alternariasp.)、 茎点霉属(Phomasp.)和球壳孢属(Sphaeropsissp.)。其中链格孢属在苹果树的根部和茎部中均存在,为优势的内生真菌菌株。
2.2 拮抗菌株的筛选
通过平板对峙法的筛选,获得8株对苹果树腐烂病、炭疽病病原菌的抑菌率均达到50% 以上的菌株,编号依次为G1、J9、J2、G9、J11、J16、J17和T1(见表1)。结果表明,这8株拮抗菌对苹果树腐烂病和炭疽病均有明显抑制效果,其中J2和J16对腐烂病抑菌效果显著,分别达到77.70%和65.54%;G7和J9对炭疽病的抑菌效果显著,抑菌率分别达到83.93%和79.17%(见图1),最终选取上述8株菌作为进一步研究的供试菌株。
2.3 拮抗菌发酵液的抑制效果
分别对选取的8株拮抗菌的发酵液活性进行测定,其对苹果树病原菌的抑菌率统计结果(见表2)表明,G1、J9、J2、G9、J11、J16这6种拮抗菌的发酵液对苹果树病原菌的抑菌效果高于拮抗菌本身,其发酵液抑菌率均在89%以上,最高达到98.81%。初步判定,拮抗菌的代谢物中存在某些可抑制苹果树病原菌生存生长的活性物质。T1拮抗菌对腐烂病和炭疽病的抑制效果均良好,但其发酵液对炭疽病抑制效果不明显;J17对腐烂病和炭疽病病原菌的抑菌率分别为65.54%和70.83%,但其发酵液的抑菌率却下降至63.38% 和45.24%,出现这种现象的原因可能是在菌株的液体震荡培养过程中,部分菌丝断裂或者代谢产物分解所造成的,也可能是由于培养过程中培养条件和环境不适合等原因造成的(见图2)。
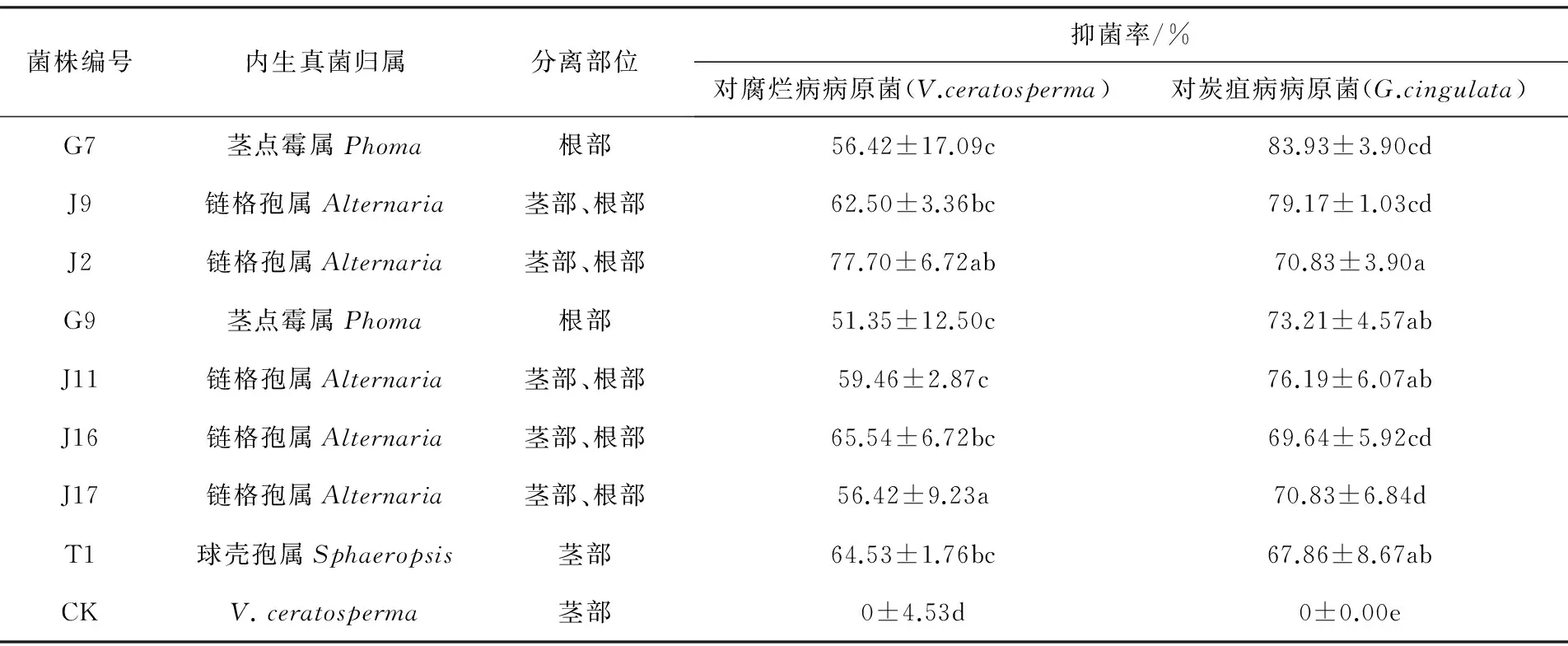
表1 苹果树拮抗真菌的筛选结果及其对苹果树腐烂病、炭疽病病原菌菌丝生长的抑制作用
注:表中数据为平均值±标准误,同列数据后相同字母表示经邓肯氏新复级差法检验在P<0.05水平差异不显著,表2同
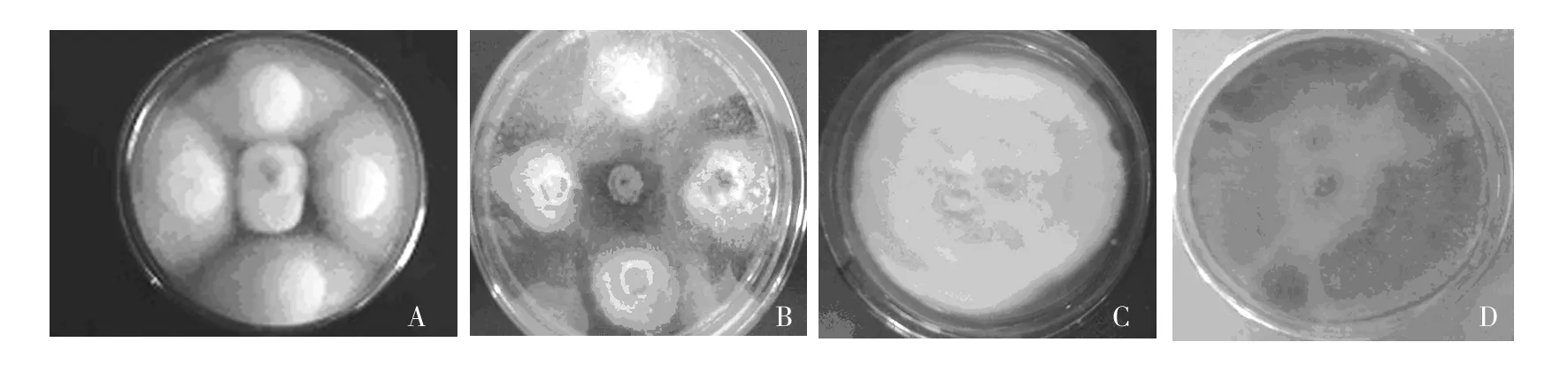
图1 拮抗真菌对苹果树腐烂病及炭疽病病原菌的拮抗作用Fig.1 The inhibitory effects of antagonistic fungus on V. ceratosperma and G. cingulata

菌株编号抑菌率/%对腐烂病病原菌(V.ceratosperma)对炭疽病病原菌(G.cingulata)菌株编号抑菌率/%对腐烂病病原菌(V.ceratosperma)对炭疽病病原菌(G.cingulata)G796.48±0.92ab98.51±0.52aJ1192.25±2.29b98.81±0.84aJ997.18±1.76a97.32±0.52aJ1697.89±1.12a89.29±1.46bJ295.77±1.32ab98.81±0.00aJ1763.38±3.26c45.24±8.25cG996.48±0.92ab98.51±0.52aT158.45±2.72d43.45±1.03cCK0±4.67e0±0.00dCK0±4.67e0±0.00d
2.4 化学药剂对病原菌的抑制效果
通过改良平板对峙法和药剂混合法分别测定了化学药剂不同稀释倍数对苹果树腐烂病和炭疽病病原菌的抑制作用,结果表明(表3),在药剂的建议倍数(50~100倍)下,不同稀释度有不同程度的抑制作用,相对拮抗菌及其发酵液对病原菌的抑菌率,一般化学药剂对病原菌的抑制效果不明显,尤其是对生长迅速的炭疽病病原菌,最大稀释浓度的抑菌率仅为42.67%。各浓度和抑菌率相关系数绝对值均接近1,表示各回归方程两变量线性关系密切。最小稀释倍数的化学药剂和拮抗菌发酵液的抑菌率见图3,由图3及药剂各毒力回归方程可知,若要达到拮抗菌发酵液相近的抑菌率,药剂的稀释倍数则在建议倍数外,对人体和环境有一定的危害。
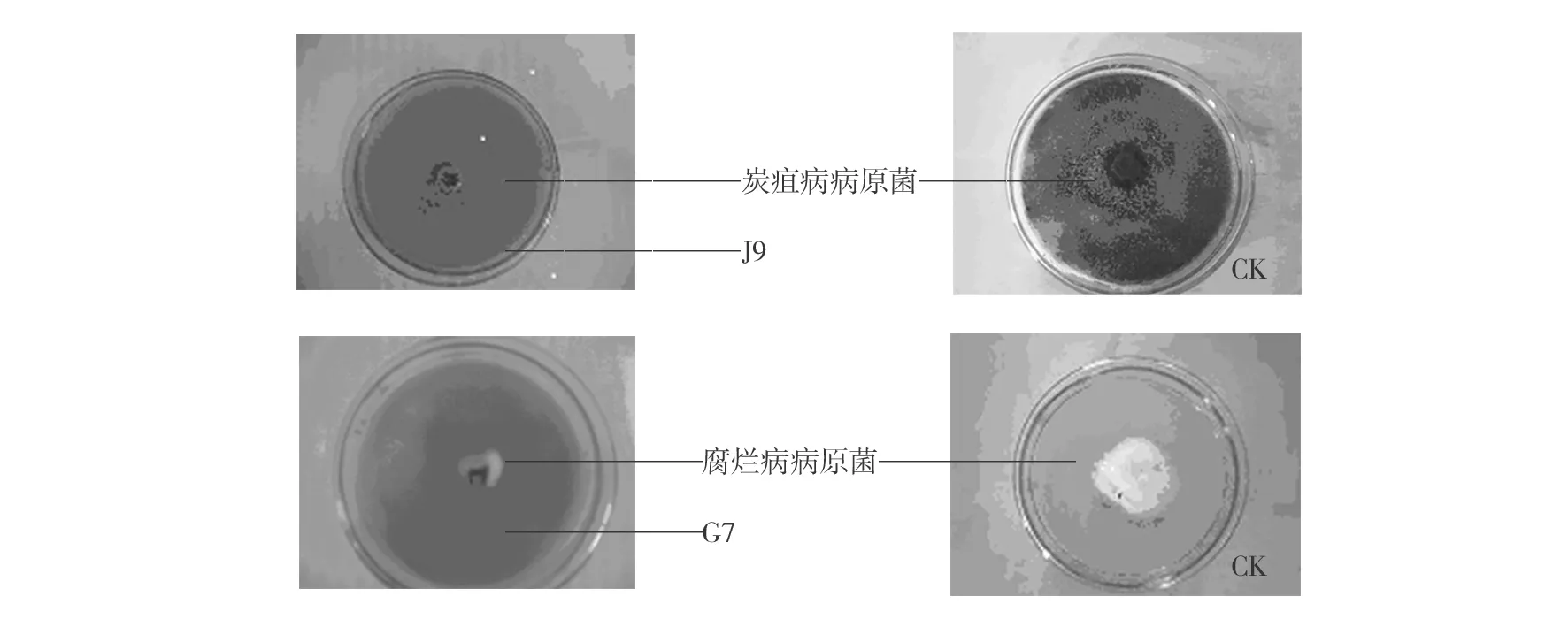
图2 拮抗菌发酵液对苹果树腐烂病、炭疽病病原菌的抑菌率Fig.2 Inhibition rates of ferment filtrate of antagonistic fungus on mycelial growth of V. ceratosperma and G. cingulata

处理方法药剂稀释浓度腐烂病病原菌(V.ceratosperma)炭疽病病原菌(G.cingulata)抑菌率/%相关系数毒力回归方程/y=a+bx抑菌率/%相关系数毒力回归方程/y=a+bx平板对峙法 100908070605017.3022.5923.5534.2935.6740.370.976601y=64.38952-0.47237x4.375.307.449.3010.1710.780.982507y=18.29048-0.1363x药剂混合法 100908070605016.8017.9023.2630.5743.2953.850.965591y=88.53-0.7678x10.2711.5526.3729.6833.4642.670.974625y=75.17524-0.66011x
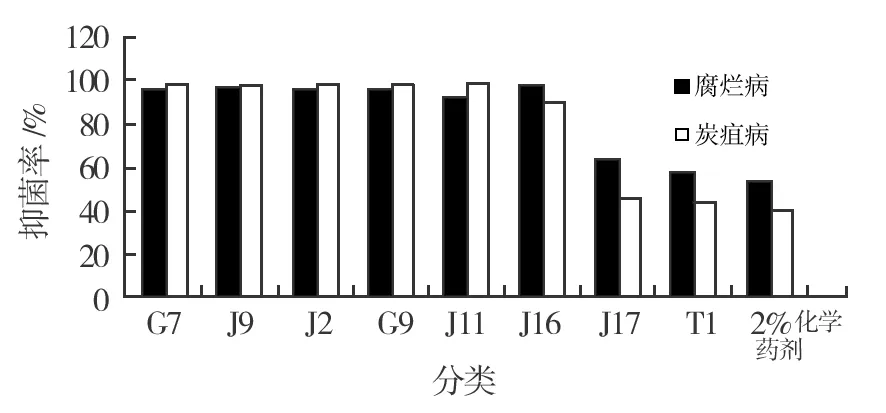
图3 拮抗菌发酵液及化学药剂对苹果树病原菌抑菌率Fig.3 The fermented liquid and chemical inhibition rate on apple tree pathogenic bacteria
3 讨 论
近年来,植物内生拮抗菌对苹果树腐烂病和炭疽病的研究取得了一些成效。颜霞等[15]研究内生放线菌Hhs-015对苹果树腐烂病病菌抑菌圈直径大于20 mm;王彩霞等[10]在植物根际土壤中筛选出细菌BJ1对苹果树炭疽病抑菌率在60%以上;张淑颖等[11]研究剑麻内生细菌 JM-3对炭疽病抑菌圈半径大于7.1 mm,其发酵液对苹果树腐烂病抑制效果显著。本研究主要从苹果树根和茎中筛选拮抗菌,通过对照一般化学药剂抑制效果,揭示了生物源杀菌剂的抑菌优势。结果表明,苹果树内生拮抗菌对苹果树病原菌具有很强的抑菌效果,且拮抗菌发酵液也能显著抑制病原菌生长,抑菌率平均达到89%以上。在同等条件下,拮抗菌发酵液的抑菌效果优于试验所用化学药剂,说明苹果树内生菌及其代谢产物可以作为生防治剂应用于苹果树腐烂病和炭疽病的防治。生产上推广的专门用于防治腐烂病的抑菌剂作用不显著[16],本研究中若要达到内生菌或其发酵液抑制效果,其浓度则会超出药剂的建议使用倍数,造成环境污染、果品药物残留等危害。
拮抗菌株平板对峙结果与其发酵液对苹果树腐烂病与炭疽病病原菌的生长抑菌率存在一定的差异,说明苹果树内生拮抗菌在发酵过程中能够产生抑制苹果树病原菌生长的活性物质,这与原犇犇等[17]研究生防放线菌及其发酵液对杨树腐烂病生长抑制率的结果相同,同时研究也表明某些植物内含有某些抗菌物质或诱导产生的植物防卫素,能够杀死或有效抑制某些病原菌的生长发育,且植物体内的抗菌化合物是植物体产生的多种具有抗菌活性的次生代谢产物,包含了生物碱类、类黄酮类、蛋白质类、有机酸类、酚类化合物和脂肽类物质等[18-19]。
由于本试验筛选出的菌种有限,某些抑制效果更好的内生菌可能未被发现,今后应该进一步扩大筛选数量。筛选出的菌株还需要通过田间试验来进一步确定试验结果,对抑菌活性物质的化学性质及结构等的研究也有必要做深层次的研究。目前,这项工作正在进一步完成中,这对于新生物源抑菌剂的研究具有重要意义。
[1] Wang XL, Liu JL, Huang LL, et al. Re-evaluation of pathogens causingValsacankeron apple in China[J]. Mycologia, 2011, 103(2): 317-324.
[2] 王树桐, 张凤巧, 曹克强. 我国苹果树腐烂病研究的文献计量学分析[J]. 安徽农业科学, 2010,38(25): 13802-13804.
[3] 吴芳芳, 檀根甲, 陈仁虎. 苹果树果实炭疽病的研究进展[J]. 安徽农业大学学报, 2002, 29(1): 29.
[4] 王忠明, 潘登. 苹果树常见病害及防治[J]. 吉林农业, 1994,(4): 27.
[5] 柯希望. 苹果树腐烂病菌在树皮组织内的扩展观察[D]. 杨凌:西北农林科技大学, 2009.
[6] 黄宝康, 秦路平. 药用植物内生菌的生物多样性及活性成分[J]. 药学实践杂志, 2006, 24(4): 193-196.
[7] 王美琴, 卢海波, 赵立娟, 等. 核桃内生菌HT3对番茄和黄瓜的促生作用[J]. 山西农业科学, 2013, 41(2): 130-132.
[8] Strobel GA. Rainforest endophytes and bioactive products [J]. Crit Rev Biotechnol, 2002, 22(4): 315-330.
[9] 赵增峰, 曹克强. 苹果树腐烂病流行性分析及防治建议[J]. 中国果树, 2011, (1): 61-63.
[10]王彩霞, 张清明, 李桂舫, 等. 苹果树腐烂病拮抗细菌菌株BJ1的鉴定及其抑制作用[J]. 植物保护学报, 2012, 39(5): 431-437.
[11]张淑颖, 曲田丽, 孙阳, 等. 剑麻内生细JM-3对苹果腐烂病抑制作用的研究[J]. 华北农学报, 2013, 28(4): 208-213.
[12]郜佐鹏, 柯希望, 韦洁玲, 等. 七株植物内生放线菌对苹果树腐烂病的防治作用[J]. 植物保护学报, 2009, 36 (5): 410-416.
[13]邓振山, 赵龙飞, 张薇薇, 等. 银杏内生真菌的分离及其对苹果腐烂病病原菌的拮抗作用[J]. 西北植物学报, 2009, 29(3): 0608-0613.
[14]翟慧志, 胡同乐, 陈曲, 等. 10种化学杀菌剂对苹果树腐烂病的防效评价[J]. 植物保护学报, 2012, 38(3): 152.
[15]颜霞, 黄以超, 兰鑫, 等. 内生放线菌Hhs-015中抗菌成分的性质及初步鉴定[J]. 西北农林科技大学学报, 2014, 42(3): 176-180.
[16]徐瑞富, 翟凤艳, 徐高歌. 杨树、苹果树、桃树腐烂病菌致病性及药剂抑菌研究[J]. 北方园艺, 2013, (18): 105-107.
[17]原犇犇, 曹支敏. 杨树腐烂病生防放线菌筛选及其活性产物研究[J]. 西北农林科技大学学报, 2007, 35(4): 139-144.
[18]李少华, 曹挥, 刘素琦. 大戟狼毒石油醚提取物对苹果树腐烂病抑菌活性初步探究[J]. 山西农业大学学报, 2009, 29(6): 561.
[19]柯杨, 马瑜, 沈莹华, 等. 冬凌草内生细菌的分离鉴定及其对植物病害的生防作用[J]. 微生物学杂志, 2013, 33 (1): 20-24.
Screening of Endophytic Fungus from Apple Tree with Anti-Valsa ceratosperma and Anti-Glomerella cingulata Activities
DENG Zhen-shan, CHEN Miao, ZHANG Wei-min, HE Xiao-long
(Coll.ofLifeSci.,YananUni.,Yanan716000)
In order to confirm the species of endophytic fungi from apple tree bark and their inhibitory effects againstValsaceratospermaandGlomerellacingulata, endophytic fungi in Fuji healthy apple stem and root were isolated and preliminary identified, and their inhibitory effects againstV.ceratospermaandG.cingulatawere tested both through tissue separation and plate confrontation method. Furthermore the inhibitory effects of their fermented broth against the pathogens. The results showed that 8 endophytic fungi from 49 isolates had a significant inhibitory effect againstV.ceratospermaandG.cingulata, and the highest inhibitory rate reached 83.93%; the average inhibition rate of fermented broth was more than 89%, the highest up to 98.81%. And in the same conditions, the inhibition rates of antifungal activity againstV.ceratospermaandG.cingulatareached by 50% higher than chemical pesticide. The study provided a theoretical basis for the research and development of new plant source bio-pesticide.
apple tree; endophytic fungus;Valsaceratosperma;Glomerallacingulata; antagonistic activity
陕西省自然科学基础计划项目(2013JM3004);陕西省科技统筹创新工程项目(2012CGX7)、(2012KTZB03-02-03)
邓振山 男,副教授,博士。主要从事植物病害综合防治和环境微生物研究。Tel: 0911-2332030,
E-mail: zhenshandeng214@163.com
2014-12-08;
2015-03-04
Q93-331;S432.4
A
1005-7021(2015)05-0061-06
10.3969/j.issn.1005-7021.2015.05.011