活用质量守恒决胜中考试场
赵青
目前绝大多数省市的中考兼具有毕业考试(水平考试)和升学考试(选拔考试)的功能。所以在中考化学的试题中一般来说基础性的属于水平测试的试题占全卷的80%左右,保证了大部分学生能通过毕业考试,但同时也会有少量的试题具有选拔性,拉开不同目标学生的成绩差距以达到选拔的目的。那么,在中考中如何才能获得高分呢?这是教师和学生在教与学的过程中不得不面对的问题。本文从质量守恒定律的知识点出发,讨论在学习中如何能对所学知识进行融会贯通而从识记转化成理解,最终上升到应用的渠道。
一、关于质量守恒定律
初中化学教材中给出的质量守恒定律的定义指出,质量守恒定律是指参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
从教材给出的定义可以看出,它是从宏观的角度来下的定义,即从可称量的物质来进行定义。但我们来理解或是解释质量守恒定律可以从微观的角度出发,即在学习物质构成的奥秘时我们就知道了分子是保持物质化学性质的最小微粒,而原子在化学变化中不可再分,原子是化学变化中的最小微粒。也就是说在化学反应中分子可能是有变化的,分子的种类和数目包括质量都可能是不守恒的,但原子在化学反应中仅仅是重新组合而形成了其他物质,所以原子在化学反应前后种类、数目,包括质量都没有改变。这才是质量守恒定律的实质和本原。
质量守恒定律在初中化学知识中反映得最为完美的是化学反应方程式中的守恒。从化学方程式中可以得到的与质量守恒有关的信息有:反应前后原子的种类、数目及质量是守恒的;反应前后的分子种类不同,分子数目也不一定相等;反应前的各物质的质量总和等于反应后的各物质的质量总和等等。
二、应用质量守恒进行问题解决
1.从宏观对质量守恒概念的理解与应用
例1根据质量守恒定律及2Mg+O22MgO的反应方程式,下列各组数据正确的是()。
A.镁的质量2 g,氧气质量3 g,氧化镁质量5 g
B.镁的质量3 g,氧气质量2 g,氧化镁质量5 g
C.镁的质量1 g,氧气质量4 g,氧化镁质量5 g
D.镁的质量4 g,氧气质量1 g,氧化镁质量5 g
解析质量守恒是指反应前后物质的质量保持相等。这里对质量守恒的理解要注意到的是“反应前后”,也就是说,只能参加反应与生成的物质之间才存在质量守恒,而不是你所提供的反应物与生成物之间的关系,所以要从方程式本身出发,即找到本反应中各物质的关系为:48∶32∶80,即3∶2∶5;因而本题的答案中应选择B。
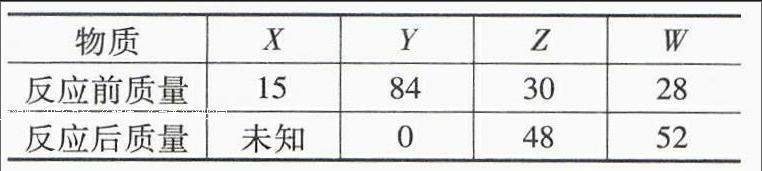
例2现在一密闭容器中有四种物质X、Y、Z、W,测得其在化学反应前后的质量数据如下表所示,试选择该反应所属的反应类型。
物质XYZW
反应前质量15843028
反应后质量未知04852
A.化合反应 B.置换反应
浓度也应为原溶液的两倍,但事实上,由于是等体积混合而不是等质量混合,溶液体积在混合过程中是不守恒的,因而不能直接用体积加和的方式得到物质的量浓度也为两倍的关系,我们可以应用物质的量浓度与质量分数换算的公式c=1000ρa%/M,即:c1=1000ρ(稀)a%/M,c2=1000ρ(浓)2a%/M,即可得c1/c2=ρ(稀)/2ρ(浓),又由于ρ(浓)>ρ(稀),所以可得c2>2c1。
本文讨论了等体积不同浓度溶液的混合,在混合过程中由于体积的不守恒,需将其转化成守恒的质量来进行换算,再根据不同溶液的密度与浓度的关系进行讨论而解决。当然在不同的试题中有着不同的要求,比如在有些试题中忽略了体积的变化,从而将问题进行了简化,这也是我们在问题解决时要注意的。
(收稿日期:2015-02-10)

