棉花G.LEC1A基因的克隆和鉴定
樊可心 ,曹爱萍 ,张文婷 ,郝小军 ,崔百明
(1石河子大学生命科学学院/农业生物技术重点实验室,石河子832003;2石河子大学农学院/生产建设兵团绿洲农业生态重点实验室,石河子832003)
LEC1是拟南芥胚胎发生的重要调节因子,控制着胚胎发育的许多不同方面[1]。LEC1是CCAAT-box结合因子(CBFs)亚基 HAP3的同源物[1]。HAP3有3个结构域:分别为N端和C端的不保守的A域和C域及中部的保守的B域[2],其中B域是HAP3与其他蛋白质亚基相互作用的位点,也是CBF复合体与DNA结合所必须的位点[3]。依据B域氨基酸序列相似性,拟南芥HAP3(AHAP3)家族的10个成员可分为2大类:LECl类型和非 LECl类型,LEC1和 LEC1-LIKE(L1L)属LEC1类型,主要在种子发育过程中表达,是胚胎发育所必需,其余8个属于非LEC1类型[3]。LEC1型B结构域特有的氨基酸残基—Asp55是其调控胚胎发生的必要条件,同时可使非LEC1型B结构域具备部分LEC1型基因的活性。这表明B域是决定LEC1功能的关键区域[4]。
LEC1基因在高等植物中普遍存在,且功能保守[5-7]。在胚胎发育早期,其决定胚胎细胞命运、规范子叶特性;胚胎发育后期,其表达有助于储藏物的积累和种子干燥耐受性的获得[4]。拟南芥Lec1突变体胚轴短、子叶圆且不弯曲、顶端分生组织突起、胚抗脱水能力丧失。过量表达LEC1恢复lecl突变体的胚胎发育异常和不耐干燥的表型。异位表达LEC1基因导致转基因后代幼苗畸形,幼苗叶片上产生胚状体,这表明LEC1过量表达可赋予幼苗胚胎特性,诱导体细胞胚的形成[8-9]。LEC1可能建立了一个细胞环境,这种环境可以促使胚胎形态发生和成熟的相关基因协同表达,从而促进了胚胎的发育[6]。Yazawa等[5]分离了胡萝卜LEC1基因(C-LEC1),发现其在胚性细胞、体细胞胚中表达,但不在胚乳中表达。以拟南芥LEC1启动子驱动的胡萝卜LEC1(C-LEC1)的表达能够与拟南芥lec1-1突变体的缺陷互补,表明C-LEC1是拟南芥LEC1的功能性同源物,也是胚胎发育的关键调控因子[5]。
近年来,植物体细胞胚发生相关基因的研究越来越受研究者的关注,目前,已分离得到了SERK、BABY BOOM、WUSCHEL等体胚发生相关基因[10-12]。而关于棉花LEC1基因尚未见报道。因此,本研究克隆棉花LEC1基因,通过氨基酸序列分析及基因功能互补实验,研究棉花G.LEC1A基因是否为LEC1的功能同系物,旨在为今后通过转基因方法提高棉花体胚发生率奠定基础。
1 材料与方法
1.1 材料
海岛棉材料为“新海25号”。 拟南芥lec1-1突变体 (Heynh生态型Wassilewskija)由Davis(University of California,Los Angeles) 惠赠。
Super ScriptTMⅢOne-Step RT-PCT System with Platinum Taq DNA Polymerase试剂盒购自Invitrogen公司;Wizard DNA Clean-Up Kit试剂盒、pGEM-T Easy Vector、T4-DNA连接酶和限制性内切酶等均购自Promega公司。引物合成及基因测序由北京华大基因公司完成。
1.2 方法
1.2.1 棉花总RNA提取
以海岛棉开花授粉后1-3 d的棉胚(1-3DAP)为材料,利用CTAB法[13]提取棉胚总RNA。
1.2.2 棉花LEC1基因的克隆与序列分析
以拟南芥LEC1基因(GenBank登陆号:NM102046)保守的B域进行BLAST,获得棉花LEC1同源序列;在该开放阅读框序列两侧设计引物,引物5’端分别引入XbaI和SacI酶切位点(下划线):
G.LEC1A-1F:5'-TCTAGAATGGAACGTGGGCTGA GCATC-3′;
G.LEC1A-627R:5'-CTCGAGCTCATTTGAACTGA CCAAATGGAT-3′。
使用上述引物,SuperScriptTMⅢ One-Step RT-PCT System with Platinum Taq DNA Polymerase进行一步法RT-PCR扩增。RT-PCR反应体系:RNA 5.0μL、10μmol/L上下游引物各 1.0μL、SSⅢRT/Platinum Taq 0.8μL、2×Reaction Mix 10.0 μL,DEPC-H2O补足至20μL。PCR扩增程序:55℃反转录 20 min,94℃变性 2 min;94℃变性15s,55℃退火 30 s,68℃延伸 1 min,40个循环;68℃延伸 5 min。
回收目的片段连接pGEM-T-easy,转化E.coli DH5α,经蓝白斑筛选及质粒酶切鉴定均正确的T-G.LEC1A质粒送去测序。测序结果用DNAMAN进行序列比对。
1.2.3 植物表达载体的构建
用XbaI和SacI分别双酶切T-G.LEC1A及pBI121质粒,将pBI121载体骨架上位于35S和NOS之间的GUS替换为目的基因G.LEC1A;获得中间载体pBIG.LEC1A;之后用PstI和EcoRI切下重组质粒pBIG.LEC1A的35S-G.LEC1A-NOS片段,并克隆到载体pCAMBIA1301的相应位点,得到植物表达载体pCAMG.LEC1A。将表达载体pCAMG.LEC1A电击转入农杆菌GV3101中用于拟南芥转化,以空载体pCAMBIA1301作为对照。
1.2.4 农杆菌介导的拟南芥遗传转化及干燥筛选试验
Lec1突变体纯合子的营救及侵染:lec1突变体果荚(约开花后30 d黄色果荚,种子为绿色)于70% 乙醇消毒30 s,95% 乙醇消毒15 s,酒精风干后用解剖针撕开果荚;种子均匀播种于含0.8%B5的1/2 MS培养基上;22℃,长日照培养(光∶暗=16∶8 h),生长2周待长出真叶后移入小花钵中,待开花后用农杆菌介导的拟南芥蘸花法[14]转化lec1突变体拟南芥,获得G.LEC1A及pCAMBIA1301空载体转基因拟南芥。
干燥筛选:将G.LEC1A和pCAMBIA1301空载体转基因T0代种子于37℃烘箱干燥2周,至种子完全干燥;4℃低温春化3 d,1.5%次氯酸钠消毒,播种于1/2 MS培养基于长日照培养箱培养。
1.2.5 转基因植株的PCR和半定量RT-PCR检测
1.2.5.1 转基因植株的PCR检测
用CTAB法提取筛选12 d植株总DNA,进行PCR检测。以lec1突变体纯合子植株做对照。PCR反应体系:总DNA 2.0μL、10μmol/L G.LEC1A-1F/G.LEC1A-627R引 物 各 0.5 μL、10×buffer with MgCl21.0 μL、10 μmol/L dNTP 0.2 μL、Taq DNA poly(5 U/μL)0.1μL,ddH2O 补足至 10 μL。PCR扩增程序:94℃ 3 min;94℃ 15 s,60℃ 20 s,72℃ 30 s 30个循环;72℃ 3 min。
1.2.5.2 半定量RT-PCR检测
以培养12 d的转基因拟南芥幼嫩叶片为材料,Trizol法提取总RNA备用。利用半定量PCR方法分析转基因植株基因表达情况。G.LEC1A基因特异性引物为G.LEC1A-1F/G.LEC1A-627R,RT-PCR反应体系及程序同“1.2.2”,30个循环。以拟南芥actin2-1基因为内参基因,其引物为Atactin2-1 SP:5'-TGATGAAGCACAATCCAAGA-3′/Atactin2-1 ASP:5'-ACCAGAATCCAGCACAATAC-3′,actin2-1反应体系:总RNA 2.5μL、10μmol/L上下游引物各0.2 μL、SS Ⅲ RT/Platinum Taq 0.4 μL、2×Reaction Mix 5.0μL,DEPC-H2O补足至10μL,PCR扩增程序:55℃,20 min;94℃,2 min;94℃ 15 s,56℃30 s,68℃ 1 min,28个循环;68℃,5 min。
2 结果与分析
2.1 棉花G.LEC1A基因的克隆及序列分析
根据设计的引物,以棉胚总RNA为模板进行RT-PCR扩增,克隆得到长为627 bp的目标片段(图1),命名为G.LEC1A基因(Genbank登录号:KP185323)。
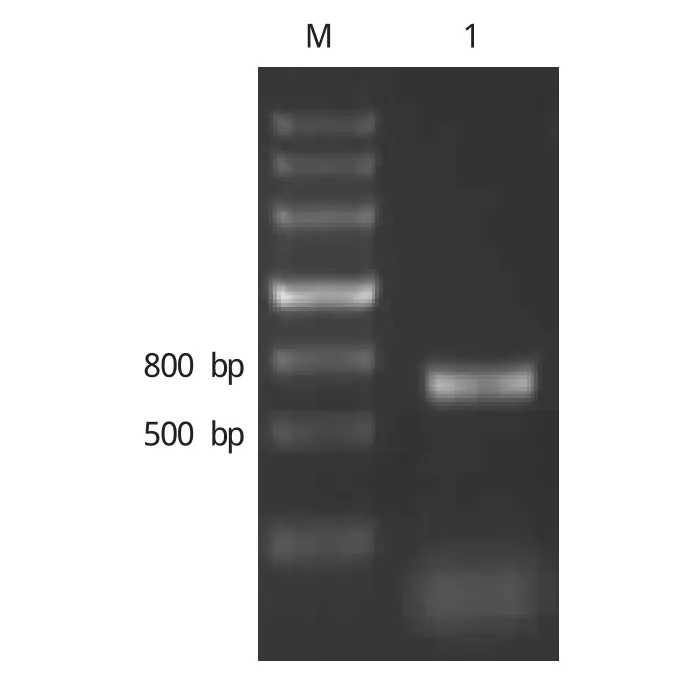
图1 G.LEC1A基因的扩增Fig.1 RT-PCR amp lification of G.LEC1A
序列分析结果表明,G.LEC1A基因序列包含1个完整的开放阅读框,编码208个氨基酸。将G.LEC1A的氨基酸序列与拟南芥HAP3家族的10个蛋白质的氨基酸序列比较,结果(图2)表明,在保守的B域90个氨基酸中,G.LEC1A与LEC1型的LEC1和L1L的氨基酸一致位点(identity position)均为90.0%,而保守位点(consensus position)分别为 96.7%和 95.6%,而与非LEC1型的一致位点低于70%,此外,G.LEC1A也拥有LEC1型特有的16个氨基酸(图2黑色背景部分),因此,G.LEC1A属于LEC1型的HAP3蛋白。
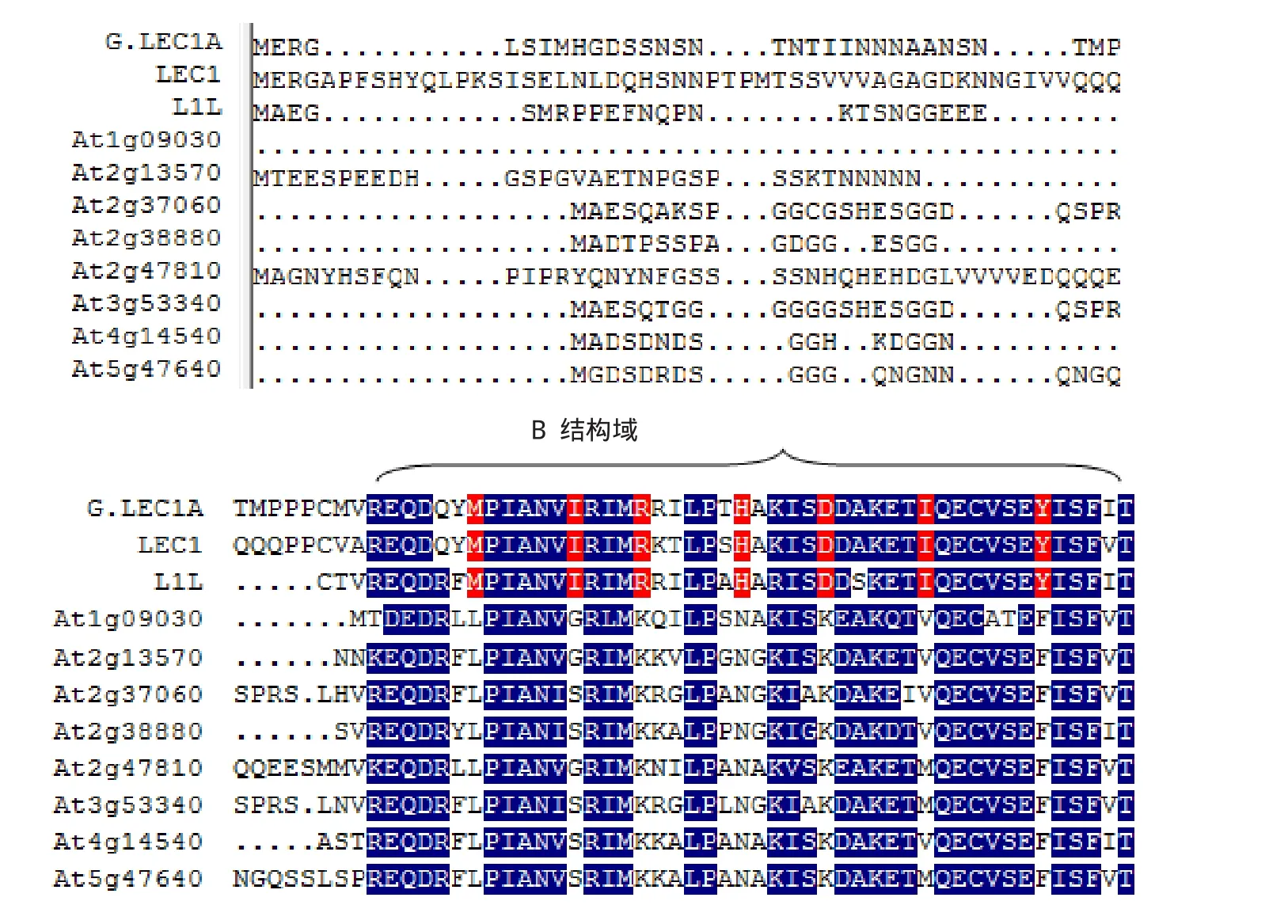
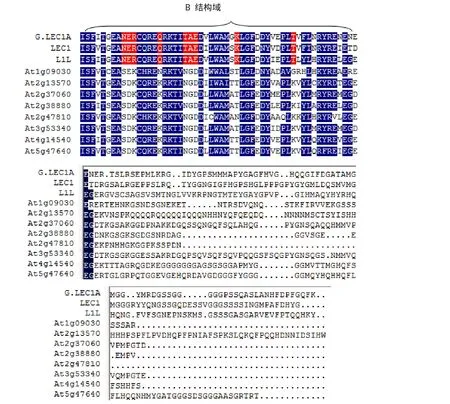
图2 G.LEC1A与拟南芥HAP3蛋白家族的氨基酸序列比对Fig.2 Amino acid sequence alignment of Arabidopsis HAP3 protein family and G.LEC1A
2.2 转基因拟南芥干燥筛选检测
为了检验G.LEC1A是否为预期的功能基因,将G.LEC1A置于用35S启动子驱动下,转化拟南芥lec1-1突变体,并以pCAMBIA1301为空载体对照。T0代转基因拟南芥种子经37℃干燥处理2周后,播种于培养基上。培养12 d后,转空载体对照组种子均未萌发,而转G.LEC1A种子有4株萌发,活性种子比例为0.004%(表1)。转化植株进一步用PCR和半定量PCR验证了G.LEC1A基因的整合和表达(图3)。

表1 lec1-1突变体转基因植株T1代植株恢复率Tab.1 The recovery rate of T1 transgenic plant of the lec1-1 mutation
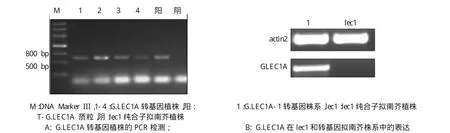
图3 G.LEC1A转基因拟南芥株系的PCR检测和表达Fig.3 The PCR detection and expression level of G.LEC1A gene in transgenic Arabidopsis lines
2.3 G.LEC1A转基因拟南芥植株表型分析
获得的4株转基因幼苗分别标记为A-1、A-2、A-3、A-4。A-1侧枝较少,花序雄蕊数少于 lec1,花粉少,果荚含种子量少(≤20粒 /果荚)(图 4B、F、J);A-2花序少且小,后萎蔫,无雄蕊产生,雌蕊柱头短,未产生种子(图4C、G、K)。A-4花序雄蕊授粉,但在正常培养条件下干枯死亡,无种子产生(图4D、H、M)。这些表型说明G.LEC1A基因可恢复lec1突变体的种子干燥耐受性,但也可以导致花器官发育异常,特别是雄蕊,从而导致育性下降甚至不育。

图4 lec1突变体和转基因拟南芥表型比较Fig.4 Phenotype comparison between lec1 mutant and transgenic Arabidopsis plant
3 讨论和结论
(1)LEC1是真核生物转录激活因子CBF亚基HAP3的同源蛋白[3]。HAP3在拟南芥中由10个基因编码,但只有2个基因,即LEC1和L1L,是胚胎发育的关键调控基因,属LEC1型的HAP3[2]。本研究成功克隆了棉花LEC1基因(G.LEC1A),其编码的蛋白与LEC1型蛋白的B域氨基酸序列相似度很高,与LEC1和L1L仅存在9个氨基酸的差异,较拟南芥LEC1型与非LEC1型的B域差异小,说明G.LEC1A属于LEC1型蛋白。
(2)LEC1在植物胚胎发育的整个时期均起着关键性的调控作用[1]。胚胎发育早期,LEC1是维持胚胎细胞命运所必需的;胚胎发育晚期,LEC1参与种子成熟的许多事件,包括干燥耐受性的获得和储藏物的积累[4]。West研究发现LEC1缺失突变体lec1-1的胚不耐脱水,干燥的种子无活性;lec1-1纯合子在果荚内种子未完全干燥脱水前可营救成活;营救成功的lec1突变体纯合子种子多产且可育,植物的营养器官和花器官无任何突变表型[16]。本研究中,G.LEC1A的表达使lec1突变体恢复了种子的干燥耐受性,说明G.LEC1A是LEC1的功能同系物,并可能在棉花胚发育调控中起关键性调控作用。
(3)然而,本研究得到的G.LEC1A-2/-3/-4植株于筛选12 d后通过PCR检测验证了G.LEC1A基因的整合和表达,但50 d后观察均出现了雄性发育不全、雌蕊授粉后期花序干枯死亡等不同程度的不育表型,表明G.LEC1A在发育的T1代种子最初是活跃的,可互补lec1基因突变体,但发芽后该基因失活;这与拟南芥LEC1异位表达结果相一致[17]。Lotan等[1]和 West等[16]在异位表达的 35S/LEC1幼苗发现了油体蛋白质和两个2S贮藏蛋白等种子胚胎特异性RNA,表明植物异位表达LEC1基因可导致胚后期种子发育所需特异性基因在营养组织和生殖组织表达;本研究中G.LEC1A转基因幼苗出现植株矮小,花器官异常等畸形表型,推测可能为种子特异性基因过早表达导致了转基因植株的形态发生异常。因此,在下一步工作中,将从种子发育所需特异性基因表达方面,研究造成G.LEC1A转基因植株花器官异常及雄性不育的原因,同时通过植物组织培养技术和植物生理学相应手段研究G.LEC1A对棉花体胚发生的影响。
[1]Lotan T,Ohto M,Yee K M,et al.Arabidopsis leafy cotyledon1 is sufficient to induce embryo development in vegetative cells[J].Cell,1998,93(7):1195-1205.
[2]Lee H,Fischer R L,Goldberg R B,et al.Arabidopsis leafy cotyledon1 represents a functionally specialized subunit of the CCAAT binding transcription factor[J].Proc Natl Acad Sci USA,2003,100(4):2152-2156.
[3]Kwong R W,Bui A Q,Lee H,et al.Leafy cotyledon1-like defines a class of regulators essential for embryo development[J].The Plant Cell,2003,15(1):5-18.
[4] 郭凤丹.LEC基因促进植物体细胞胚形成及机理的研究[D].济南:山东师范大学,2012.
[5]Yazawa K,Takahata K,Kamada H.Isolation of the gene encoding carrot leafy cotyledon1 and expression analysis during somatic and zygotic embryogenesis[J].Plant Physiol Biochem,2004,42(3):215-223.
[6]Shen B,Allen W B,Zheng P,et al.Expression of ZmLEC1 and ZmWRI1 increases seed oil production in maize[J].Plant Physiol,2010,153(3):980-987.
[7]Fambrini M,Durante C,Cionini G,et al.Characterization of leafy cotyledon1-like gene in Helianthus annuus and its relationship with zygotic and somatic embryogenesis[J].Development Genes and Evolution,2006,216(5):253-264.
[8]Gaj M D,Zhang S,Harada J J,et al.Leafy cotyledon genes are essential for induction of somatic embryogenesis of Arabidopsis[J].Planta,2005,222(6):977-988.
[9]Junker A,B umlein H.Multifunctionality of the LEC1 transcription factor during plant development[J].Plant Signal Behav,2012,7(12):1718-1720.
[10]米贯勋.光照对棉花下胚轴体细胞胚诱导能力的影响[D].石河子:石河子大学,2014.
[11]Deo P C,Tyagi A P,Taylor M,et al.Factors affecting somatic embryogenesis and transformation in modern plant breeding[J].The South Pacific Journal of Natural and Applied Sciences,2010,28(1):27.
[12]Yuceer SU,Koc N K.Agrobacterium-mediated transformation and regeneration of cotton plants[J].Russian Journal of Plant Physiology,2006,53(3):413-417.
[13]吕西洋,崔百明,段琛,等.棉花DELLA蛋白GhGAI4a基因在拟南芥中功能初步分析[J].石河子大学学报:自然科学版,2013,32(5):529-535.LU Xiyang,CUI Baiming,DUAN Shen,et al.Function analysis of cotton DELLA protein GhGAI4a gene in Arabidopsis thaliana[J].Journal of Shihezi University:Natural Science,2013,32(5):529-535.
[14]陈英杰,詹杰鹏,王志江,等.棉花DELLA蛋白GhGAI2b基因的克隆和功能初步分析[J].石河子大学学报:自然科学版,2014,32(5):635-640.CHEN Yingjie,ZHAN Jiepeng,WANG Zhijiang,et al.Cloning and preliminary functional analysis of cotton DELLA protein GhGAI2b gene[J].Journal of Shihezi University:Natural Science,2014,32(5):635-640.
[15]游义霞,黄先忠,郑银英,等.大叶落地生根STM基因植物表达载体构建及烟草转化[J].石河子大学学报:自然科学版,2012,31(3):271-275.YOU Yixia,HUANG Xianzhong,ZHENG Yinying,et al.Plant expressing vector construction of Kalancho daigremontiana STM gene and its transformation into tobacco[J].Journal of Shihezi University:Natural Science,2012,31(3):271-275.
[16]West M,Yee K M,Danao J,et al.Leafy cotyledon1 is an essential regulator of late embryogenesis and cotyledon identity in arabidopsis[J].Plant Cell,1994,6(12):1731-1745.
[17]Stam M,Mol J N M,Kooster J M.The Silence of genes in transgenic plants[J].Ann Bot,1997,79:3-12.

