蒙药嘎日迪-13味丸对脑缺血大鼠海马组织白介素-1β、肿瘤坏死因子-α蛋白及神经细胞凋亡的影响
蒙药嘎日迪-13味丸对脑缺血大鼠海马组织白介素-1β、肿瘤坏死因子-α蛋白及神经细胞凋亡的影响
陶春林琳宋葆华汤文莉宝鲁尔宣丽颖翟景波刘鑫张冬丽霍万学刘月英
(内蒙古民族大学,内蒙古通辽028000)
摘要〔〕目的探讨蒙药嘎日迪-13味丸对脑缺血大鼠海马组织炎性细胞因子白介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)表达及神经细胞凋亡的影响。方法采用枕大池二次注血法至大鼠脑组织缺血损伤模型,在各时间段断头取脑,用ELISA法和流式细胞仪分别检测脑缺血海马组织中IL-1β和TNF-α的含量及细胞凋亡数量的百分比。结果与正常组比较,模型组海马组织中IL-1β和TNF-α升高,细胞凋亡百分比增多(P<0.05);与模型组比较,嘎日迪-13味丸组大鼠海马组织中IL-1β和TNF-α含量降低,细胞凋亡百分比数减少(P<0.05)。结论嘎日迪-13味丸能降低大鼠脑缺血组织神经细胞凋亡数量,减轻缺血损伤程度,其机制可能与降低脑组织内IL-1β和TNF-α含量有关。
关键词〔〕嘎日迪-13味丸;脑缺血;细胞凋亡;炎性因子
中图分类号〔〕R743;R285〔
基金项目:内蒙古自治区教育厅研究项目(NJZY11204);内蒙古自然科学
Effect of Mongolian medicine Garidi-13 pill on IL-1β, TNF-αprotein and nerve cell apoptosis of cerebral ischemia hippocampus tissue of rats
TAO Chun, LIN Lin, SONG Bao-Hua,etal.
Inner Mongolia University for the Nationalities, Tongliao 028000, Inner Mongolia, China
Abstract【】ObjectiveTo investigate the effects of Mongolian medicine Garidi-13 pill on inflammatory cytokines interleukin-1β(IL-β) and tumor necrosis factor-α(TNF-α) expression and nerve cell apoptosis of cerebral ischemia hippocampus tissue of rats. MethodsTwo times of blood injection to the cistema magna was used to make the rat model of cerebral ischemia. Brain tissue was acquired at each time point. Flow cytometry and ELISA were used to detect the number of apoptotic cells, IL-1β and TNF-α content in hippocampus tissue. ResultsCompared with normal group, IL-1βand TNF-αin hippocampus were increased, apoptosis percentage number was increased of model group (P<0.05). ConclusionsGaridi-13 can reduce the number of apoptosis nerve cell in ischemia brain tissue and reduce the severity of ischemic injury, its mechanism may be related to reduce IL-1β and TNF-αcontent of brain.
【Key words】Garidi -13 pill; Cerebral ischemia; Cell apoptosis; Inflammatory factor
第一作者:陶春(1960-),男,教授,硕士生导师,主要从事神经病理学研究。
嘎日迪-13味丸(又名扎冲十三味丸)是蒙医临床常用的传统方剂之一,由诃子、制草乌、石菖蒲、木香、麝香、珊瑚(制)、珍珠(制)、丁香、沉香、禹粮土、磁石(煅)、甘草、肉豆蔻 13 味药组成〔1〕。在蒙医临床上一直用于脑缺血性疾病的治疗(脑缺血性疾病在蒙医学中称之为“萨病”、“白脉病”),主治半身不遂,左瘫右痪,口眼歪斜,四肢麻木,腰腿不利,言语不清,筋骨疼痛,神经麻痹等症,临床疗效满意〔2〕。但该药作用机理研究尚少,临床应用严重受限。为明确其抗脑损伤的作用及其机制,本实验采用Elisa法和流式细胞仪分别检测脑缺血大鼠海马组织中IL-1β和TNF-α表达的变化及细胞凋亡数量的百分比。探讨嘎日迪-13味丸对脑缺血损伤的抗炎作用,为其治疗脑缺血损伤提供一定的实验依据。
1材料与方法
1.1动物与分组清洁级SD大鼠72只,体重180~210 g,雌雄不拘,由吉林大学实验动物中心提供,许可证号吉2007-0003,动物分笼饲养(环境温度24~26℃,湿度60%~70%),自由饮水,术前12 h禁食。将大鼠随机分为3组,即正常对照组、模型组、嘎日迪-13味丸组,各组根据术后处死时间不同再分为模型1、3、5、7 d组和嘎日迪-13味丸1、3、5、7 d组,每组各8只大鼠。
1.2试剂与仪器美国DB公司生产BD Calibur流式细胞仪。芬兰雷勃公司生产的MK3酶标仪,Elisa试剂盒购自美国GBD公司提供。嘎日迪-13味丸由内蒙古民族大学附属医院提供。水合氯醛为天津市河北区海晶精细化工厂产品。Annexin V fitc/pi细胞双染试剂盒购自上海贝博生物试剂公司。
1.3方法
1.3.1给药方法嘎日迪-13味丸丸以蒸馏水配制成2%浓度,经灌胃给药,每日一次,每次1.2 ml。模型组均给予蒸馏水。正常对照组在同一环境下饲养。
1.3.2模型建立10%水合氯醛(0.35/100 g)腹腔注射麻醉后,大鼠俯卧位固定于操作台上,项部备皮,安尔碘常规消毒。在左右耳根连线中点,沿正中线纵行切开颈部皮肤,暴露枕骨、环椎及环枕膜,用1 ml注射器针头刺破环枕膜并稍稍推进到达枕大池,有脑脊液流出后,由左眼球后静脉丛抽取0.3 ml无抗凝自体血,以0.1 ml/min注射速度缓慢将0.15 ml/100 g(体重)的自体不抗凝血注入枕大池。明胶海绵压迫穿刺点3 min后缝合切口。将大鼠头低30°俯卧位30 min,以利血液凝固沉积在脑底血管周围。大鼠保温复苏至清醒后自由饮食饮水。48 h后同法操作制成大鼠脑梗死模型。嘎日迪-13味丸组在手术第二天开始给嘎日迪-13味丸灌胃。在第2次注射后第1,3、5、7天取脑待检。
1.3.3模型成功标志大鼠苏醒后按Longa5分制标准进行神经功能缺失评分〔3〕。0分:无明显神经损伤症状;1分:不能完全伸展对侧前爪;2分:行走时向对侧旋转;3分:行走时向对侧倾倒;4分:不能自发行走,意识丧失。在1~3分者为有效模型。观察期内没入选及死亡的大鼠予以剔除,剩余每组6只。
1.3.4标本采集在第2次注血后分别在第1、3、5、7天断头处死各组大鼠,取脑海马组织。手术在冰盒上进行。
1.3.5大鼠脑海马组织IL-1β、TNF-α蛋白检测采用ELISA法检测IL-1β、TNF-α蛋白,方法严格按照说明书进行。
1.3.6大鼠脑海马组织细胞凋亡百分率检测将大鼠脑海马组织标本置于生理盐水中,充分吸收水分后,将组织剪切成2~3 mm直径的小块,放在单细胞制备仪中,加1 ml生理盐水,研磨5 min左右。吸取组织液用10 000目细胞筛过滤后,用含0.1%牛血清白蛋白的PBS低速1 000 r/min离心5 min,洗涤2次,弃上清。根据试剂盒重悬细胞并标记细胞,严格按照说明书,上机检测。
1.4统计学方法应用SPSS17.0统计分析软件进行方差分析和t检验。
2结果
2.1各组大鼠脑海马组织IL-1β和TNF-α蛋白水平与正常组〔IL-1β(18.01±1.86)、TNF-α(11.59±1.91)〕比较,模型组脑海马组织IL-1β和TNF-α蛋白表达量较多,且随着损伤时间延长,给予嘎日迪-13味丸治疗后,TNF-α和IL-1β表达均不同程度的减少(P<0.05),表明嘎日迪-13味丸能够抑制脑缺血海马组织炎性细胞因子TNF-α和IL-1β的表达。见表1,表2。


时间点模型组嘎日迪-13味丸组1d组41.17±3.931)24.93±5.643)3d组42.99±3.401)2)27.26±3.312)3)5d组60.41±4.621)2)26.14±4.392)3)7d组97.95±13.891)2)26.22±10.352)3)
与正常组比较:1)P<0.05;与同组前一时点比较:2)P<0.05;与同时点模型组比较:3)P<0.05,下表同


时间点模型组嘎日迪-13味丸组1d组27.49±4.431)28.26±1.903)3d组51.82±2.941)2)16.57±22.012)3)5d组64.81±3.781)2)21.88±4.712)3)7d组63.22±4.521)2)21.19±2.152)3)
2.2各组大鼠脑海马组织细胞凋亡百分比比较与正常组比较(2.83±0.15)%,模型组大鼠脑海马组织神经细胞凋亡百分比显著增加(P<0.05),且随损时间延长细胞凋亡率增多,给予嘎日迪-13味丸治疗后,凋亡细胞百分比降低(P<0.05),见表3。
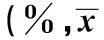

时间点模型组嘎日迪-13味丸组1d组3.75±0.341)1.86±0.213)3d组9.85±2.571)2)3.70±0.962)3)5d组5.20±0.861)2)2.95±0.262)3)7d组17.63±2.631)2)5.77±0.622)3)
3讨论
脑缺血性疾病导致的脑缺血损伤,是非常复杂的病理生理过程,其与损伤级联反应有关,具体包括兴奋性毒性、周围去极化、炎症、程序性细胞死亡等四种主要机制,这四种机制往往是相互因果相互影响,其中细胞凋亡是脑缺血神经元损伤的严重结果〔4〕。尽管不同的机制参与了脑缺血损伤的病理过程,越来越多的证据表明,炎症反应是其病理发展的重要因素。
炎症是由级联反应产生的大量细胞毒性成分诱导的细胞因子和致炎症酶原产生的结果,细胞因子作用于内皮细胞受体,吸引白细胞并诱导它们移至脑组织造成损伤,细胞因子也可直接激活小胶质细胞产生有害介质〔5〕,所以有研究表明,抑制炎症反应可能也是新的治疗缺血性脑血管病的对策。
脑缺血性损伤首先影响的是细胞的能量代谢,ATP下降,各种依赖ATP的酶活性下降,能量代谢的异常产生了氧自由基(ROS)和钙超载,钙离子大量进入细胞内,损伤线粒体,这二个因素和一些炎症介质共同协调作用,造成组织发生的级联反应,细胞因子在其中扮演着重要角色,氧自由基和其他信使激活炎性细胞因子,导致小胶质细胞激活,产生炎症反应。炎症本身又产生自由基,导致恶性循环,进而引起细胞凋亡〔6〕。由上可知,脑缺血后激发的炎症反应是脑组织损伤的关键,在炎症级联反应中,肿瘤坏死因子(TNF)-α、白介素(IL-1β)等炎性细胞因子的作用对脑缺血损伤有重要意义。
TNF-α在正常脑内有低水平表达,研究显示,TNF-α属于前炎症因子,具有多效促炎性及神经毒性作用,是炎症反应的起始因子。脑缺血诱发内皮细胞、星形胶质细胞和小胶质细胞产生TNF-α,使脑组织内TNF-α表达大量增加,TNF-α促进白细胞和内皮细胞黏附,并激活巨噬细胞、神经胶质细胞释放炎性递质,导致白细胞游走至受损脑组织引发炎性反应,使毛细血管周围水肿和白细胞黏附毛细血管,并且TNF-α可经内皮细胞激活作用,促成凝血状态和血管收缩,增加神经缺损和组织损伤。TNF-α还对毛细血管有直接毒性作用,导致毛细血管通透性增加和血-脑脊液屏障(BBB)破坏,加重白细胞浸润及脑水肿。脑组织缺血后,活化的星形细胞、少突胶质细胞及浸润的巨噬细胞分泌IL-1β,IL-1β介导小胶质细胞释放细胞因子,促进内皮细胞表达黏附分子,刺激单核-巨噬细胞产生TNF-α,从而加重局部炎症反应。IL-1β还可促进白细胞在炎性部位的聚集,并激活中性粒细胞使之参与炎症的发展,通过破坏BBB,加重脑水肿〔7〕。以上最终导致了缺血核心区域不可逆性地损伤,然而,有研究表明,缺血核心坏死区和正常组织之间包围着缺血半暗带区,该区细胞结构存在但功能受损,细胞凋亡是细胞的重要形式,细胞凋亡是细胞基因调控下逐步走向死亡的过程,它是一种生理性死亡,不同于坏死,凋亡是脑损伤的动态进行过程,因此半暗区不是静止的,随时间推移和治疗适宜,其大小也发生改变,梗死区可扩展到半暗区,如果及时或适宜的治疗可缩小半暗区的范围,这给了治疗脑缺血疾病一个时间〔8〕,因此一直被国内外医务工作和研究人员关注。有效抑制细胞凋亡,对脑缺血损伤的保护显得至关重要。
本实验结果表明,嘎日迪-13味丸能降低大鼠脑缺血组织神经细胞凋亡数量,减轻缺血损伤程度,其机制可能与降低脑组织内IL-1β和TNF-α含量有关。
4参考文献
1国家药典委员会.中国药典〔S〕.北京:化学工业出版社,2005:190.
2林琳,陶春,汤文丽,等.扎冲十三味丸的药理与临床研究概况〔J〕.内蒙古民族大学学报(自然科学版),2010;25(1): 80-2.
3Zea Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
4刘秀平,许栋明,王文,等.炎症反应影响脑缺血再灌注损伤的研究进展〔J〕.中国康复理论与实践,2009;15(11):1041-3.
5倪光夏,石学敏,王占奎.针刺对缺血再灌注大鼠脑组织炎症反应相关蛋白表达的影响〔J〕.江苏中医药,2012;44(12):73-4.
6刘剑刚,姚明江,黄志斌,等.还脑益聪方对老年大鼠脑组织炎症因子及海马核因子NF-κB表达的影响〔J〕.中华中医药杂志(原中国医药学报),2011;26(1):156-60.
7宋兆晶,吉训明,牛小媛,等.脑缺血后炎性反应机制的研究进展〔J〕.中国脑血管病杂志,2010;7(3):154-6.
8张金华,闫福岭.脑梗死大鼠外周血促炎/抗炎细胞因子的动态变化〔J〕.中华脑血管病杂志(电子版),2010;4(2):88-93.
〔2013-06-11修回〕
(编辑曹梦园)

