汉防己甲素对食管癌放射性肺损伤的保护作用
汉防己甲素对食管癌放射性肺损伤的保护作用
柏会明1,刘宏1,周步全2,吴少兵1,柏社香1,杨瑜1,沈蓉1
(1.盐城市肿瘤医院放疗科,江苏 盐城 224003;2.盐城市肿瘤医院检验科,江苏 盐城 224003)
[摘要]目的观察汉防己甲素对食管癌放射性肺损伤的保护作用及其机制。方法经病理确诊的食管癌患者78例根据治疗方法不同随机分为2组,治疗组40例在放疗第1天起口服汉防己甲素片40~60 mg·d-1,对照组38例仅给予放疗。治疗过程中监测患者血清转化生长因子β1(TGF-β1)及肿瘤坏死因子α(TNF-α)水平。治疗后评价肺损伤情况。结果治疗组放疗结束后1、3、6个月血清TGF-β1、TNF-α水平均低于对照组(P均<0.05)。治疗组在放疗结束后6个月肺CO弥散量下降比对照组少(P<0.05)。治疗组放射性肺炎和放射性肺纤维化的发生率低于对照组(P<0.05)。结论汉防己甲素能抑制食管癌放疗后TGF-β1和TNF-α的过度表达,阻止肺弥散功能的恶化,可用于放射性肺损伤的预防。
[关键词]汉防己甲素;转化生长因子β1;肿瘤坏死因子α;放射性肺炎;食管癌
作者简介:柏会明(1965-),男,学士,主任医师,主要从事肿瘤放疗工作。E-mail:drbhm@163.com
DOI:10.3969/j.issn.1673-5412.2015.01.025
[中图分类号]R735.1;R730.6
收稿日期:(2014-08-08)
Effect of Tetrandrine on Radiation-induced
Lung Injury in the Patients with Esophageal Carcinoma
Abstract[]ai Huiming1,Liu Hong1,Zhou Buquan2,Wu Shaobing1,Bai Shexiang1,Yang Yu1,Shen Rong1
(1.DepartmentofRadiaitionOncology,YanchengCancerHospital,Yancheng224003,China;
2.DepartmentofClinicalLaboratory,YanchengCancerHospital,Yancheng224003,China)
Abstract[]ObjectiveTo observe the effect of tetrandrine on radiation-induced lung injury in the patients with esophageal carcinoma and the mechanism.MethodsSeventy-eight patients with esophageal carcinoma were randomly divided into two groups.Forty patients in the treatment group received tetrandrine (oral,40-60 mg·d-1) plus radiotherapy,38 patients in the control group received radiotherapy only.The serum transforming growth factor β1 (TGF-β1) and tumor necrosis factor α (TNF-α) levels were detected during the treatment.The radiation-induced lung injury was observed after the treatment.ResultsAfter 1,3,6 months of radiotherapy,the serum levels of TGF-β1 and TNF-α in the treatment group were lower than those in the control group (P<0.05).After 6 months of radiotherapy,the pulmonary CO diffuse quantity decline of the treatment group was lower than that of the control group (P<0.05).The incidences of radiation pneumonia and radiation lung fibrosis of the treatment group were lower than those of the control group (P<0.05).ConclusionTetrandrine can restrain the TGF-β 1 and TNF-α overexpression in the patients with esophageal carcinoma after radiotherapy,reduce the deterioration of dispersion function,can be used to prevent the radiation-induced lung injury.
[Key words]tetrandrine; transforming growth factor β1; tumor necrosis factor-α; radiation pneumonitis; esophageal carcinoma
放射性肺损伤是食管癌在放疗中常见的并发症,严重影响患者生活质量。在放射性肺损伤发生的过程中,转化生长因子β1 (transforming growth factor β1,TGF-β1)及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)可能起着关键性作用。汉防己甲素是双苄基异喹啉类化合物,存在于千金藤属植物粉防己的根块中,具有消炎、止痛和抗肿瘤等作用。本研究对食管癌放疗患者在放疗开始即给予口服汉防己甲素,连续服用6个月,观察治疗后放射性肺损伤的发生情况以及治疗过程中TGF-β1、TNF-α表达水平的变化。
1资料与方法
1.1病例选择入组2011年6月至2013年6月我院经胃镜病理确诊的食管癌患者78例,均为鳞癌,随机分为2组。治疗组40例:有5例因为经济原因未完成治疗,另有5例失访,余30例完成治疗,并且患者临床数据完整,其中男18例,女12例,年龄48~79(63±10)岁;对照组38例:失访3例,余35例完成治疗,并且患者临床数据完整,其中男21例,女14例,年龄54~80(67±9)岁。2组患者在性别、年龄和病期等方面比较差异无统计学意义(P>0.05),具有可比性。
1.2病例排除标准既往有矽肺、慢支、间质性肺炎以及心脏病史者,头颅MRI及腹部CT和全身骨扫描提示有转移者,预计生存期<6个月者,放疗后还需行辅助化疗者均排除出该研究。
1.3治疗方法治疗组40例在放疗第1天起口服汉防己甲素片40~60 mg·d-1,对照组38例仅给予放疗。2组放疗方案相同,具体放疗方案:常规放疗36~39.6 Gy后改野避脊髓,总剂量63~68.4 Gy。
1.4放射性肺损伤的评价放射肺损伤按RTOG的标准分为0~5级(第5级为死亡),临床症状2级以上为观察指标。从放疗后2周开始,观察患者的临床症状如咳嗽、气短等。诊断以临床症状和CT等影像学检查为依据,表现在放射区域内的沿放射野方向的模糊渗出状影。
1.5肺弥散功能检查放疗前及放疗结束后6个月各检查1次。采用SM6200肺功能检测仪(美国BD公司)测定肺CO弥散量,测定结果以实测值占预计值的百分比表示。
1.6血清TGF-β1和TNF-α水平检测放疗前,放疗结束后1、3、6个月采用ELISA法分别测定血清TGF-β和TNF-α水平,操作严格按照试剂盒说明进行。放疗前的数据为基础参考值,>基础参考值的为升高,≤基础参考值的为正常。

2结果
2.12组放疗前后血清TGF-β1水平比较见表1。

表1 2组放疗前后血清TGF-β1水平比较 ng·mL -1
注:与对照组同期比较,1)P<0.05;2组随着放疗的进展,TGF-β1水平均逐渐上升,对照组上升更快(P<0.05)
2.22组放疗前后血清TNF-α水平比较见表2。
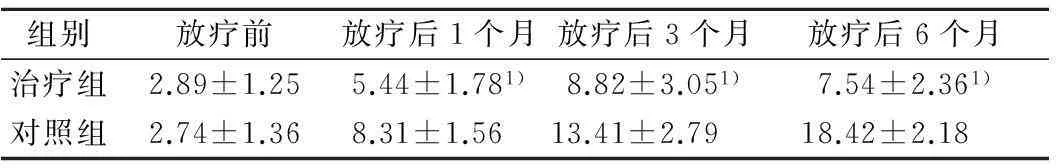
表2 2组放疗前后血清TNF-α水平比较 ng·mL -1
注:与对照组同期比较,1)P<0.05;2组随着放疗的进展,TGF-β1水平均逐渐上升,对照组上升更快,差异有统计学意义(P<0.05)
2.32组放疗前后肺弥散功能变化比较见表3。

表3 2组放疗前后肺弥散功能变化比较 n(%)
注:治疗组在放疗结束后6个月肺CO弥散量下降比对照组少,差异有统计学意义(P<0.05)
2.42组放射性肺损伤的发病情况比较见表4、5。

表4 2组放射性肺炎发病情况比较 n(%)
注:治疗组放射性肺炎发生率为75.0%,低于对照组的92.1%,差异有统计学意义(P<0.05)
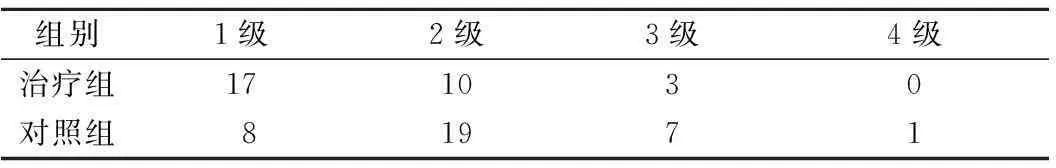
表5 2组放射性纤维化发病情况比较 n(%)
注:治疗组放射性肺纤维化发生率为75.0%,低于对照组的92.1%,差异有统计学意义(P<0.05)
2.52组其他毒副反应比较2组患者均未出现明显心、肝、肾功能异常等毒副反应。
3讨论
食管癌为我国常见的消化道恶性肿瘤,放疗是其主要的治疗手段之一[1]。放射性肺损伤是食管癌在放疗中最常见的并发症之一。细胞因子在肺的放射性损伤的发生过程中扮演重要角色[2]。在肺受照射后数小时,就有多种细胞因子表达,促进炎性细胞的入侵,进而导致急性放射性肺炎的发生[3]。对于放射性肺损伤的治疗关键在于早期预防,比如确定高危人群、控制肺V20在恰当范围以及放射防护剂的应用等。一旦发生放射性肺炎,则治疗较为困难。明确放射性肺损伤的发病机制及找到相应干预措施可能为肺部受照射者带来益处。
TGF-β1是公认的与放射性肺损伤发生密切相关的重要细胞因子之一,在放疗期间,检测TGF-β1水平变化,可用于预测放射性肺损伤的发生[4]。TGF-β1由肺泡巨噬细胞释放,然后通过一系列自分泌等方式刺激成纤维细胞,后者产生细胞基质蛋白,调节胶原的转录及翻译过程,诱导肺结缔组织生长因子高表达,加速肺纤维化的发生[3]。正常人外周血TGF-β1处于低水平,但当肺组织受到照射后,过量的TGF-β1进入血液循环,导致外周血中的TGF-β1水平升高[5]。TNF-α是体内强有力的一种促炎症反应细胞因子,其作为调节启动因子,对促进炎症反应发挥有作用,例如改变血管内皮细胞的通透性、增加血管的渗出、刺激中性粒细胞的积聚等[6]。
汉防己甲素是从防己科千金藤属植物粉防己的块根中分离出的一种双苄基异喹啉生物碱[7],具有良好抗肿瘤作用,并能减轻其他抗肿瘤治疗的毒副反应。目前汉防己甲素在临床上用于高血压、肝纤维化治疗,取得了良好的疗效[8-9]。汉防己甲素还具有免疫抑制作用,可能与干扰跨膜信号传导有关[10]。实验[11]表明汉防己甲素抗肿瘤机制有:1)通过诱导肿瘤细胞凋亡抑制肿瘤细胞生长;2)可能通过抑制潜在致死性损伤的修复而起到放射性增敏作用,其抗炎作用能减轻放射性损害;3)可减轻博莱霉素等所致肺纤维化形成前的肺泡炎症反应,从而加速氧自由基清除,减轻肺内功能细胞受损所导致的各种致纤维化因子释放,进而减轻毒副反应。
本文研究结果表明,联用汉防己甲素的患者放疗结束后1、3、6个月血清TGF-β1、TNF-α水平均低于未联用者;联用汉防己甲素的患者在放疗结束后6个月肺CO弥散量下降比未联用者少;联用汉防己甲素的患者急性放射性肺炎和放射性肺纤维化的发生率低于未联用者。
综上所述,汉防己甲素对早期放射性肺炎及晚期肺纤维化有保护作用,可以减轻肺放射性损伤,其机制可能与下调TGF-β1、TNF-α的表达水平有关。本研究样本量较小,具体机制还有赖于扩大样本量的研究证实。
参考文献:
[1]石明宏,程节凤,王琍,等.三维适行放疗同期多西紫杉醇和顺铂化疗治疗中晚期食管癌的临床观察[J].肿瘤基础与临床,2013,26(6):501-503.
[2]Rübe CE,Uthe D,Wilfert F,et al.The bronchiolar epithelium as a prominent source of pro-inflammatory cytokines after lung irradiation[J].Int J Radiat Oncol Biol Phys,2005,61(5):1482-1492.
[3]Rube CE,Uthe D,Schmid KW,et al.Dose-dependent induction of transforming growth factor beta (TGF-beta) in the lung tissue of fibrosis-prone miceafter thoracic irradiation[J].Int J Radiat Oncol Biol Phys,2000,47(4):1033-1042.
[4]Novakova-Jiresova A,Van Gameren MM,Coppes RP,et al.Transforming growth factor-beta plasma dynamics and post-irradiation lung injury in lung cancer patients[J].Radiother Oncol,2004,71(2):183-189.
[5]Hernando ML,Marks LB,Bentel GC,et al.Radiation-induced pulmonary toxicity: a dose-volume histogram analysis in 201 patients with lung cancer[J].Int J Radiat Oncol Biol Phys,2001,51(3):650-659.
[6]Rübe CE,Uthe D,Wilfert F,et al.The bronchiolar epithelium as a prominent source of pro-inflammatory cytokines after lung irradiation[J].Int J Radiat Oncol Biol Phys,2005,61(5):1482-1492.
[7]Xie QM,Tang HF,Chen JQ,et al.Pharmacological actions of tetrandrine in inflammatory pulmonary diseases[J].Acta Pharmacol Sin,2002,23(12):1107-1113.
[8]Kwan CY,Achike FI.Tetrandrine and related bis-benzylisoquinoline alkaloids from medicinal herbs: cardiovascular effects and mechanisms of action[J].Acta Pharmacol Sin,2002,23(12):1057-1068.
[9]Jin Q,Kang C,Soh Y,et al.Tetrandrine cytotoxicity and its dual effect on oxidative stress-induced apoptosis through modulating cellularredox states in Neuro 2a mouse neuroblastoma cells[J].Life Sci,2002,71(17):2053-2066.
[10]Wang G,Lemos JR,Iadecola C.Herbal alkaloid tetrandrine: fron an ion channel blocker to inhibitor of tumor proliferation[J].Trends Pharmacol Sci,2004,25(3):120-123.
[11]Lee JH,Kang GH,Kim KC,et al.Tetrandrine-induced cell cycle arrest and apoptosis in A549 human lung carcinoma cells[J].Int J Oncol,2002,21(6):1239-1244.

