Real—TimePCR方法对IBV弱毒苗致弱分析
霍亚飞+胡北侠+张秀美+张琳+杨少华+黄庆华+黄艳艳+许传田


摘要:在前期研究中,对QX基因型IBV分离株SDZB0808在SPF鸡胚连续传代前后毒株(P1和P100)进行全基因组测序。针对P1和P100毒株基因组的差异,设计特异性引物,利用SYBRGreenI实时荧光定量检测方法对其进行定量分析。结果显示:该野毒株强、弱基因并存,经鸡胚传代后,强毒毒株所占比例逐步下降,弱毒毒株所占比例逐步上升,相对值呈下降趋势,接近于零。从而推测:传染性支气管炎病毒致弱原因可能是鸡胚对弱毒基因的定向选择性筛选的结果。
关键词:鸡传染性支气管炎;Real-TimePCR;IBV弱毒苗;致弱
中图分类号:S858.31文献标识号:A文章编号:1001-4942(2015)04-0112-05
鸡传染性支气管炎(AvianInfectiousBronchitis,IB)是由传染性支气管炎病毒(IBV)引起的一类急性、高度接触性并以感染呼吸道和泌尿生殖道为主的传染病[1]。IBV为冠状病毒,5'端为复制酶引导序列形成的帽子结构,3'端为聚腺苷酸化的Poly(A)结构,全长27.6kb。IBV基因组被分成6个区域,从5'端到3'端次序为:5'cap-Replicase-S-3a-3b-M-Sa-5b-Npoly(A)3',利用不连续复制机制转录出6种亚单位组mRNAs,其中5'端2/3的基因组编码具有活性的复制酶,包含两个开放性阅读框(Openingreadingframe,ORF)ORF1a和1b,3'端1/3的基因组编码结构蛋白-纤突蛋白(Spike,S)、膜蛋白(Membrane,M)、核蛋白(Nucleocapsid,N)和囊膜蛋白(Envelope,E)[2-3]。
收稿日期:2014-12-18
基金项目:现代农业产业技术体系建设专项资金(CARS-42-712)
目前,疫苗免疫是传染性支气管炎防控的主要手段之一。本实验室筛选了1株具有广泛抗原谱的QX基因型IBV毒株SDZB0808[4],并通过鸡胚连续传代进行毒力致弱,通过对不同代次的病毒进行全基因组测序,发现传代到62代时,复制酶1a序列上缺失30bp位点(另文报道),之后的代次一直保持这种缺失状态。本研究采用SYBRGreenI实时荧光定量检测方法对不同代次的病毒进行检测,对不同代次病毒基因组进行定量分析,探讨不同代次强、弱毒株所占比例的变化规律,以期阐明传染性支气管炎弱毒株致弱机理。
1材料与方法
1.1病毒
SDZB0808(GenBank登录号为KF853202)为山东IBV分离株。
P1、P60、P100(GenBank登录号为KM586818)、P110为SDZB0808在9~11日龄SPF鸡胚分别连续传1、60、100、110代获得的子代病毒。
1.2SPF鸡胚和SPF鸡
SPF鸡胚和SPF鸡购自山东省农业科学院家禽研究所SPF鸡研究中心。
1.3主要试剂
TaqDNA聚合酶、TrizolReagentRNA抽提试剂、One-StepRT-PCR试剂盒和pMD?18-TVector均购自山东赛恩斯科技有限公司。柱式DNA胶回收试剂盒(SK8131)、一步法快速感受态细胞制备试剂盒(SK9307)、SanPrep柱式质粒DNA小量抽提试剂盒(SK8191)、定量PCR试剂ABISYBRGreenPCRMasterMix(2X)均购自上海生工生物工程股份有限公司。
1.4引物的设计与合成
参与P1和P100全基因组序列,后者比前者缺失30bp位点,为了能更好地区分这两个序列,暂把未存在缺失的序列称为强毒毒株(QD),存在缺失的序列为弱毒毒株(RD),并把弱毒毒株基因作为内参照,针对缺失部分设计特异性引物,其中缺失部分为QD的上游引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.5标准品的制备
1.5.1RNA提取与PCR扩增按照TrizolReagentRNA抽提试剂方法提取RNA,转录为cDNA后进行PCR扩增,PCR反应体系(25μL)为:模板cDNA0.5μL,上下游引物各0.5μL,dNTP(10mmol)0.5μL,TaqBuffer(10×)2.5μL,MgCl2(25mmol)2μL,Taq酶(5U/μL)0.2μL,H2O18.3μL。两个基因扩增条件均为:95℃预变性3min,94℃变性30s,56℃退火30s,72℃延伸30s,35个循环,72℃修复延伸8min。
1.5.2标准质粒的构建PCR产物用2%琼脂糖凝胶电泳鉴定。对鉴定正确的目的条带用手术刀切下,按DNA回收试剂盒步骤进行回收,将回收的PCR产物与pMD18-T载体于4℃连接过夜,连接反应体系为:Solution5μL,pMD18-TVrctor10ng,PCRProduct5μLL。将连接产物加入到50μLDH5α感受态细胞中,冰浴30min后,42℃热激45s,再冰浴15min,向其中加入600μLSOC培养基,37℃200~250r/min振荡培养1h,取100μL加入预先用100mmolIPTG20μL和20mg/mLX-gal100μL涂布的氨苄青霉素平板上,置37℃温箱培养12~24h,挑取白色单菌落扩大培养后进行菌液PCR鉴定,将鉴定为阳性的菌液用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒。对构建好的质粒进行测序。
将阳性重组质粒分别命名为pMD18-QD、pMD18-RD,用紫外分光光度计测定其在260nm处的吸光度及浓度(ng/μL),并进行10倍递增稀释,作为标准质粒模板,用于荧光定量PCR的扩增和标准曲线的建立。质粒浓度(copies/μL)=260nm处对应浓度(ng/μL)×6.02×1014/分子量。endprint
1.6标准曲线的绘制
以10倍梯度稀释的已知拷贝数的标准质粒为模板进行荧光定量检测,Real-TimePCR反应体系(20μL):SBRYGreenqPCRMasterMix(2x)10μL,上下游引物(10μmol)各1μL,ddH2O6μL,cDNA2μL。循环条件为:95℃3min,95℃15s,57℃20s,72℃30s,40个循环。
2结果与分析
2.1PCR电泳结果
2%琼脂糖凝胶,1×TAE,150V,100mA,20min电泳观察(见图1)。
2.2标准质粒OD260值测定结果
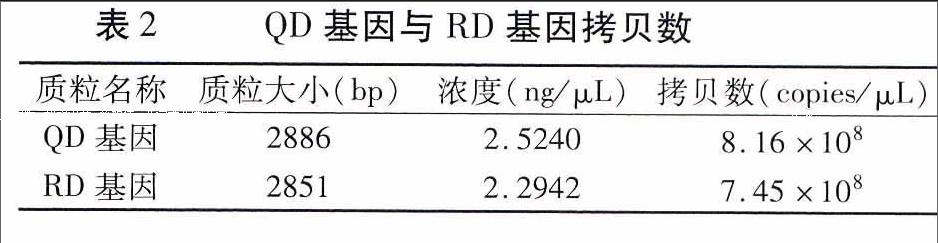
对构建好的质粒经测序鉴定无误后用紫外分光光度计测定质粒OD260值,通过公式换算可知,QD基因和RD基因的拷贝数分别为8.16×108copies/μL、7.45×108Copies/μL(表2)。
2.3标准曲线的建立
取10倍梯度稀释的QD基因和RD基因重组质粒pMD18-QD、pMD18-RD标准品分别进行实时荧光定量PCR扩增,建立以目的基因拷贝数对数为横坐标、Ct值(循环阈值)为纵坐标的标准曲线(图2-1和2-2),QD基因标准曲线表达式为:y=-3.162x+38.905,RD基因标准曲线表达式为y=-3.271x+38.933。QD基因与RD基因实时荧光定量PCR标准曲线的线性范围均达到5个数量级,各重组质粒浓度分别在8.16×104~8.16×108和7.45×104~7.45×108copies/μL之间,得到扩增动力学曲线(图3-1、3-2),其对数与相应Ct值均具有良好的相关性,决定系数(R2)分别为0.996与0.993。
2.4特异性检测
QD基因与RD基因SYBRGreenI实时荧光定量PCR产物的特异性很强,两基因特异产物的熔解峰分别为80.46℃与80.74℃,熔解曲线均为单一峰值(图4-1、4-2)。
2.5不同代次定量分析结果
Real-TimePCR检测结果显示:随着传代次数的递增,强毒毒株所占比例逐渐减少,而弱毒毒株所占比例逐步增加,两者相对值逐步下降,到P110,相对值基本为0。
3结论与讨论
IB弱毒苗是由IB分离株在鸡胚连续传代获得的,H120、MA5和2886等多种IB弱毒活疫苗用于该病的免疫预防[5,6],但这种由强毒变为弱毒的致弱机理目前还不明确。本实验室在前期研究的基础上,对不同代次毒株进行Real-timePCR检测,结果显示:在鸡胚传代过程中,强毒株所占比例随代次增加而减少,而弱毒株所占比例恰恰相反。由此可以推测,此弱毒疫苗是由强毒毒株与弱毒毒株组成的“准种”(QuasisPecies),在鸡胚连续传代过程中,鸡胚对弱毒毒株进行定向筛选,弱毒株逐渐成为优势毒株,这种推测与之前学者的报道一致[7~10],即病毒致弱可能是毒株被选择性筛选的结果。
下一步将继续传代并检测强毒毒株与弱毒毒株所占比例的变化情况,并且挑选不同代次进行安全性与免疫效力评价,以期寻找到合适的代次用于疫苗的研发。endprint

