人肝癌细胞Hep-G2的低温保存研究
姚岚 梁玮 刘宝林
(上海理工大学生物系统热科学研究所 上海 200093)
人肝癌细胞Hep-G2的低温保存研究
姚岚 梁玮 刘宝林
(上海理工大学生物系统热科学研究所 上海 200093)
在细胞的低温保存中,低温保护剂的种类与浓度对复温后的存活率有着重要影响。本文以人肝癌细胞Hep-G2为研究对象,利用慢速冷冻法,筛选最佳的冻存液配方。通过配比不同浓度的甘油、Me2SO以及在Me2SO中添加一定浓度的蔗糖、海藻糖,一周后复温细胞,对台盼蓝染色存活率、MTT存活率以及24 h贴壁率三种检测结果进行比较分析,结果表明:以Me2SO作为低温保护剂时,冻存液浓度为10%(v/v)的Me2SO复温后细胞的三种检测指标最优;以甘油作为低温保护剂时,冻存液浓度为20%(v/v)的甘油复温后细胞的三种检测指标最优;再将以上分别得到的最佳浓度(即体积浓度20%甘油、10%Me2SO)与5% Me2SO(v/v)+0.3 mol/L蔗糖、5%Me2SO(v/v)+0.3 mol/L海藻糖这四种低温保护剂进行冻存与比较,5%Me2SO(v/v)+0.3 mol/L海藻糖检测指标高于其他实验组,并且差异显著(P<0.05)。最终得到5%Me2SO(v/v)+0.3 mol/L海藻糖为慢速冷冻保存Hep-G2细胞的最优保护剂配方。
低温保存;低温保护剂;糖类;存活率
随着人类生活环境的恶化,恶性肿瘤的发病率越来越高,肿瘤的早期诊断和治疗是目前研究的热点。而临床样本作为研究肿瘤不可再生的宝贵资源,不仅对于探索新的治疗方法,发现新的诊断工具提供保障,对于制定新的诊断指标以及新药的研发也具有重要意义,所以建立肿瘤样本组织库势在必行。保持样本库中肿瘤细胞的活性,可以更加有效地保护细胞中蛋白、DNA、RNA等生物信息免受损伤,从而使后续的肿瘤基础研究结果可信、准确。但是,目前绝大多数的生物样本库均不能保持细胞的活性,所以,针对样本库中各种各样的细胞类型,研究其细胞及组织活体的低温保存方法,具有十分重要的意义。
细胞的低温保存有两种方法:慢速冷却法与玻璃化保存法[1],这两种方法都需要添加低温保护剂[2]。而低温保护剂的种类以及浓度对细胞复温后的存活率是至关重要的。自从1949年Polge C等[3]利用甘油成功的冻存精子后,至今低温保护剂的种类已达上百种。由于甘油的局限性,人们继续在寻找低温保护剂的路上进行探索;直到1959年,Lovelock等人发现了二甲基亚砜(Me2SO)后,人们对低温保护剂的种类有了更多的发现。Jolanta K等[4]利用甘油和羟乙基淀粉来冻存人体红细胞,发现羟乙基淀粉比甘油能更有效地保存红细胞的血红蛋白。Chesne C等[5]通过比较得到,Me2SO较甘油有更好的保护作用。然而有研究表明Me2SO对细胞膜有一定毒副作用,而利用非渗透性保护剂(如蔗糖,海藻糖等)与渗透性保护剂Me2SO联合应用,不仅减小Me2SO的浓度,又能达到理想的低温保存效果。Mohammed S等[6]在冻存人体原代肝细胞时添加Me2SO与Me2SO+葡萄糖这两种保护剂,两者对于复温后的存活率没有显著性差异,但通过检测相关指标得出利用后者保存后的肝功能更佳。目前,肿瘤细胞的低温保存也有较多的报导,Sui L等[7]通过以人类卵巢癌细胞以及宫颈癌细胞为研究目标,得到海藻糖+Me2SO的最优保护剂配方。李慧等[8]探讨季德胜蛇药含药血清对人肝癌细胞Hep-G2增殖和凋亡的影响。陈光等[9]利用10% Me2SO+高浓度血清的冻存液冻存胃肠道肿瘤组织原代细胞,成功率达到100%。由以上可以看出,对于不同种类的细胞,选择合适的低温保护剂,可以更好的保护细胞及其功能。
建立肝癌组织样本库,从中筛选肝肿瘤生物标志物,利用各种组学方法来早期诊断、预测肝癌,具有重要意义[10]。因此,本文以人肝癌细胞Hep-G2为研究对象,以不同浓度的甘油、Me2SO以及Me2SO联合蔗糖、海藻糖作为低温保护剂,通过对复温后细胞的台盼蓝染色存活率、MTT存活率以及24 h贴壁率三种监测指标进行对比、显著性分析等,探讨了不同保护剂对Hep-G2细胞的保存效果,优化保护剂配方,从而进一步提高低温保存Hep-G2细胞的存活率。
1 材料与方法
1·1 材料与试剂
实验材料:人肝癌细胞Hep-G2(购于中科院)。
实验试剂:HyClone胎牛血清(赛默飞世尔生物化学制品北京有限公司);Dulbecco’s Modified Eagle Medium培养基(DMEM)(GIBCO公司);台盼蓝染色液(2X),四唑盐(MTT)(碧云天生物技术公司);二甲亚砜(Me2SO)(德国APPLICHEM公司);甘油(丙三醇)(BIOSHARP公司);蔗糖、海藻糖(中国医药集团上海化学试剂公司)。
1·2 仪器与设备
实验仪器:二氧化碳培养箱(上海博讯实业有限公司);超低温冰箱(青岛海尔特种电器有限公司);低速台式离心机(上海安亭科学仪器厂);程序降温盒(赛默飞世尔生物化学制品北京有限公司)。
1·3 方法
1·3·1 细胞培养
吸除细胞培养瓶中的培养基(10%(v/v)胎牛血清+90%(v/v)DMEM培养基),加入5 mL的 DHanks液,冲洗细胞两次,再加入2 mL的0.25%胰蛋白酶消化,之后于显微镜下观察,当细胞呈现圆粒状将要分离时,吸掉胰蛋白酶溶液,加4mL培养基终止消化。反复吹打瓶壁上残留的细胞,并将已消化下来的细胞吹打均匀,然后吸入离心管中,1000 r/min离心10 min,吸除上清液,备用。
1·3·2 实验分组
根据保护剂配方种类,实验分为三组,第一组为Me2SO组,对应表1中编号1~3;第二组为甘油组,保护剂配方对应表1中编号4~6,第三组为不同保护剂组,对应表1中编号7~10。其中第三组的保护剂配方是根据第一、二组实验结果,选择Me2SO和丙三醇浓度,再配以蔗糖和海藻糖。将上述配好的冻存液各取3 mL,分别逐滴加入到处理好的细胞中,轻轻振摇混匀,在室温下平衡5 min后,再将3 mL细胞悬液均分三份滴入3支冻存管中,并在各冻存管中标注细胞的组号。表1中编号0为对照组,未加入任何保护剂。
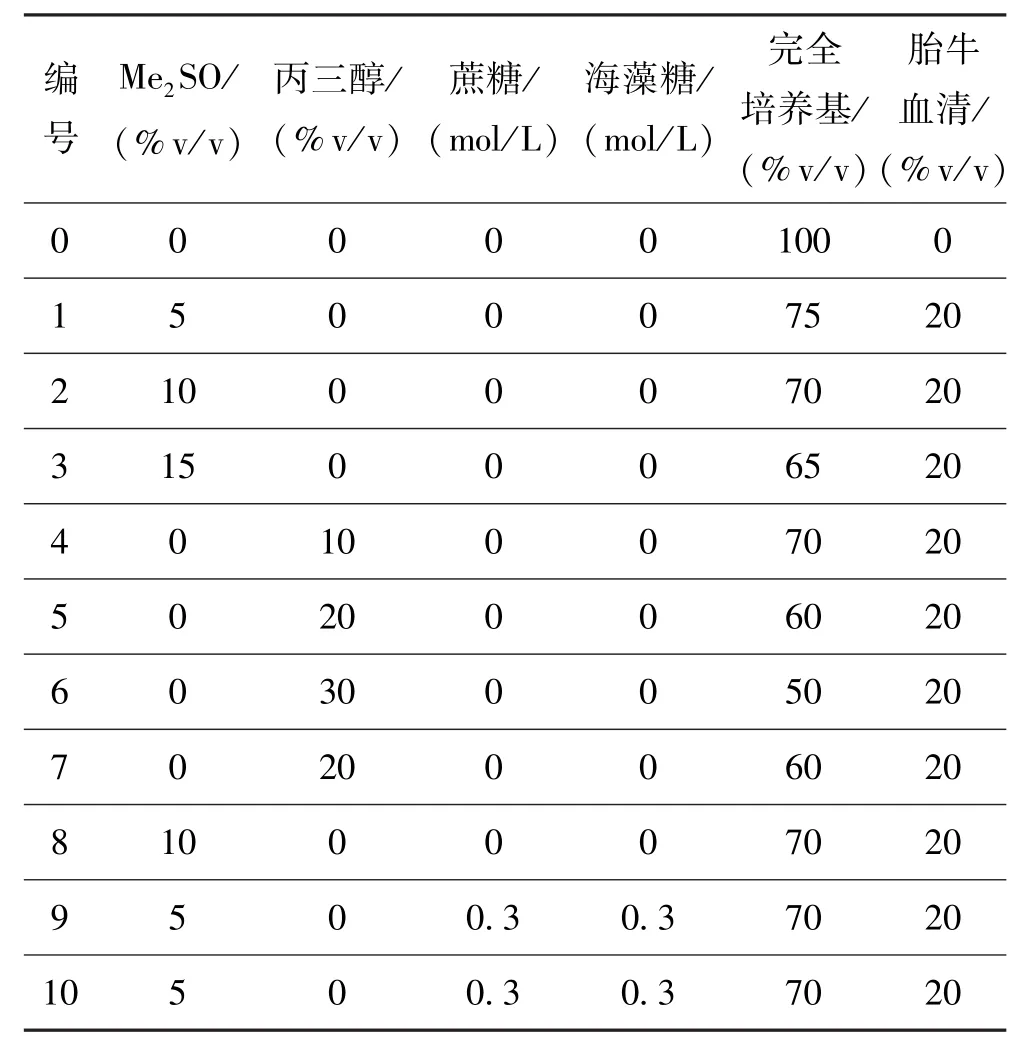
表1 保护剂分组Tab·1 The grouPof cryoprotectants
1·3·3 细胞冻存
将冻存管放入程序降温盒中,再放入-80℃低温冰箱中,根据程序降温盒的参数,能实现的降温速率为1℃/min。细胞在-80℃冻存7天。
1·3·4 细胞复苏
一周后从低温冰箱中取出冻存管,于37℃水浴中快速震荡复温,1000 r/min离心10 min并去除上清液,然后分别加入1mL培养基吹打均匀,制备成细胞悬液。
1·3·5 细胞检测
1)台盼蓝染色检测细胞存活率[11]
冻存前以及复温后的细胞吹打混匀后,取100 uL 于2 mL离心管中,再加入100 uL台盼蓝染液染色,混匀后静止3~5 min,吸取10 uL于血球计数板计数,分别记录冻存前以及复温后活细胞和死细胞数量。按以下公式计算细胞存活率:
细胞存活率(%)=

2)MTT检测细胞活性[11]
每组实验中,取复温后的细胞悬液置于96孔培养板中,每种保护剂配方有三个平行,另加一组新鲜对照组(新鲜细胞且浓度接近于复苏后细胞),一组完全培养基组;每孔加入100 uL,每组对应4个复孔,即第一、二组实验共4×14孔,第三组实验共4×17孔。待细胞铺满孔底后,每孔加入20 uL MTT,于37℃、5%CO2培养箱中避光孵育4 h,4000 r/min离心10 min,吸掉上清,每孔加入150 uLMe2SO,于37℃、5%CO2培养箱中孵育4 h后,置摇床上低速振荡10 min,待结晶物充分溶解后,在酶联免疫检测仪OD490 nm处测量各孔的吸光值。按以下公式计算细胞存活率:
细胞存活率(%)=

3)24 h贴壁率
复温后的细胞接种于细胞培养瓶中(500 uL),加入4.5 mL培养基后置于37℃、5%CO2培养箱中培养,24 h后换液并用D-Hanks液(2.5 mL)清洗两次,收集上清液,计数未贴壁细胞;接着用胰酶消化后加入培养基,1000 r/min离心10 min,计数贴壁细胞。同时观察培养肝细胞的生长情况及形态变化,按以下公式计算细胞贴壁率:
24 h贴壁率(%)=

1·4 数据分析
应用SPSS软件对数据进行处理、统计以及显著性分析。
2 结果与分析
2·1 me2SO组的细胞存活率、mTT存活率以及24 h贴壁率
冻存前,用台盼蓝染色得到细胞的存活率为(95.74±3)%。
对照组以及保护剂浓度(v/v)为5%、10%、15% 的Me2SO的细胞复温后,存活率、MTT存活率以及24 h贴壁率结果如表2所示。
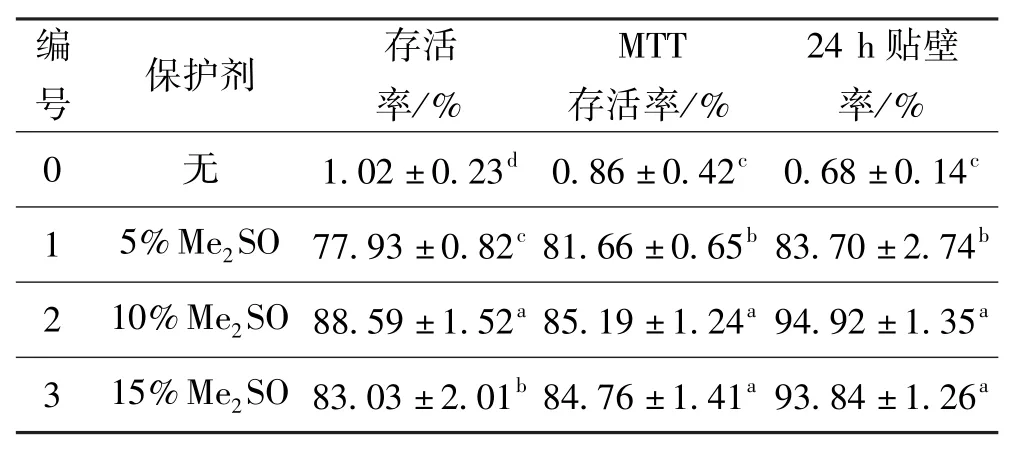
表2 保护剂为me2SO组的细胞复温后存活率、MTT存活率以及24 h贴壁率Tab·2 Trypan blue dye exclusion test,MTT assay and the attached rations after 24 h of cellwith me2SO(cryoprotectant)
从表2中可以得出,三个实验组的细胞存活率,MTT存活率以及24 h贴壁率与对照组(编号0)相比,均有显著性差异(P<0.05),说明加入5%~15%(v/ v)Me2SO的低温保护剂能够显著提高细胞的存活率。10%(v/v)Me2SO(编号2)组的细胞存活率,MTT存活率以及24 h贴壁率都较5%组高,且均具有显著性(P<0.05);而10%(v/v)Me2SO的MTT存活率以及24 h贴壁率与15%组相比,略高但无显著性差异(P>0.05),而细胞存活率差异有显著性(P<0.05)。综上所述:添加10%(v/v)Me2SO的低温保护剂,对人肝癌细胞Hep-G2能产生较好的保护作用。
2·2 甘油组的细胞存活率、MTT存活率以及24 h贴壁率
冻存前,用台盼蓝染色得到细胞的存活率为(96.66±2)%。对照组及保护剂浓度(v/v)为10%、20%、30%的甘油的细胞复温后,细胞存活率、MTT存活率以及24 h贴壁率结果如表3所示。
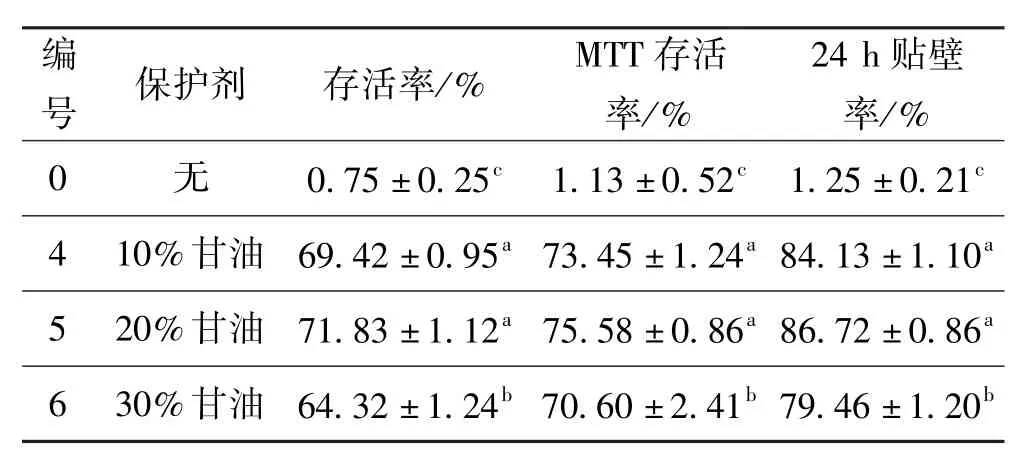
表3 保护剂为甘油组的细胞复温后存活率、MTT存活率以及24 h贴壁率Tab·3 Trypan blue dye exclusion test,mTT assay and the attached rations after 24 h of cell with glycerol(cryoprotectant)
从表3中可以得出,三个实验组的细胞存活率,MTT存活率以及24 h贴壁率与对照组(编号0)相比均有显著性差异(P<0.05),这说明加入10%~30% (v/v)甘油的低温保护剂能够显著提高细胞的存活率。20%(v/v)甘油(编号5)组的细胞存活率,MTT存活率以及24 h贴壁率都较30%(v/v)高,且均具有显著性(P<0.05);而略高于10%组,且无显著性差异(P>0.05)。综上所述:添加20%(v/v)甘油的低温保护剂的冻存效果与10%(v/v)甘油相近但稍好,对人肝癌细胞Hep-G2能产生较好的保护作用。
2·3 复方保护剂组的细胞存活率、MTT存活率以及24 h贴壁率
从前两组实验中分别选择最优保护剂,从而进行第三组复方保护机组实验。
冻存前,用台盼蓝染色得到细胞的存活率为(95.06±2)%对照组及实验组(保护剂分别为20% (v/v)甘油、10%(v/v)Me2SO、5%(v/v)Me2SO+0.3 mol/L蔗糖、5%(v/v)Me2SO+0.3 mol/L海藻糖)的细胞复温后,存活率、MTT存活率以及24 h贴壁率结果如表4所示。

表4 不同保护剂的细胞复温后存活率、MTT存活率以及24 h贴壁率Tab·4 Trypan blue dye exclusion test,MTT assay and the attached rations after 24 h of cellwith different cryoprotectant
从表4中可以得出,四个实验组的细胞存活率,MTT存活率以及24 h贴壁率与对照组(编号0)相比,均有显著性差异(P<0.05),这说明低温保护剂对细胞的低温保存有一定作用。
20%(v/v)甘油组(编号7)无论是细胞存活率,MTT存活率以及24 h贴壁率都低于其他三组实验组,这说明在这四种保护剂冻存细胞中,20%(v/v)甘油组的冻存效果最差。10%(v/v)Me2SO组(编号8),无论是细胞存活率,MTT存活率以及24 h贴壁率,都略高于Me2SO+蔗糖(编号9)但差异不显著(P>0.05),这说明两组实验冻存效果接近,但10% (v/v)Me2SO的冻存效果略好于Me2SO+蔗糖;由此得出:通过降低Me2SO浓度(v/v)加入蔗糖的低温保护剂起到一定的保护作用,但保护效果并不如10% (v/v)Me2SO。而10%(v/v)Me2SO(编号8),无论是细胞存活率,MTT存活率以及24 h贴壁率,都低于Me2SO+海藻糖(编号10),这说明Me2SO+海藻糖的冻存效果优于10%(v/v)Me2SO,即Me2SO与海藻糖的联合保护作用优于Me2SO的单独作用。
3 讨论
目前,台盼蓝染色法做为最常用的检测细胞死活的方法之一,其原理是丧失活性或是细胞膜不完整的细胞由于膜的通透性增加,可被台盼蓝染成蓝色;通常认为细胞膜完整性丧失,即可认为细胞已经死亡[11]。四唑盐比色法(MTT)是利用活细胞线粒体中的琥珀酸脱氢酶可将噻唑蓝(MTT)还原成紫蓝色(Formazan)颗粒的原理,而二甲基亚砜(DMSO)能溶解细胞中的紫色结晶物,用酶联免疫检测仪在490 nm波长处测定其光吸收值,从而间接反映活细胞数量[11]。然而,在MTT染色的过程中有的细胞虽有细胞膜的损害,但仍有酶的活性,仍属于“活细胞”,不能存活下去;并且台盼蓝染色法的误差偏大。所以这两种方法联合应用能更全面地反映细胞活性[12]。24 h贴壁率是检测细胞复温后,在24 h内的存活以及贴壁能力的一种方法;与前面两种方法不同的是,它着重于细胞复温培养后的存活能力。
细胞在降温过程中,胞外溶液会先结冰,由于冰晶的形成使细胞外的溶液浓度增大,导致细胞脱水收缩,引起细胞内原生质和细胞器的损伤。添加渗透性保护剂(如甘油、Me2SO等)后,通过结合溶液中的水分子从而弱化了水的结晶过程,达到了保护细胞的目的。保护剂浓度的不同以及细胞膜渗透能力的差异等,都会影响着细胞的冻存效果。所以本文通过前人的实验总结,针对Hep-G2细胞,筛选出最优的低温保护剂。
甘油作为最早发现以及使用的低温保护剂[1],60多年来仍然被应用在细胞的低温保存中,而甘油的浓度对低温保存效果有着重要的影响。华泽钊等[13]利用浓度为15%(v/v)的甘油冻存表皮细胞,得到92%的存活率;郝爱玲等[14]利用浓度为4%(v/ v)的甘油对鲜精低温保存的效果达到最好,由此可见不同的细胞在低温保存中对甘油的浓度要求并不相同。本文选用10%、20%、30%三种常用的甘油低温保护剂浓度,研究得到20%(v/v)甘油浓度对Hep-G2细胞低温保存效果最佳。
Me2SO作为渗透型保护剂,是冻存肝细胞最常用的保护剂[15],常用浓度(v/v)为5%~20%。杨波等[16]利用浓度为10%(v/v)的Me2SO冻存人肝细胞,存活率达到89.95%;Andre Guillouzo等[17]通过配比不同浓度的Me2SO得出:冻存老鼠肝细胞的Me2SO最佳浓度(v/v)为16%,其他动物为14%,而人肝细胞的Me2SO浓度(v/v)为10%~12%。本文基于前人对于肝细胞的研究基础,选用的Me2SO浓度(v/v)为5%~20%,得到10%(v/v)Me2SO的冻存效果最优。
糖类作为非渗透型保护剂,近些年越来越广泛的应用于低温保存中。当渗透性保护剂渗入细胞后,与细胞内的水分子结合,通过控制结晶过程而达到保护作用;而非渗透型低温保护剂虽然不能进入细胞内,但可形成细胞外的高渗,减少胞内冰的形成,虽然两者机制不同,合用可以产生协同效应,因此目前一致认为,非渗透型和渗透型保护剂混合使用的保护效果最好。并且有文献显示,糖类添加到低温保护剂中,会产生更好的保存效果。阿洛糖作为一种罕见的单糖,在某些人类细胞的保存连同Me2SO加入后,复温后的存活率有所提高[7];Me2SO中加入一定浓度的海藻糖可以提高胰岛细胞的存活率[18];在人肝细胞的低温保存中,在保护剂Me2SO中添加不同浓度的蔗糖与海藻糖,分别得到Me2SO+蔗糖、Me2SO+海藻糖的最佳浓度配比[16]。而本文选用蔗糖、海藻糖这两种常用的糖类作为保护剂添加到Me2SO中,一方面可以通过降低Me2SO的浓度来减小对细胞的毒性[19],另一方面利用糖类对细胞膜的保护性。与蔗糖相比,海藻糖具有较高的玻璃化温度、更低的引湿性、并不具有还原性,所以在低温保护剂中应用更好。因而实验数据得出浓度为 5%(v/v)Me2SO+0.3 mol/L海藻糖的冻存效果最佳;虽然浓度为5% (v/v)Me2SO+0.3 mol/L蔗糖的冻存效果不如浓度为10%(v/v)Me2SO,但两者差异并不显著,这说明蔗糖仍起到一定的保护作用。实际上,海藻糖的浓度将影响保存效果,浓度过高会抑制细胞表面分子(酶等)活性、减少Me2SO(渗透型保护剂)进入胞内、引起渗透性胞内脱水;而浓度过低起到的作用效果不够明显,所以选择最优的海藻糖浓度还有待更多的探讨。
4 结论
本文以人肝癌细胞Hep-G2为研究对象,利用慢速冷冻的低温保存程序,选取了不同浓度的Me2SO、甘油以及一定浓度的Me2SO联合蔗糖、海藻糖作为低温保护剂,对比复温后细胞的存活率和24 h贴壁率,结果表明:添加浓度为5%(v/v)Me2SO+0.3 mol/L海藻糖的细胞,复温后台盼蓝染色存活率、MTT存活率以及24 h贴壁率分别达到89.88%、92.35%、96.14%,高于其他保护剂组,并且差异显著。所以浓度为5%(v/v)Me2SO+0.3 mol/L海藻糖的保护剂冻存效果最佳。
[1] 华泽钊,任禾盛.低温生物医学技术[M].北京:科学出版社,1995:150-152.
[2] Watts P,Grant mH.Cryopreservation of rat hepatocyte monolayer cultures[J].Human&Experimental Toxicology,1996,15(1):30-37.
[3] Polge C,SmithAU,ParkesAS.Revival of spermatozoaafter vitrification and dehydration at low temprature[J]. Nature,1949,164:666.
[4] Jolanta K,Agnieszka G,Agnieszka R,etal.Evaluation of two distinct cryoprotectants for cryopreservation of human red blood cell concentrates[J].Cryoletters,2014,35 (1):15-21.
[5] Chesne C,Guillouzo A.Cryopreservation of isolated rat hepatocytes:A critical evaluation of freezing and thawing conditions[J].Cryobiology,1988,25(4):323-330.
[6] Mohammed S,Frida H,BergstromT R,et al.Improved cryopreservation of human hepatocytes usingAnew xenofree cryoprotectant solution[J].World Journal of Hepatology,2012,4(5):176-183.
[7] Sui L,Nomura R,Dong Y,etal.Cryoprotective effects of d-allose on mammalian cells[J].Cryobiology,2007,55 (2):87-92.
[8] 李慧,姚建华,田芝奥,等.季德胜蛇药含药血清对人肝癌细胞Hep-G2增殖和凋亡的影响[J].中西医结合肝病杂志,2012,22(1):32-37.(Li Hui,Yao Jianhua,Tian Zhi’ao,et al.Effects of Jidesheng Sheyaomedicated serumon proliferation and apoptosis of human hepatocellular carcinoma cell Hep-G2[J].Combine Traditional Chineseand Western Medicine Liver Disease,2012,22(1): 32-37.)
[9] 陈光,蔡慧云,魏晓军,等.胃肠道肿瘤冻存组织原代细胞培养的实验研究[J].临床军医杂志,2011,39 (4):605-607.(Chen Guang,Cai Huiyun,Wei Xiaojun,et al.Study on primary cell culture of gastroenteriCcancer tissues after cryopreservation[J].Clinical Journal of Medical Officer,2011,39(4):605-607.)
[10]王晨,卫建平,李育民.建立标准化规范化肿瘤生物样本库是转化医学的重要保障[J].中国药物与临床,2013,13(9):1176-1178.(Wang Chen,Wei Jianping,Li Yumin.EstablishAstandardized tumor biological sample library is the important guarantee of translationalmedicine [J].Chinese Remedies&Clinics,2013,13(9):1176-1178.)
[11]司徒镇强.细胞培养[M].北京:世界图书出版社,2004:3.
[12]成惠林,王袆芳,史继新,等.用四甲基偶氮唑盐比色法测定5种冷冻保存液对大鼠垂体细胞的保存效果[J].江苏医药,1998,24(5):329-330.(Cheng Huilin,Wang Huifang,Shi Jixin,et al.With tetramethyl azo azole salt colorimetry determination of five kinds of cryopreservation on the preservation effectof the rat pituitary cells [J].Jiangsu Medical Journal,1998,24(5):329-330.)
[13]华泽钊,冯世杰.皮肤低温保存的方法和工艺研究[J].中国生物医学工程学报,1991,10(2):118-126. (Hua Zezhao,Feng Shijie.Skin cryopreservation method and technology of the research[J].Chinese Journal of Biomedical Engineering,1991,10(2):118-126.)
[14]郝爱玲,阿淑艳,郑伟.不同甘油浓度对牛鲜精低温保存的影响[J].中国奶牛,2007(10):33-34.(Hao Ailing,A Shuyan,Zheng Wei.The influence of different glycerol concentration of NiuXian spermcryopreservation [J].China Dairy Cattle,2007(10):33-34.)
[15]Naik S,Santangini H A,Trenkler D M,et al.Functional recovery of porcine hepatocytes after hypothermiCor cryogeniCpreservation for liver support systems[J].Cell Transplantation,1997,6(5):447-454.
[16]杨波,周燕,刘宝林,等.肝细胞低温保存的实验研究[J].中国生物医学工程学报,2011,30(2):308-311. (Yang Bo,Zhou Yan,Liu Baolin,et al.Studies on cryopreservation of cryopreservation of human hepatocytes[J]. Chinese Journal of Biomedical Engineering,2011,30(2): 308-311.)
[17]Andre G,Laure R,Alain F.Survival and function of isolated hepatocytes after cryopreservation[J].Chemico-Biological Interactions,1999,121(1):7-16.
[18]Beattie G M,Crowe JH,LopezAD,et al.Trehalose:A cryoprotectant that enhances recovery and preserves function of human pancreatiCislets after long-termstorage[J]. Diabetes,1997,46(3):519-23.
[19]Li Y,Lu R H,Luo G F,et al.Effects of different cryoprotectants on the viability and biological characteristics of porcine preadipocyte[J].Cryobiology,2006,53(2): 240-247.
Study on Cryopreservation of Human Hepatoma Hep-G2 Cell
Yao Lan Liang Wei Liu Baolin
(Institute of Biothermal and Technology,University of Shanghai for Science and Technology,Shanghai,200093,China)
It iswell known that the type and concentration of cryoprotectant(CPAs)exertsAsignificant influence on the survival rate of cells following cryopreservation.The optimal cryoprotectant for human hepatoma Hep-G2 cell with slow coolingmethod was determined in the study.The Cells were frozen in Me2SO,glycerol,sucrose and trehalose at different concentration and combination,then stored inA-80℃ freezer for one week.The survival rate was assessed by trypan blue dye exclusion test,MTT assay and 24 h attachment assay. The results suggested that10%(v/v)Me2SO provide effective protection among Me2SO groups;20%(v/v)glycerol provide effective protection among glycerol groups;when sugars were added,5%Me2SO(v/v)+0.3 mol/L trehalose provide effective protection than the other groups(P<0.05).In conclusion,5%Me2SO(v/v)+0.3 mol/L trehalose was the presumptive optimal cryoprotectant for human hepatoma Hep-G2 cell during slow freezing.
cryopreservation;cryoprotectants;sugar;viability
TK124;R318.52
A
0253-4339(2015)02-0095-06
10.3969/j.issn.0253-4339.2015.02.095
简介
刘宝林,男,教授,博士,上海理工大学医疗器械与食品学院,13636524955,E-mail:blliuk@163.com。研究方向:低温生物。About the corresponding author
国家自然科学基金(51076108)资助项目。(The projectwas supported by the National Natural Science Foundation of China(No. 51076108).)
2014年7月7日
Liu Baolin,male,Ph.D./professor,College of Medical Equipment and Food,University of Shanghai for Science and Technology, +86 13636524955,E-mail:blliuk@163.com.Research fields:cryobiology.

