海南小果酸浆HPLC指纹图谱的研究
周松林,丁 洁,赵唤阁,黄用豪,林映莹(海南省热带病重点实验室,海南海口571199)
酸浆(Physalis alkekengi.Linn)为茄科植物酸浆属的干燥宿萼或带果实的宿萼[1],酸浆始载于《神农本草经》,名酸酱,其后历代本草多有收载,明·李时珍《本草纲目》中记载灯笼草利湿除热、清肺治咳、利湿化痰、治疽,《本草纲目拾遗》[2]中云:“灯笼草,……经霜乃红,京师呼为红姑娘。按此草主治虽多,惟咽喉是其专治,用之功最捷。……性寒、治咽喉肿如神。酸浆原产于南美洲,在我国野生资源十分丰富,能抗病虫害,生命力极强[3]。我国酸浆属约5种,南北均产,海南1种,即小果酸浆(Physalis minima),主要分布于中南及西南地区,海南低海拔地区常见,生于旷野、荒地及路旁等处[4]。酸浆全草含有酸浆苦素A-T(Physailin A-T)等苦味素类化合物(physalins)和黄酮类化合物如木犀草素(luleolsn,3',4',5,7-四羟基黄酮)、木犀草素-7-O-β-D葡萄糖苷、酸浆黄酮醇等,以及甾醇类化合物如β-谷甾醇、马尾藻甾醇(24ε-羟基-24-乙烯基胆甾醇)等[5-11]。由于不同采收期小果酸浆中的成分有一定变化,从而影响到用药的疗效,因此需对小果酸浆的化学成分进行全面地评价,以保证用药安全及疗效的稳定性。近些年,指纹图谱技术得到广泛应用[12-14],笔者采用HPLC-UV-MS法建立了小果酸浆的HPLC指纹图谱,得到能够标示其特性的共有色谱峰图谱,再通过高分辩率的LC-MS鉴定其共有色谱峰,为小果酸浆药材的采收及其内在质量的均一性提供全面的质量控制依据。
1 材料与方法
1.1 仪器 双光束紫外可见分光光度计:HITACHI U-2900型;高效液相色谱仪:HITACHI L-2000型(检测器:L-2420;泵:L-2130;色谱柱:L-2300;进样器:L-2200);色谱柱:LaChrom C18(4.6 mm×150 mm);液相色谱-质谱联用仪:ABSciex API4000三重四极杆液质联用仪;电子天平:METTLER TOLEDO PL2002;超声波清洗器:JN-5200DTD。
1.2 试药 所用海南小果酸浆药材于不同季节在海南海口美舍河旁采集,并由海南医学院曾开念博士鉴定为小果酸浆Physalis minima Linn.,样品分别阴干、粉碎过80目后供分析用。药材编号、来源、采集时间见表1。甲醇、乙腈均为TEDIA色谱纯;乙酸、磷酸为国产分析纯;水为实验室自制18.2Ω的超净水,经超声洗涤器超声。所配置的流动相均通过0.45 μm 的滤膜过滤。
1.3 方法
1.3.1 样品溶液的配制。分别取不同批次的样品小酸浆粉末3.00 g,加15 ml甲醇摇匀,超声提取6 h,提取液置于50 ml棕色容量瓶中,重复2次,合并3次提取液于容量瓶中,定容。取溶液经微孔滤膜滤过,滤液备用。
1.3.2 HPLC 条件摸索。扫描显示在波长 238、381、394、410、468、536 nm时均有吸收峰,其中在238 nm的吸收峰最为明显。同时参考相关文献[6-9,15-16]并考虑到色谱柱的差异,在相同色谱条件下(流动相:乙腈-0.1%磷酸20∶80;流速1.0 ml/min,进样量 10 μl),用 220、230、240、260,380,390 nm不同检测波长进行分析,发现在检测波长230 nm时,各峰吸收面积最大,故确定230 nm为检测波长。
参考相关文献[6-9,15-16],以此色谱柱初步拟定以下几种溶液为流动相。a:甲醇-2%醋酸(45∶55,V/V)、b:甲醇-乙腈 -0.1%磷酸(5∶15∶80,V/V/V)、c:乙腈 -0.1%磷酸(34∶66/20∶80/15∶85),在相同色谱条件下(检测波长 230 nm;流速 1.0 ml/min,进样量 10 μl),分别以 a,b,c(3 种比例)为流动相进行分析,发现c在15∶85时波峰峰型较高,分离度较高,波峰面积较大,故确定乙腈 -0.1%磷酸(15∶85,V/V)为流动相条件。
分别取样品滤液 1 ml稀释至 1、2、5、10、20 和 50 倍,在相同色谱条件下(流动相∶乙腈-0.1%磷酸20∶80;检测波长:230nm;流速 1.0 ml/min,进样量 10 μl),发现在稀释 5 倍时不仅分离度较好,且峰面积较大,故选择将样品溶液稀释5倍后分析。
1.3.3 质谱条件。质谱采用电喷雾离子化方式,正离子模式,扫描范围m/z 100~1 000;喷射电压为5 500 V;干燥气流速10 L/min,干燥气温度550℃,雾化室压21 758 Mpa,毛细管电压4 kV;传输电压70 V,进样量5 μl。
1.3.4 指纹图谱的建立与共有指纹峰的指认。
1.3.4.1 指纹图谱的建立。取“1.3.1”制备的供试品溶液稀释5 倍后各10 μl,在“1.3.2”所述条件下进行测定,得到5批不同批次小果酸浆HPLC指纹图谱,根据色谱图中各色谱峰的相对保留时间,确定共有峰,并选取其中20个共有峰作为特征指纹峰,建立的指纹图谱见图1。
1.3.4.2 共有指纹峰的标定。小果酸浆HPLC指纹图谱中,从42个峰中得到共有指纹峰20个,其共有峰的相对保留时间和相对峰面积见表2和3。
1.3.4.3 共有指纹峰的指认。采用Q-TOF-MS-IDA-MS/MS技术,参考相关文献[5-11],对HPLC指纹图谱20个共有峰中的14个色谱峰进行了指认,结果见表4。
2 结果与分析
2.1 精密度 取同一供试品溶液按“1.3.2”条件连续测定5次,考察各共有峰的相对保留时间和相对峰面积的RSD。结果相对保留时间RSD<0.3%,相对峰面积RSD<3.0%。
2.2 稳定性 取同一供试品溶液按“1.3.2”条件,分别在0、4、8、12、24 h测定其指纹图谱,考察各共有峰的相对保留时间和相对峰面积的RSD。结果相对保留时间RSD<0.5%,相对峰面积RSD<5.0%。
2.3 重复性 按照“1.3.1”供试品溶液制备方法平行处理同一批次样品5份,按“1.3.2”条件分别测定,考察各共有峰的相对保留时间和相对峰面积的RSD。结果相对保留时间RSD <0.5%,相对峰面积 RSD <5.0%。
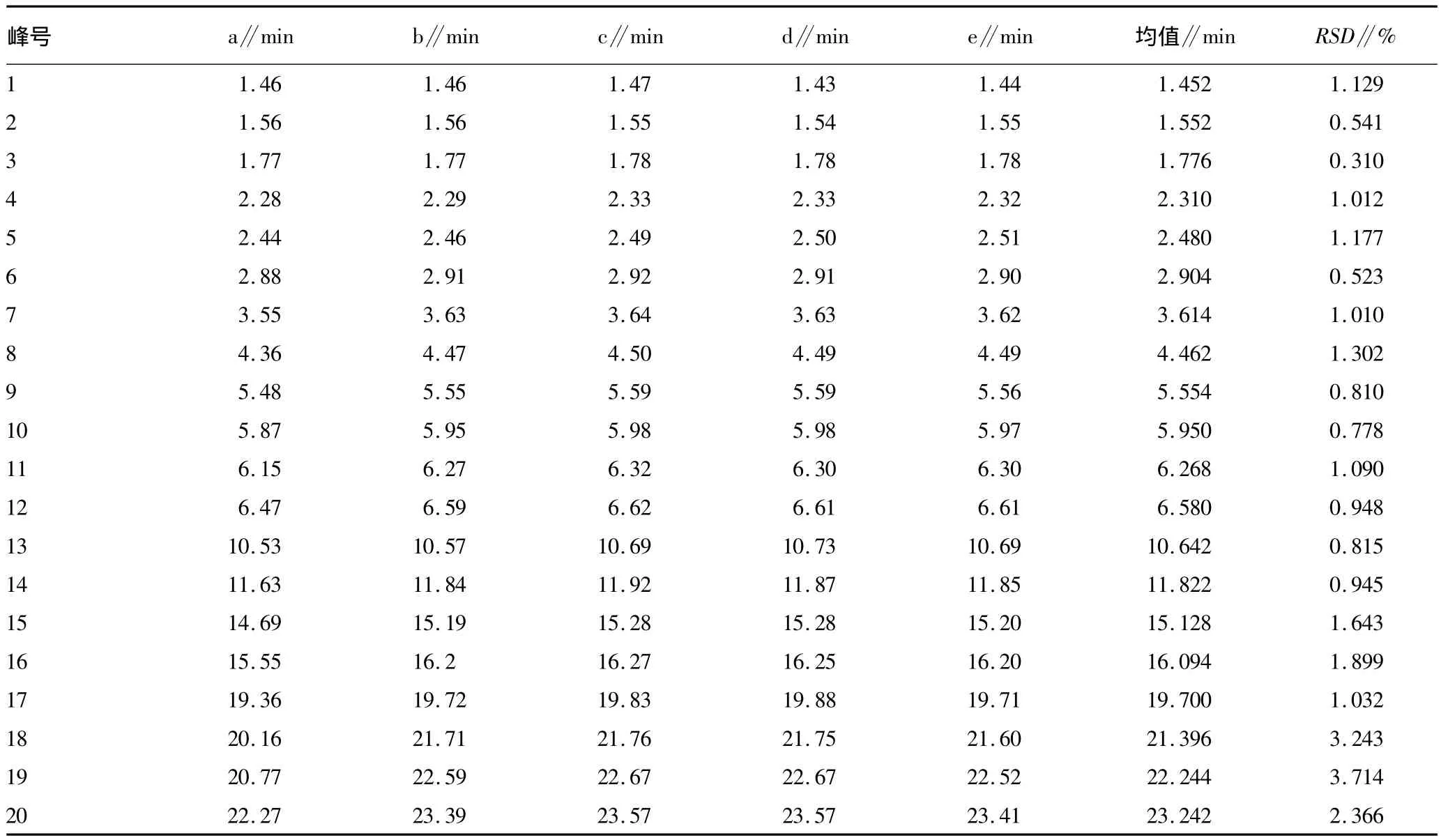
表2 小果酸浆共有峰相对保留时间
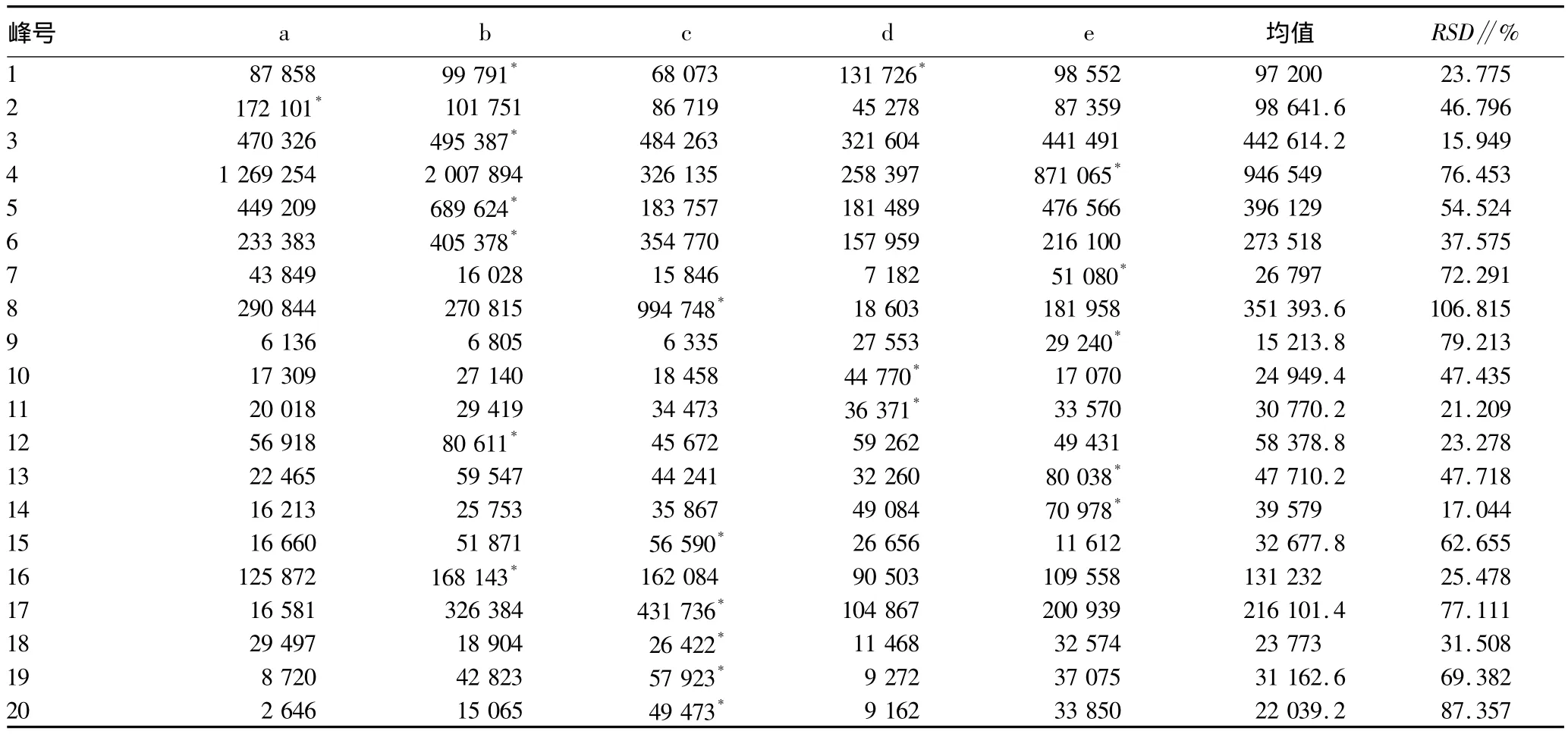
表3 小果酸浆不同季节共有峰的相对峰面积

表4 小果酸浆指纹图谱共有峰的指认结果
3 讨论
指纹图谱是目前控制中药材质量最有效、最直观的手段之一。该研究采用HPLC-UV-MS方法,建立了小果酸浆不同季节的指纹图谱。结果表明,该方法稳定、可靠、重现性好,可为小果酸浆质量分析、评价与控制提供依据。
从该试验结果看,不同季节的小果酸浆成分含量是有变化的,相对而言,在7月份采集时苦味素类含量较高,但总峰面积与共有峰总面积却是4月份最高,因而在采集小果酸浆某种成分时,可在其含量水平最高的季节采集,为小果酸浆在临床治疗提供理论支持。
由于该试验HPLC-UV仪器采用日本HITACH公司的LC2000,所获得的数据无法通过国家药典委员会的中药色谱指纹图谱相似度评价系统2004A版软件进行相似度评估,建议国家药典委员会在编写新版的版软件进行相似度评估系统时,考虑到其他系统的版本,所要求的“TXT”及ASII码编写文档更简便、大众化些。
[1]国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2010:1,296.
[2]清·赵学敏.本草纲目拾遗[M].北京:人民卫生出版社,1957:116.
[3]中国科学院编辑委员会.中国植物志[M].北京:科学出版社,2010.
[4]刘雅杰,于德江,李宝荣.酸浆资源和利用[J].中国野生植物,1990(2):10.
[5]袁野.酸浆的化学成分及质量控制研究[D].沈阳:辽宁中医药大学,2010.
[6]郑运亮.乌药、锦灯笼药效物质及质量评价方法研究[D].杭州:浙江大学,2012
[7]KAWAI M,YAMAMOTO T,MAKINO B,et al.The structure of physalin T from Physalis alkekengi var.franchetti[J].J Asian Nat Prod Res,2001,3(3):199-205.
[8]KAWAI M,MATSUURA T,KYUNO S,et al.A new physalin from physalis alkekengi:structure of physalin L[J].Phytochemistry,1987,26(12):3313-3317.
[9]RAMACHANDRA L,SAMBI K,SUBRAHMANYA N,et al.New physalins from physalis angulata and physalis lancifolia,structure and reactions of physalins D,I,G and K[J].Phytochenistry,1980,19:1175 -1181.
[10]许玬,王冰,周翎,等.酸浆化学成分的研究[J].中草药2009,40(2):175-178.
[11]李静,李娟,李德坤.锦灯笼化学成分的研究(Ⅰ)[J].中草药,2002,33(8):6922-6931.
[12]CHEN C,ZHANG H,XIAO W,et al.High-performance liquid chromatographic fingerprint analysis for different origins of sea buckthorn berries[J].Journal of Chromatography A,2007,1154:250 -259.
[13]LIU A H,LIN Y H,YANG M,et al.Development of the fingerprints for the quality of the roots of Salvia miltiorrhiza and its related preparations by HPLC-DAD and LC-MSN[J].Journal of Chromatography B,2007,846:32-41.
[14]MICHAEL H N.A new flavonol diglycoside from solenostemma arghel leaves[J].Asian Journal of Chemistry,1998,10(4):1038 -1040.
[15]董雪,刘玉强,才谦.HPLC测定锦灯笼宿萼中酸浆苦素P的含量[J].中成药,2009,31(8):1304 -1306.
[16]施蕊,贾凌云,孙启时,等.RP-HPLC测定酸浆药材中3种有效成分的含量[J].药物分析杂志,2008,28(2):260 -262.

