SpermCryo无卵黄冷冻液对食蟹猴精子冷冻保存的影响
支大龙,敖 磊,王 宏,季维智,3,司 维,3*(1.昆明理工大学生命科学与技术学院,云南昆明650093;2.云南中科灵长类生物医学重点实验室,云南昆明650500;3.昆明亚灵生物科技有限公司,生物医学动物模型国家地方联合工程研究中心,云南昆明650500;.昆明医科大学第一附属医院,云南昆明650032)
灵长类动物是生物医学研究中广泛使用的实验动物,由于其在生理生化和遗传上与人类高度接近,因此成为研究人类疾病适宜的动物模型。然而,随着人类对灵长类动物栖息地的破坏,其数量急剧下降。种质资源的低温保存为灵长类动物的迁地保护和生物多样性保护提供了一条有效的途径。目前,灵长类动物的精子冷冻保存的方法大多倾向于经验性,而且难以准确重复。食蟹猴是一类重要的灵长类实验动物,其精子冷冻复苏后往往受到冷冻损伤,复苏后精子活力明显下降,从而导致受精能力下降[1-3]。研究表明,不同类型的冷冻液对食蟹猴精子的冷冻保护作用存在差异,冻存后精子的复苏活力也有明显差异[4]。目前已报道的灵长类动物精子冷冻液中,卵黄作为非渗透性保护剂是主要成分之一,其使用浓度通常为10% ~20%[5-6]。通常认为卵黄主要是通过影响精子质膜的相变而起到抗冷休克的左右[7],起主要作用的可能是卵黄中的一类低密度脂蛋白,另外卵黄中的卵磷脂能稳定精子细胞膜,防止顶体破裂,减轻冷冻引起的精子冷休克[8]。但是,由于卵黄的构成成分较为复杂,使深入研究精子冷冻损伤的机制变得十分困难。此外,由于卵黄通常来源于家禽的蛋,可能携带一些潜在的传染性病原体(病毒、细菌、支原体)[9-10],这极大增加了对精子污染的风险,甚至影响精子的受精能力,导致应用冷冻精子开展体外受精和人工授精的成功率下降,并增加疾病传播的风险。此外,不同来源的卵黄质量参差不齐,其对精子的冷冻保护效果也就存在差异[11-12],难以标准化。因此,建立高效、安全、质量可控的无卵黄冷冻液及相应的冷冻降温程序对于冷冻精子在辅助生殖方面的应用以及精子冷冻损伤机制的研究至关重要。除了冷冻液以外,冷冻降温速率也是影响动物精子冷冻复苏存活率的重要因素之一。每个物种精子冷冻保存的适宜冷冻降温速率与使用的冷冻液种类和冷冻保护剂的浓度有关[13-15]。现有的食蟹猴精子冷冻研究报道使用的降温速率各不相同[3,16],目前还未见到关于研究降温速率对食蟹猴精子冷冻复苏存活率的报道。
SpermCryoTMAll-round是应用于人类精子冷冻保存的商品化的无卵黄冷冻液[17],该冷冻液采用甘油作为冷冻保护剂,使用该冷冻液保存人类精子的冷冻程序简单,且冷冻液的质量标准化已成功应用于人类精子的低温保存[17]。然而,迄今为止尚未见到在灵长类动物的精子冷冻保存中使用SpermCryo的研究报道。因此,笔者选取食蟹猴作为试验对象,以冷冻复苏精子活力和顶体完整率作为精子功能状态的检测指标,使用SpermCryo冷冻液冷冻保存食蟹猴精子,研究在液氮蒸汽中冷冻降温的时间以及不同的冷冻降温速率对食蟹猴精子冷冻复苏效率的影响,优化冷冻方法,最终建立基于SpermCryo无卵黄冷冻液的食蟹猴精子冷冻保存的方法。
1 材料与方法
1.1 实验动物 4只雄性健康、可育的食蟹猴(年龄8~10岁),来自通过国际AAALAC认证的昆明亚灵生物科技有限公司。每只食蟹猴单笼饲养,保持每天12 h光照、12 h黑暗,17~22℃室温。实验动物的使用和试验方案通过了昆明亚灵生物科技有限公司动物使用和管理委员会(IACUC)的批准。
1.2 试剂 SpermCryoTMAll-round为商品化冷冻液(Provitro,Fredericia,Denmark)。葡萄糖、乳糖和牛血清白蛋白(BSA),均来自Sigma公司(St Louis,MO,USA)。冷冻麦管来自IMV Technologies公司(IMV,L’Aigle,France)。花生凝集素来自Molecular Probes公司(Alexa Fluor-488-PNA,Molecular Probes,Eugene,OR,U.S.A.)。
1.3 精液的采集 雄猴通过肌肉注射盐酸氯胺酮(4 mg/kg体重)麻醉,使用美国Grass公司产S44型方波发生器通过阴茎电刺激采集精液[18]。
1.4 降温速率和解冻复温速率的测定 精子冷冻的降温速率和解冻复温速率的测定方法参照以前的相关报道[16,19]。将食蟹猴精子冷冻液装入0.25 ml的冷冻麦管中,然后将直径0.25 mm的T型5SRTC-TT-T-30热电偶(Omega Engieering,Inc.Stamford,CT,USA)的一端插入麦管中,另一端与 8-通道USB热电偶数据采集模块(TC-088,Omega Engieering,Inc.Stamford,CT,USA)相连接。将热电偶数据采集模块与微机相连,运行TC-088软件,然后将冷冻麦管分别置于泡沫盒内距液氮表面1、4和7 cm处收集每秒钟的温度变化,然后计算距液氮表面不同距离的冷冻降温速率。同样,将装有热电偶的冷冻麦管从-196℃液氮中直接投入37℃水浴中2 min中,利用热电偶数据采集模块收集数据,并计算解冻复苏速率。
1.5 食蟹猴精子的冷冻保存和解冻复苏 将采集的精液于37℃水浴中液化 30 min后,用含 0.15 mol/L乳糖、0.15 mol/L葡萄糖和0.3%BSA的溶液稀释至终浓度7×106个/ml[20],检测新鲜精子活力和顶体完整率。然后,参照SpermCryo说明书的方法进行精子冷冻:室温下加入Sperm-Cryo防冻液(精液与冷冻液比例为3∶1),室温静置10 min。然后,再将精液装入0.25 ml冷冻麦管封口后,将麦管分别至于液氮上方4 cm处降温10和30 min后直接投入液氮中冷冻保存。精子复苏时将麦管直接投入37℃水浴中2 min,并加以搅动使精子解冻复苏。
1.6 精子功能的检测
1.6.1 精子活力的检测。分别取10 μl新鲜精子或冷冻复苏精子样本置于37℃预热的Makler精子计数板上,在光学显微镜下记录运动精子数,计算运动精子占精子总数的百分率,即为精子活力。每次至少计数200个精子,每份样品计数2次,最后精子活力为2次计数所得的平均值。然后,按照以下公式计算精子冷冻复苏率:精子冷冻复苏率=冷冻后精子活力/鲜精精子活力×100%。
1.6.2 顶体完整率的检测。将精子样本涂片,放置于通风橱内平整的桌面上,于室温下待其完全干燥;吸取无水乙醇滴加在涂片上,均匀完整地覆盖涂片;待无水乙醇自然风干后,将涂片置于湿盒中,湿盒的四周和盖子进行避光处理,并将湿盒置于37℃的温台上;将10 μg/ml的Alexa Fluor-488-PNA溶液滴加在涂片上,于37℃孵育30 min;用PBS将涂片表面的Fluor-488-PNA溶液冲洗掉;将涂片置于37℃的温台上,遮光并待其风干;将涂片置于荧光显微镜下检测精子顶体完整性(发射光波长515 nm,激发光波长488 nm)。顶体完整的精子头部被染成均匀的苹果绿色,而发生了顶体反应的精子头部则仅部分着色或不被染色。记录顶体完整精子占精子总数的百分率。每次至少记录200个精子。计数200个精子,计算顶体完整率[21]。
1.7 冷冻平衡时间对食蟹猴精子冷冻复苏活力的影响 将采集的精液液化稀释后,根据SpermCryo说明书,室温下加入SpermCryo冷冻液,精液与冷冻液比例为3∶1,室温下静止10 min。再将精液装入麦管封口后,将麦管分别置于液氮上方4 cm处降温10和30 min。
1.8 降温速率对食蟹猴精子冷冻复苏活力的影响 采集的精液液化稀释后,室温下加入SpermCryo冷冻液,精液与冷冻液比例为3∶1,室温静止10 min。再将精液装入麦管封口后,将麦管分别至于液氮上方1、4和7 cm处降温,冷冻平衡时间采用较好的冷冻平衡时间。
2 结果与分析
2.1 冷冻平衡时间对食蟹猴精子冷冻复苏活力的影响 食蟹猴精子在距液氮面4 cm处分别冷冻平衡10和30 min,测定精子冷冻保存后的复苏活力。从图1可以看出,与新鲜精子相比,冷冻保存显著降低了精子的活力(P<0.05)。精子在液氮上方冷冻10和30 min存在显著差异,用10 min冷冻平衡时间保存的精子复苏活力显著高于冷冻平衡30 min的精子复苏活力(P<0.05)。从图2可以看出,与新鲜精子相比冷冻保存显著降低了精子完整性(P<0.05)。但是,精子在液氮上方冷冻平衡10和30 min中未发现显著差异(P >0.05)。
2.2 降温速率对食蟹猴精子冷冻复苏活力的影响 食蟹猴精子在距液氮面1、4、和7 cm处冷冻平衡10 min后投入液氮时的冷冻降温速率度分别是-435、-183、和-69℃/min。精子从-196℃的液氮中转至37℃水浴解冻复苏的速率为1 200℃/min(表1)。由表1可知,与新鲜精子相比冷冻保存显著降低了精子的活力(P<0.05)。用快速冷冻(液氮面上方1 cm)和中速冷冻(液氮面上方4 cm)保存的精子复苏活力显著高于慢速冷冻(液氮面上方10 cm)(P<0.05),而在液氮上方1 cm和4 cm冷冻保存精子的复苏活力没有显著差异(P>0.05)。从图3可以看出,与新鲜精子相比冷冻保存显著降低了精子顶体完整性(P<0.05),但是精子的顶体完整性在不同的降温速率的各组之间没有显著差异(P >0.05)。
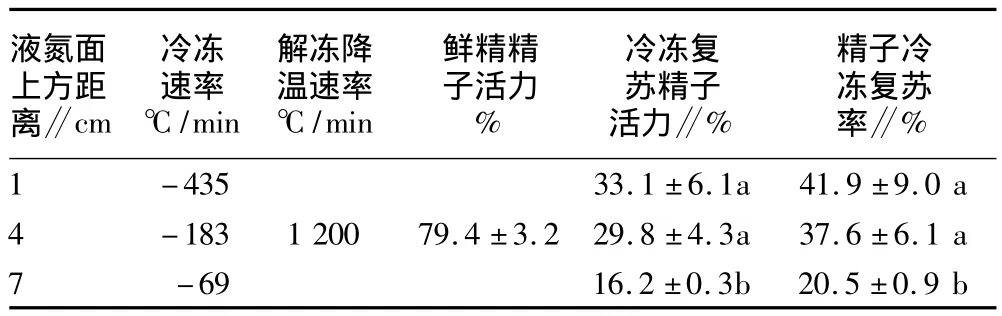
表1 不同降温速率对的食蟹猴精子冷冻前后复苏活力的影响
3 讨论
SpermCryo冷冻液已经成功应用于人类精子的冷冻保存,该产品推荐采用的液氮蒸汽冷冻平衡时间为30 min[17]。研究表明,液氮蒸汽冷冻平衡时间可以对猕猴精子冷冻保存复苏活力产生影响[16]。然而,食蟹猴冷冻保存中冷冻平衡时间对食蟹猴精子冷冻保存复苏活力的影响尚不清楚。研究表明,在胞内开始形成冰核时细胞外的渗透压已经升高10倍[22]。因此,冷冻降温过程中食蟹猴精子冷冻平衡时间可能会影响胞内冰晶形成,从而造成精子的冷冻损伤。笔者通过采用在液氮蒸汽中冷冻平衡10和30 min冷冻食蟹猴精子,比较了不同冷冻平衡时间对食蟹猴精子复苏活力的影响。结果表明,采用SpermCryo作为冷冻液,液氮蒸汽平衡时间为10 min可获得较高的食蟹猴精子冻存复苏活力。研究表明,非人灵长类精子细胞膜对水的通透性在冰点以下时较在冰点以上时成百倍下降[23]。因此,食蟹猴精子在冷冻过程中脱水过程主要发生在冰点以前,延长冷冻平衡时间(30 min)并不能进一步使精子细胞脱水,反而可能使精子长期处于高浓度溶质和高渗透压的非正常生理环境导致食蟹猴冷冻精子的复苏活力下降。该研究冷冻平衡时间与Li等[1]报道的液氮蒸汽冷冻平衡时间(10 min)相似,说明食蟹猴精子在冷冻保存时液氮蒸汽冷冻平衡10 min已经脱水充分。
研究表明,不同的细胞类型和不同的冷冻液存在着数值各不相同的最佳冷冻速率。Mazur等针对细胞在冷冻时存在最佳冷冻降温速率,提出了细胞冷冻损伤的“两因素”假说[24]:如果降温速率过快,精子还没有充分脱水,水分已经在胞内形成胞内冰晶,从而导致精子受到胞内冰晶损伤(Intracellular ice formation damage);如果冷冻速率过慢,导致细胞外溶液溶质浓度和渗透压的过高,细胞长期处于这种非正常生理环境中而受到溶液损伤(Solution damage)。因此,精子在冷冻过程中使用最佳冷冻速率时,可获得最高的精子冷冻保存复苏活力。以前研究表明不同的冷冻降温速率可以影响猕猴精子的冷冻复苏存活率猕猴精子冷冻保存的适宜降温速率为液氮面上方4 cm处及降温速率-183℃/min[16]。然而,SpermCryo冷冻液的商品使用说明中并未推荐精子冷冻保存的最佳降温速率。该研究采用3种不同的降温速率1、4和7 cm(相应的降温速率分别是 -435、-183和-69℃/min)冷冻食蟹猴的精子,比较了不同降温速率对食蟹猴精子复苏活力的影响。结果表明,虽然采用-435℃/min冷冻速率可以获得最高的精子复苏活力。但是,与采用-183℃/min冷冻速率获得的精子复苏率并没有明显差异。这与猕猴精子冷冻保存使用的最佳冷冻速率-183℃/min不同[16]。这可能是由于物种差异或者使用不同冷冻液和冷冻方法所致。另外,精子冷冻保存后,与精子活力相比,精子顶体的完整性受到冷冻速率和冷冻平衡时间的影响较小,表明精子的活力对于冷冻速率和冷冻平衡时间更为敏感。这与Li等[1]报道的用含卵黄的冷冻液保存的食蟹猴精子解冻复苏后的顶体完整率的结果类似。
研究表明,不同类型的冷冻液保护剂对精子冷冻保存精子复苏活力有明显差异[4]。由于无卵黄冷冻液与卵黄冷冻液相比成分简单,这对于食蟹猴精子冷冻保存中保护机制的研究十分重要。此外,由于卵黄潜在含有的传染性病原体(病毒、细菌)可能增加卫生安全的风险[9-10]。笔者通过采用无卵黄SpermCryo冷冻液冷冻保存食蟹猴精子获得41.9%的精子冷冻保存复苏率,达到Paras L报道采用SpermCryo冷冻液获得人类精子冷冻保存精子复苏率(32.3%)水平。此外,SpermCryo冷冻液的冻存方法简单迅捷,经过该试验优化后的整个精子冷冻过程只需要20 min,明显比先前报道的精子冷冻过程时间(180 min)短[25],操作步骤简单。
笔者使用SpermCryo冷冻液冷冻保存食蟹猴精子,研究液氮蒸气平衡时间和降温速率对食蟹猴精子冷冻保存精子复苏活力的影响方法,建立了SpermCryo无卵黄冷冻液冷冻保存食蟹猴精子的方法。食蟹猴精子冷冻保存中采用液氮蒸气平衡10 min和距液氮面1和4 cm的降温速率可获得较高食蟹猴精子冷冻保存复苏活力。与常规冷冻保存方法相比,采用SpermCryo这种商品化无卵黄冷冻液可以简单快速完成食蟹猴精子的冷冻保存,对深入研究食蟹猴精子的冷冻损伤机制及其在辅助生殖中的应用具有重要意义。
[1]LI Y,CAI K,LI J,et al.Comparative studies with six extenders for sperm cryopreservation in the cynomolgus monkey(Macaca fascicularis)and rhesus monkey(Macaca mulatta)[J].Am J Primatol,2006,68(1):39 -49.
[2]FERADIS A H,PAWITRI D,SUATHA IK,et al.Cryopreservation of epididymal spermatozoa collected by needle biopsy from cynomolgus monkeys(Macaca fascicularis)[J].Med Primatol,2001,30:100 -106.
[3]SANKAI T,TERAO K,YANAGIMACHI R,et al.Cryopreservation of spermatozoa from cynomolgus monkeys(Macaca fascicularis)[J].Reprod Fertil,1994,101:273 -278.
[4]LI YH,CAI KJ,KOVACS A,et al.Effects of various extenders and permeating cryoprotectants on cryopreservation of cynomolgus monkey(Macaca fascicularis)spermatozoa[J].Androl,2005,26(3):387 -395.
[5]MARTORANA K,KLOOSTER K,MEYERS S.Suprazero cooling rate,rather than freezing rate,determines post thaw quality of rhesus macaque sperm.[J]Theriogenology,2014,81(3):381 -388.
[6]SI W,ZHENG P,TANG X,et al.Cryopreservation of rhesus macaque(Macaca mulatta)spermatozoa and their functional assessment by in vitro fertilization[J].Cryobiology,2000,41(3):232 -240.
[7]DROBNIS E Z,CROWE L M,BERGER T,et al.Cold shock damage is due to lipid phase transitions in cell membranes:a demonstration using sperm as a model[J].Exp Zool,1993,265(4):432 -437.
[8]PELFREY RJ,OVERSTREET JW,LEWIS EL.Abnormalities of sperm morphology in case of persistent infertility after vasectomy reversal[J].Fertil Steril,1982,38:112 -116.
[9]SHIN S J,LEIN DH,PATTEN VH,et al.A new antibiotic combination for frozen bovine semen.1.Control of mycoplasmas,ureaplasmas,Campylobacter fetus subsp.Venerealis And Haemophilussomnus[J].Theriogenology,1988,29:577 -591.
[10]BOUSSEAU S,BRILLARD J P,MARGUANT-LE GUIENNE B,et al.Comparison of bacteriological qualities of various egg yolk sources and the in vitro and in vivo fertilizing potential of bovine semen frozen in egg yolk or lecithin based diluents[J].Theriogenology,1998,50:699 -706.
[11]FRASER L,JASIEWICZ E,KORDAN W.Supplementation of different concentrations of OrvusEs Paste(OEP)to ostrich egg yolk lipoprotein extender improves post-thaw boar semen quality[J].Pol J Vet Sci,2014,17(2):225-230.
[12]SU L,LI X,QUAN J,et al.A comparison of the protective action of added egg yolks from five avian species to the cryopreservation of bull sperm[J].Anim Reprod Sci,2008,104(2/4):212 -219.
[13]KOSHIMOTO C,MAZUR P.Effects of cooling and warming rate to and from -70 degrees C,and effect of further cooling from -70 to -196 degrees C on the motility of mouse spermatozoa[J].Biol Reprod,2002,66:1477-1484.
[14]STACY R,EROGLU A,FOWLER A,et al.Thermal characterization of Nakagata’s mouse sperm freezing protocol[J].Cryobiology,2006,52:99-107.
[15]SUMIGAMA S,MEYERS S.Cooling rate affects rhesus monkeyspermsurvival[J].Med Primatol,2012,41(4):278 -283.
[16]YANG S,PING S,JI S,et al.The positive effects of seminal plasma during the freezing process on cryosurvival of sperm with poor freezability in the rhesus macaque(Macacamulatta)[J].Reprod Dev,2011,57(6):737 -743.
[17]PARAS L,FREISINGER J,ESTERBAUER B,et al.Cryopreservation technique:comparison of Test yolk buffer versus Sperm Cryo and vapour versus computerised freezing[J].Andrologia,2008,40(1):18 -22.
[18]杨上川,季维智,陈建春,等.一种改进的阴茎电刺激采精法和猕猴藏酋猴及熊猴的采精及其精液特征的初步研究[J].动物学研究,1994(15):77-83.
[19]SI W,LU Y,HE X,et al.Directional freezing as an alternative method for cryopreserving rhesus macaque(Macaca mulatta)sperm[J].Theriogenology,2010,74(8):1431 -1438.
[20]SI W,WANG H,REID C,et al.Effect of sugar type on the survival of frozen-thawed rhesus monkey(Macaca mulatta)sperm[J].Am J Primatol,2006,68(1):103 -108.
[21]司维,李亚辉,关沫,等.四种渗透性防冻剂在猕猴精子低温冷冻保存中对精子功能状态的影响[J].动物学研究,2004,25(1):32 -36.
[22]MAZUR P,KLEINHANS F W.Relationship between intracellular ice formation in oocytes of the mouse and Xeno-pus and the physical state of the external medium-revisit[J].Cryobiology,2008,56:22 -27.
[23]ALAPATI R,GOFF K,KUBISCH HM,et al.Water transport in epididymal and ejaculated rhesus monkey(Macaca mulatta)sperm during freezing[J].Cryobiology,2008,57:182 -185.
[24]MAZUR P.Limits to life at low temperatures and at reduced water contents and water activities[J].Orig Life,1980,10:137 -159.
[25]LI YH,CAI KJ,SU L,et al.Cryopreservation of monkey(Macaca fascicularis)permatozoa in a chemically defined extender[J].Asian J Androl,2005,7(2):139-144.

