酿酒酵母DL28转化产γ-氨基丁酸主要影响因子的筛选
乌云达来,郭雪娜,张博润,王肇悦*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018;2.中国科学院微生物研究所,北京100101)
γ-氨基丁酸(γ-aminobutyric acid)简称 GABA,是谷氨酸脱羧酶(glutamic acid decarboxylase,GAD,EC 4.1.1.15)生物催化L-谷氨酸或钠盐α-羧基脱羧反应而产生的非蛋白质组成的天然氨基酸[1-2],为哺乳动物中枢神经系统的一种主要的抑制性神经递质[3],广泛存在于从单细胞生物到哺乳动物的各种有机体活细胞中[4],具有许多重要的生理功能,如降血压[5]、镇痛[6]、治疗哮喘[7]等。近年来,GABA 相关功能性食品的开发引人关注,其中植物富集法(米胚、米糠、绿茶等)和微生物发酵法(乳酸菌、酵母)制得的富含GABA食品都获得了良好的社会价值和经济效益。因此,GABA作为一种功能性因子越来越广泛地用于食品、医药及化工等行业[8-11]。
酵母菌是单细胞真核生物,在我国已有2 000多年的使用历史,如在酿酒业上的应用,也是我国重要的微生物资源[12-13]。据研究报道,已筛选出发酵产生较高GABA产量的酵母菌株,如 Candida parapsilosis GPT-5-11为 1.76 g/L[14]、产 GABA 酵母菌株的 GABA 产量达 1.69 g/L[15]、Saccharomyces uvarum 4#为 3.653 g/L[16]等。
Plackett-Burman试验设计是一种经济而有效的二水平试验设计方法,试验组合数量较少也满足试验要求,且因子的交互作用仅部分的与主因子发生混淆[17],应用于生物工艺优化研究中的报道很多,如粪肠球菌HX-3-6产γ-氨基丁酸发酵条件的优化[11]、嗜酸乳杆菌NX2-6产细菌素的发酵条件优化[18]等。笔者通过Plackett-Burman设计对酿酒酵母重组菌转化产生GABA具有影响的内在因素和外在因素进行研究,筛选出主要影响因素,为其发酵条件的优化提供试验数据具有重要实际意义。
1 材料与方法
1.1 材料
1.1.1 试验菌株。S.cerevisiae DL28是中国科学院微生物研究所工业微生物与生物技术研究室将产GABA的S.cerevisiae 28[19]通过聚合酶链反应和核酸体外扩增技术改良的谷氨酸脱羧酶基因(GAD 1)高效表达的重组菌株。
1.1.2 主要培养基及试剂。YEPD液体培养基根据文献[20-21]介绍的方法配制;GABA标样,Sigma公司;L-谷氨酸,国药集团化学试剂有限公司;其他试剂及药品均为分析纯。
1.1.3 主要设备。Eppendorf高速冷冻离心机,5415R型和5804R型;分光光度计,SHIMADZU UV-2450型。
1.2 试验方法
1.2.1 菌株DL28的培养及菌悬液的制备。将S.cerevisiae DL28菌株接种于5 ml YEPD液体培养基中,置29℃、摇床培养12~24 h。传代培养2次后接种于YEPD液体培养基中,置29 ℃、摇床培养12 h,3 000 r/min、4 ℃离心10 min,弃掉上清液,加入与培养液等量的灭菌生理盐水(约5 ml),振荡混匀,再次离心,同法洗涤2次。然后,弃掉上清液的菌体加入4.5 ml灭菌生理盐水,振荡混匀,即成为供试菌液。
1.2.2 标准曲线的建立。采用 Berthelot法[21-22]建立 GABA标准曲线,即取30 mmol/ml标准 GABA 溶液0.05、0.10、0.20、0.30、0.40 ml,依次加 30 mmol/ml L-Glu 溶液 0.35、0.30、0.20、0.10、0 ml,混合,加入0.2 ml碳酸钠溶液(1.0 mol/L)混合,加入1.0 ml四硼酸钠缓冲液(0.2 mol/L),混匀,加入 1.0 ml 6.0%苯酚溶液,再加入5.0 ml 7.5%次氯酸钠溶液后沸水浴10 min,然后冰浴5 min,加入60%的乙醇溶液2.0 ml,在波长640 nm下测定其吸光值,以L-Glu溶液做空白对照。以GABA浓度为横坐标,波长640 nm处的吸光值为纵坐标,绘制标准曲线。
1.2.3 转化液中GABA含量的测定[22-23]。转化液中 GABA含量的测定方法同上。将转化液0.5 ml与0.2 ml碳酸钠溶液混合,加入1.0 ml四硼酸钠缓冲液,混匀,加入1.0 ml 6%苯酚溶液,再加入5.0 ml 7.5%次氯酸钠溶液后沸水浴10 min,然后冰浴5 min,加入60%的乙醇溶液2.0 ml,在640 nm下测定其吸光值。
1.2.4 GABA转化条件关键影响因子的筛选——Plackett-Burman设计。通过Berthelot法以菌体浓度、底物浓度及起始pH等6个因素作为研究对象,从中筛选对菌株DL28转化产生GABA有显著影响的因子。选取的6个因素及其代码、编码水平见表1,其响应值为每组转化液中GABA含量(mmol/L)。利用JMP软件进行试验设计、数据分析及模型的建立。该试验采用二水平Plackett-Burman设计,试验设计见表1。
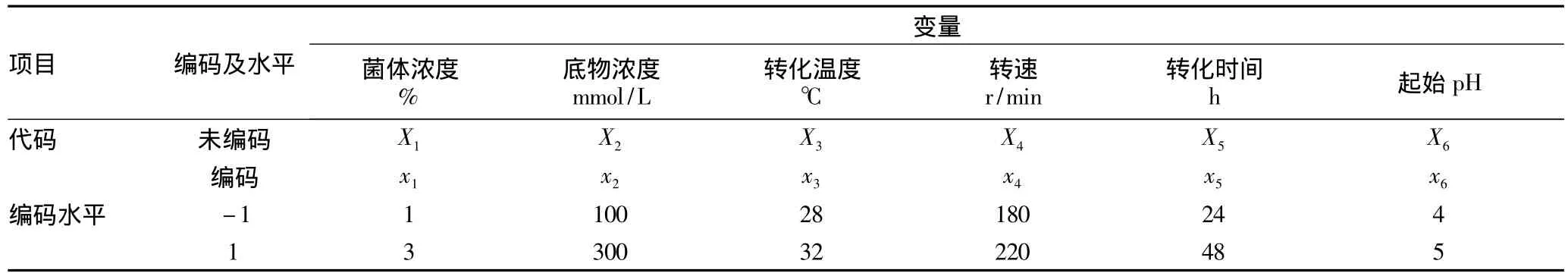
表1 影响因素及编码水平Plackett-Burman设计
2 结果与分析
2.1 GABA标准曲线的建立 通过Berthelot比色法,以GABA浓度为横坐标,波长640 nm处的吸光值(A640)为纵坐标绘制标准曲线,GABA的标准曲线见图1。
经数据分析得知,GABA的标准曲线回归方程式为Y=0.014 4X+0.412 1,相关系数 R2=0.999。因此,待测转化液中GABA浓度在4.0~30.0 mmol/L的范围内与吸光值的相关性很好。
2.2 转化液中GABA含量的测定 PB试验结果及其响应值见表2,各因素方差分析见表3。采用JMP软件对表3中的Y值(GABA含量)进行方差分析,该数据具有统计学意义(P<0.000 1)。通过逐步回归分析,得到转化液GABA含量为响应值的最优多元线性回归方程(α=0.05):
式中,Y为GABA含量预测值;由自变量编码方程可知,x1=(菌体浓度-2)/1,x5=(转化时间-36)/12,x6=(起始 pH-4.5)/0.5。
方差分析表明,所得最优多元线性回归方程达到极显著(P <0.000 1),而且各因子系数均有意义(P <0.05)。该回归模型在被研究的整个回归区域拟合的很好。决定系数R2=0.952 076 和 R2Adj=0.916 133,Y 值(GABA 含量)表明95.2%的试验数据的变异性可用此回归模型来解释。由偏回归系数及显著性检验得到影响菌株DL28转化GABA主要影响因子为:菌体浓度(P=0.012 3)、转化时间(P=0.047 5)和起始 pH(P=0.001 9)。
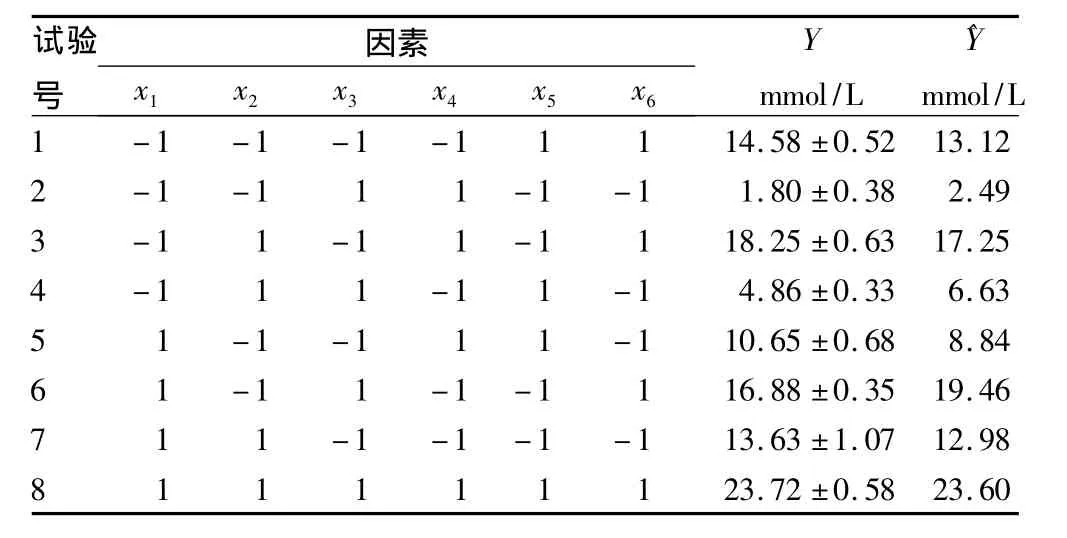
表2 Plackett-Burman试验设计及响应值
S.cerevisiae DL28转化产生GABA的含量受内条件(如菌体浓度、底物浓度等)和外条件(如转化温度、转化时间等)的制约。因此,为提高该菌株通过转化产生GABA的含量,首先从众多的相关影响因素中筛选出主要影响因子,并了解转化因素之间的相互作用是至关重要的。由显著因素的偏回归系数和重要影响因子动态预测图(图2)可知,在各项影响因素的2个水平范围内,菌体浓度、转化时间和起始pH均对菌株DL28转化GABA为正效应,即随菌体浓度的增加、起始pH的提高及转化时间的延长,GABA含量呈增加趋势。
谷氨酸脱羧酶(glutamic acid decarboxylase,GAD,EC 4.1.1.15)是一种磷酸吡哆醛(PLP)类酶,是生物体催化L-谷氨酸或钠盐脱羧反应生成非蛋白质组成的天然氨基酸GABA的唯一酶[24-25]。因此,GAD的含量和活性对GABA产量的影响最重要,该研究中菌体浓度、转化时间及起始pH对菌株DL28转化产GABA的产量具有显著影响也说明了这一点,如菌体浓度对应GAD的含量,而转化时间和起始pH是对应GAD活性。据研究报道,Candida parapsilosis GPT-5-11合成γ-氨基丁酸的最佳pH为6.5和37℃发酵时间为48 h[26];酵母菌突变菌株的最佳接种量为4%、起始pH为5.5及37 ℃培养时间为4 d[27];L.plantarum LpL328 的固定化细胞在菌体浓度为6%、pH为4.7及37℃培养20 h时GABA最高催化产量为 0.96 g/L[28];Lactococcus lactis 1.009 的细胞在菌体浓度为10 g/L、pH 4.7的醋酸缓冲液及50℃下反应60 h 时 GABA 的积累量可达 19.1 g/L,转化率为99.9%[29]等。增加菌体浓度和延长转化时间对GABA产量具有促进作用,但乳酸菌的GAD的最适起始pH相对低于酵母菌,原因由菌株特性所致。
用上述方程对转化液GABA含量最大预期值及合意性(图2)进行分析,可知欲得到较高的含GABA的转化液,需提高菌体浓度和起始pH,并延长转化时间。
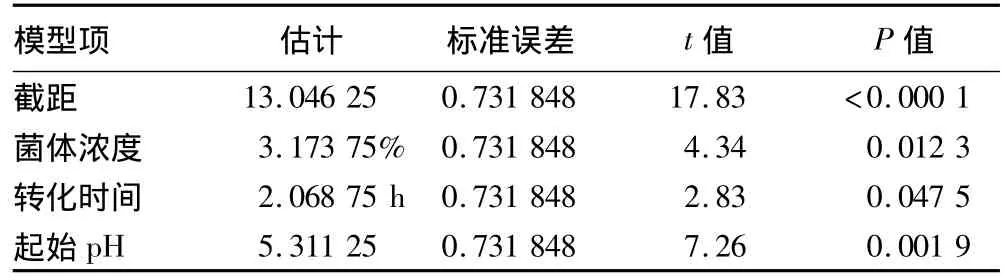
表3 偏回归系数及显著性检验
3 结论
利用PB试验设计对S.cerevisiae DL28转化产GABA的菌体浓度、底物浓度、转化温度等6个相关因素进行主要影响因子的筛选,发现在各项影响因素的2个水平范围内,菌体浓度、转化时间和起始pH均对菌株DL28转化GABA为正效应,即随着菌体浓度的增加、起始pH的提高及转化时间的延长,GABA含量呈增加趋势,其他相关因素没有显著效应。通过动态预期图直观地了解到各因素的效应趋势及大致水平范围,为进一步优化酵母菌转化产GABA的工艺参数提供了重要的理论依据与实践基础。
[1]KIM H W,KASHIMA Y,ISHIKAWA K,et al.Purification and characterization of the first archaeal glutamate decarboxylase from Pyrococcus horikoshii[J].Bioscience Biotechnology And Biochemistry,2009,73(1):224 -227.
[2]林谦,姜康怡,韦素娟,等.产GABA发酵乳杆菌的筛选、发酵条件优化及其谷氨酸脱羧酶基因的克隆[J].广东农业科学,2014(8):192-197.
[3]GOLDBERG J S.Selected gamma aminobutyric acid(GABA)esters may provide analgesia for some central pain conditions[J].Perspectives in Medicinal Chemistry,2010(4):23 -31.
[4]UENO Y,HAYAKAWA K,TAKAHASHI S,et al.Purification and characterization of glutamate decarboxylase from Lactobacillus brevis IFO 12005[J].Bioscience,Biotechnology,and Biochemistry,1997,61(7):1168 -1171.
[5]LEVENTHAL A G,WANG Y,PU M,et al.GABA and its agonists improved visual cortical function in senescent monkeys[J].Science,2003,300(5620):812-815.
[6]RILEY R,TRAFTON J,CHI S,et al.Presynaptic regulation of spinal cord tachykinin signaling via GABA(B)but not GABA(A)receptor activation[J].Neuroscience,2001,103(3):725 -737.
[7]LU W Y.The potential use of GABA ergic drugs in the treatment of asthma[J].Future Medicinal Chemistry,2011,3(2):145 -147.
[8]王辉,项丽丽,张锋华.γ-氨基丁酸(GABA)的功能性及在食品中的应用[J].食品工业,2013,34(6):186 -189.
[9]BRON P A,BENCHIMOL M G,LAMBERT J,et al.Use of the alr gene as a food-grade selection marker in lactic acid bacteria[J].Applied and Environmental Microbiology,2002,68(11):5663 -5670.
[10]TAKAHASHI T,FURUKAWA A,HARA S,et al.Isolation and characterization of sake yeast mutants deficient in gamma-aminobutyric acid utilization in sake brewing[J].J Biosci Bioeng,2004,97(6):412 -418.
[11]钱森和,黄祖耀,薛正莲,等.粪肠球菌HX-3-6产γ-氨基丁酸发酵条件的优化[J].中国生物制品学杂志,2013,26(2):268 -274.
[12]徐晓波.产生GABA酵母菌资源多样性和分子系统学研究[D].金华:浙江师范大学,2010.
[13]李杰.生物合成γ-氨基丁酸酵母菌谷氨酸脱羧酶基因的克隆及表达[D].金华:浙江师范大学,2009.
[14]李亚莉,秘鸣,魏珍珍,等.一株产GABA酵母菌的筛选及鉴定[J].食品科技,2013,38(6):17 -21.
[15]胡超,黄丽华,左斌,等.酵母产γ-氨基丁酸发酵培养基的优化[J].现代生物医学进展,2011,11(3):482 -484.
[16]徐晓波,蒋冬花,李杰.5株生物合成GABA酵母菌株的分离、筛选和鉴定[J].微生物学杂志,2009,29(1):55 -59.
[17]LOUKAS Y L.A Plackett-Burnam screening design directs the efficient formulation of multicomponent DRV liposomes[J].Journal of Pharmaceutical and Biomedical Analysis,2001,26(2):255 -263.
[18]乌云达来,陆兆新,吕凤霞,等.嗜酸乳杆菌NX2-6产细菌素的发酵条件优化[J].食品科学,2012,33(3):179 -183.
[19]乌云达来,王肇悦,郭雪娜,等.产γ-氨基丁酸酵母菌的筛选及菌种鉴定[J].内蒙古农业大学学报:自然科学版,2013,34(6):110 -114.
[20]王金晶.工业酵母菌的分子遗传修饰与应用研究[D].北京:中国科学院微生物研究所,2011.
[21]杨胜远.利用唾液链球菌嗜热亚种(Streptococcus salivarius subsp.thermophilus)Y-2生产γ-氨基丁酸的研究[D].南京:南京农业大学,2006.
[22]赵宏飞,宋伟,裴家伟,等.食品中三种γ-氨基丁酸检测方法比较[J].中国乳品工业,2008,36(11):51 -55.
[23]孙波,梁海文,迟玉杰,等.比色法快速测定酶转化反应中γ-氨基丁酸含量的研究[J].食品科技,2008(5):210 -213.
[24]杜昭,李世峰,李逸平.谷氨酸脱羧酶在神经系统及雄性生殖系统中的功能[J].生命的化学,2013,33(2):96 -100.
[25]SARDANA R K,AWAD R,AMASON J T,et al.Expression of recombinant goldfish glutamic acid decarboxylase 65 and evidence for differential pH and PLP responsiveness compared to the human enzyme[J].Comparative Biochemistry and Physiology B-Biochemistry& Molecular Biology,2006,144(1):94 -100.
[26]李亚莉,秘鸣,魏珍珍,等.1株酵母菌产GABA发酵条件的优化[J].中国农学通报,2013,29(33):389 -393.
[27]胡超.高产γ-氨基丁酸酵母菌株的诱变选育及发酵条件优化[D].长沙:湖南农业大学,2008.
[28]韩雪.微生物细胞催化合成γ-氨基丁酸(GABA)的研究[D].哈尔滨:哈尔滨商业大学,2013.
[29]傅元欣,张涛,江波,等.乳酸菌细胞转化法制备γ-氨基丁酸的研究[J].食品工业科技,2008,29(9):166 -169.

