典型内分泌干扰物在天然水环境中的污染水平
谭睿婕,李宗圣,刘瑞霞 ,代云容,宋永会(.首都经济贸易大学安全与环境工程学院,北京00070;2.中国环境科学研究院环境基准与风险评估国家重点实验室,北京0002;3.中国环境科学研究院城市水环境科技创新基地,北京0002)
内分泌干扰物(EDCs,endocrine disrupting compounds)是一种痕量污染物,具有来源广、危害大、毒理危害潜伏期长的特点。1997年美国国家环保局发表的一份有关环境内分泌干扰物的研究报告将环境内分泌干扰物[1]定义为能模拟或干扰体内天然雌激素的合成或干扰其生理作用的天然或人工合成化合物,会对动物和人类的生长和生殖功能造成危害。EDCs可分为外源性和内源性两大类。外源性干扰物主要由人工合成,如常用于生产口服避孕药的17α-乙炔基雌二醇(17α-ethinyl estradiol,EE2)、4-对特辛基苯酚(4-octylphenol,OP)、4-叔辛基苯酚(4-tert-phenol,4-T-OP)、烷基酚聚氧乙烯类及其降解产物壬基酚(Nonyl phenol,NP)和用于生产各种塑料的双酚A(Bisphenol A,BP A)。内源性干扰物则主要由生物体产生,以分泌物、排泄物的形式进入环境,主要包括雌酮(Estrone,E1)、17α-雌二醇(Estradiol,17α-E2)、雌三醇(Estriol,E3)、17β-雌二醇(17β-estradiol,E2)等类雌激素。
近年来,国内外对环境中内分泌干扰物的研究主要集中在浓度水平分布、优化检测方法、不同环境介质中EDCs的迁移转化及其对生物体的危害作用机制方面。随着工业化和城市化进程的加快,内分泌干扰物在环境中的检出率逐渐增大。水环境作为EDCs的主要迁移转化场所,其污染水平更是受到关注。Yang等对珠江三角洲沿海32个采样点的水样进行检测,发现E1的检出率为87.5%,OP、NP和BPA的检出率高达100%;由于鱼类的生物累积效应,在珠江三角洲的鲤鱼胆汁中,测得OP、NP、BPA和E1的平均值分别为27、2 478、347、19 ng/g。鱼类体中的EDCs通过食物链进入人体,部分通过呼吸系统、消化系统排出体外[2]。夏同伟等在40名成人志愿者的尿液中检测出酚类化合物,其中BPA的检出率为 98%,浓度范围为 0.01~14.90 μg/L,平均值为1.40 μg/L;TCS(三氯生)、E1、E2、EE2 检出率均为 100%,平均值分别为28.80、6.10、2.65、0.52 μg/L[3]。此外,在符合相关法律规定下,Cappiello等运用GC-qMS方法对因婴儿瘁死综合症或不明原因死亡的胎儿进行测定,在其新生组织(肝脏和大脑)中发现包括七氯(ND-7.4 ng/g)、α-氯丹(ND-34 ng/g)、异狄氏剂(ND-63.5 ng/g)、γ-氯丹(ND-25 ng/g)、p,p’-DDE(ND-3.5 ng/g)在内的5种内分泌干扰物,由此表明内分泌干扰物通过环境介质-生物累积效应-食物链,最终会蓄积在人体内对机体造成伤害与威胁[4]。内分泌干扰物不同于农药和其他有机污染物,它在环境中含量很低,但对生态环境的威胁和生物体的危害很大。世界卫生组织WHO在2002年就发现,对小鼠分别摄入E2和EE2剂量为824、800 μg/(kg·d)时,就会导致小鼠睾丸、附睾萎缩、精小管变性,精子活性和数量降低;EE2摄入量为0.02 μg/(kg·d)、BPA 为2 μg/(kg·d)时,则可导致前列腺肥大[5]。鉴于此,笔者以典型内分泌干扰物 BPA、NP、OP、E1、E2、E3、EE2 为研究对象,检索近年来全球范围内水环境中的污染水平,分析不同地区的浓度分布特点。
1 国内外EDCs污染分布特征
通过统计分析发现,测定EDCs浓度水平时,被选为研究对象的河流多具有一定的城市功能,进行采样的河流常流经城市,且具有接纳来自沿岸工业废水、生活污水和污水处理厂出水的功能。而对于具体采样点的选取,则与人类活动息息相关,如用于农业灌溉、牲畜养殖和居民用水水源地;此外,制造业集中、处于不同工业化水平的河流流经河道也是重要的采样点。
1.1 全球范围内典型EDCs的分布 通过检索发现,相关研究主要集中在亚洲的中国、新加坡、印度、韩国,美洲的巴西、美国和欧洲的希腊、葡萄牙、德国、西班牙;而在这些国家中,又以经济发达、高度工业化发展、人口密度较大的流域为主,其EDCs浓度的具体分布如表1所示。从全球范围来看,东亚中国、南亚印度和南美洲巴西的典型EDCs污染水平整体较高,在欧洲地区,BPA的最高检出浓度出现在欧洲西南部葡萄牙的Caster and Antu~a河,浓度为683 ng/L;在东南部希腊Thermaikos海湾和西班牙的Manzanares河测得OP的最高浓度均为118 ng/L;位于欧州西南部水中检出NP的最高浓度为1 483 ng/L。内源性内分泌干扰物E1、E2、EE2在欧洲地区均未检出或小于其检出限。南美巴西的EDCs污染水平远高于北美美国,其外源性EDCs浓度范围为34.5~1603.0 ng/L,美国为0.35 ~6.43 ng/L;内源性 EDCs巴西为5.6~126.4 ng/L,美国则未检出。在亚洲地区,新加坡和印度仅检出外源性EDCs,韩国汉河、中国多数流域均检出内源性和外源性EDCs。Tran等在新加坡当地集水区测得BPA,浓度 <324 ng/L[14];南亚印度 Kaveri流域污染较为严重,其中NP的最高浓度为2200 ng/L。在东亚国家中,中国的内源性EDCs污染明显比日韩严重。韩国汉河的BPA、E1、E2、EE2 浓度范围分别为 6.9 ~59.0 ng/L、0.2 ~4.2 ng/L、小于检出限浓度、小于检出限浓度,平均值分别为27.0 ng/L、1.6 ng/L、小于检出限浓度、小于检出限浓度;中国扬子江入海口的浓度范围分别为0.98~43.80 ng/L、低于检出限 ~1.43 ng/L、低于检出限、低于检出限 ~0.11 ng/L,平均值分别为10.60 ng/L、0.20 ng/L、低于检出限、0.06 ng/L;黄浦江的浓度范围分别为 <688.0 ng/L、低于检出限 ~93.5 ng/L、低于检出限 ~74.8 ng/L、低于检出限 ~55.4 ng/L,平均值分别为95.2、30.4、13.6、12.0 ng/L。
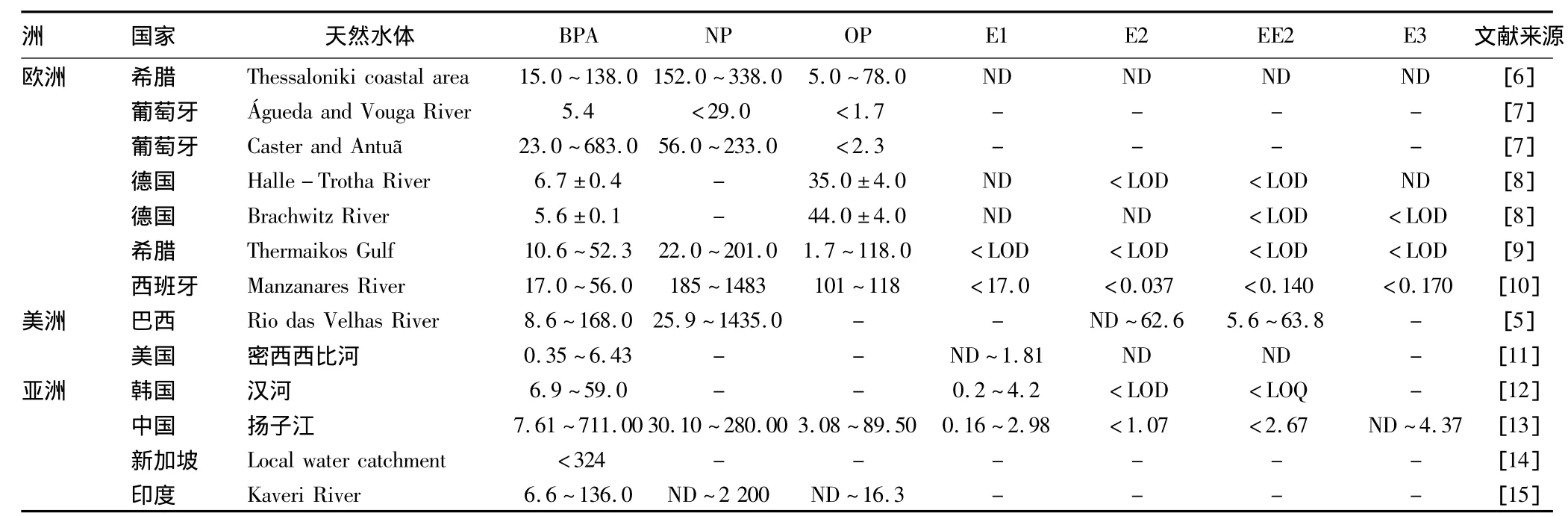
表1 典型EDCs在欧、美、亚洲水体中的浓度分布ng/L
外源性EDCs的污染程度比内源性高。其中,BPA、NP作为重要的有机化合物原料,污染程度普遍高于OP。近年来,BPA的较高浓度均在中国被检出,如2010年的扬子江(最高浓度为711 ng/L)、2011年的辽河流域(最高浓度为756 ng/L)、2012年的渭河流域关中段(最高浓度为55 612 ng/L)、2014年的张河流域(最高浓度为775 ng/L)。最高浓度往往出现在离工业园区或污水处理厂排污口较近、河流下游的采样点。对于内源性典型内分泌干扰物,在受生活污水影响较大的采样点,合成雌激素EE2的检出浓度均高于E1、E2、E3,可能是生活污水中含有口服避孕药、更年期激素药物所致。天然雌激素E2易被生物降解,作为其中间产物的E1在受纳水体中浓度往往高于E2[16]。通过比较城市中心、近郊、郊区三大类采样点发现,内源性干扰物的总浓度水平主要取决于人口数量与牲畜养殖情况。Zhang等对牛、猪、鸡的排泄物进行检测,发现每头牛每天尿液中含145~180 μg雌激素、每头猪通过尿液每天可排放42.6~219.0 μg雌激素、每只鸡每天的粪便中含有0.660~12.80 μg雌激素,人口数量越大、牲畜养殖越多,污染程度越大[17]。
1.2 中国主要流域污染水平 国内对典型内分泌干扰物的分布研究主要集中在地表水、饮用水水源、湖泊等天然水体以及污水处理厂进出水中,目前已有诸多学者分别对我国七大流域的干流、支流进行了污染水平研究,其中包括长江流域金沙江水系的滇池、干流扬子江、支流嘉陵江,黄河流域的黄河干流、支流渭河关中段、西安段及其引黄水段,珠江流域的珠江三角洲、海河流域的潮白河北京段、淮河流域的太湖、黑龙江流域的松花江以及辽河流域的大辽河,典型EDCs在各大流域水相中的具体污染水平如图1所示,其中珠三角、扬子江、太湖、黄河、潮白河、辽河、松花江分别位于珠江流域、长江流域、淮河流域、黄河流域、海河流域、辽河流域、黑龙江流域。
长江流域和黄河流域作为我国最大的两大流域,其内分泌干扰物污染水平有明显特征。Jiang等在2010~2014年分别对长江流域的扬子江、支流嘉陵江进行了检测,结果发现,2010年扬子江的外源性 EDCs浓度范围为65.0~711.0 ng/L,内源性EDCs为低于检出限~4.37 ng/L;2012年各污染物的最高浓度没有明显变化,但检出最低浓度有所下降,如2010年扬子江中NP、E1的最低浓度分别为100、0.900 ng/L,2012 年分别为 30.1、0.160 ng/L[13]。且对同一流域而言,水相中污染程度受人类活动影响较大,上游污染水平较下游低;扬子江入海口BPA浓度范围为0.98~43.80 ng/L,平均值为10.6 ng/L,明显低于下游段的污染水平[18]。同时,水期变化也是影响污染水平的重要因素。不同水期主要会带来河水径流量、温度的直接变化,进而影响污染物扩散、吸附、降解等一系列迁移转化行为。隶属黄河流域的渭河西安段,BPA、NP、E1、E2、EE2、E3 在枯水期的平均浓度分别为48 270、640、1 980、1 330、2 090、1 120 ng/L,平水期分别为270 570、8 930、540、230、300、390 ng/L,丰 水 期 分 别 为4 216 680、14 990、140、90、60、150 ng/L[19]。丰水期(5 ~ 9月)河道径流量变大,污染物的迁移速率会加快,而冬季枯水期(12月~次年2月)的河水温度较低,污染物的迁移速率和降解速率均会有所减缓。且相对春夏季节,受气候温度的影响,在秋冬季节人类活动会有所减少,从而使得两岸污染物的排放减少,整体污染水平有所下降,尤其是外源性EDCs的排放。但对香港鹤咀海岸保护区水域进行检测,测得NP在丰水期和枯水期的平均浓度分别为393、109 ng/L,丰水期水相中的NP浓度反而比枯水期高[20]。这主要是由于当地夏天雨季降雨量增加的同时,海水温度升高、底泥中相关微生物的活性大大提高,加快了沉积物中NPEO的生物降解速率,生成的NP进入水体,使得水相中NP的浓度反而比枯水期高。由此表明,水相中内分泌干扰物的浓度不仅受径流量的影响,也会受环境中本底浓度的影响。将干流EDCs的总体污染水平与支流进行比较,发现干流污染程度高于支流[16,21]。一方面可能是由于各支流的污染物在干流处汇集,存在累积效应,且沿河污染物的排放速率大于河流水体的自净作用;另一方面,不同种类的污染物在水体中的迁移转化行为各不相同,污染物之间存在一定的相互作用,可能形成拮抗或协同效应,使污染物水平和毒性发生变化。
2 典型EDCs在水环境中的多介质分布
内分泌干扰物在水环境中的迁移转化机制包括吸附/解吸、迁移和降解,主要在水相-悬浮颗粒物-沉积物介质中进行迁移、转化。多数内分泌干扰物属于疏水性化合物,在水中的溶解性较差,因此在水相中的含量相对较少。国内外研究表明,一般情况下悬浮颗粒物中EDCs含量最高、沉积物次之、水相最低,其含量高低主要受人类活动排放、河道径流量大小及总有机物含量高低影响。
根据相似相溶原理,EDCs更容易被有机质含量高的介质吸附。水环境中有机质含量较高的介质主要包括水生生物、悬浮颗粒物和沉积物。其中,水生生物主要通过消化系统、呼吸系统和直接接触的方式将内分泌干扰物富集于体内,然后通过食物链影响人类健康。悬浮颗粒物(Suspended Particulate Matter,SPM)主要包括无机胶体、有机胶体和有机颗粒,具有比表面积大、有机质含量高、流动性大的特点,因而悬浮颗粒物上的EDCs多高于水相中污染程度。对中国的珠江三角洲[22]、黄浦江上游水源地保护区[23]、张河小流域[24]和希腊海沟[9]中典型内分泌干扰物的平均浓度进行检测,发现外源性EDCs检出率仍然高于内源性污染物;在BPA、NP、OP 3种典型外源性内分泌干扰物中,NP的污染水平高于其他2种物质。在测得有内源性EDCs的流域,E3浓度最高、E1最低(图2)。
3 总结
随着生活水平的提高,人们对健康的关注程度日益增加。而工业化进程的加快,也使得内分泌干扰物这一新型痕量污染物的环境暴露越来越严重,外源性内分泌干扰物的污染水平明显高于内源性内分泌干扰物。在全球范围内,发展中国家的污染程度普遍高于发达国家。具体流域中EDCs的浓度分布则取决于当地温度、人类活动、径流变化等多因素。目前我国对该物质的相关研究越来越多,但仍缺乏系统的环境暴露数据。此外,虽然内分泌干扰物对于生物体的健康威胁及其作用机制已逐步明晰,但在生态风险评价方面尚有不足。为此,建立准确、系统、统一的监测程序,完善污染暴露数据、对已有污染水平的水环境进行合理的生态风险评价,将成为现在和未来研究的方向。
[1]鲁佳铭.双酚A和类固醇内分泌干扰物在污水土地处理中的迁移转化行为[D].上海:上海交通大学,2011.
[2]YANG J,LI H Y,RAN Y,et al.Distribution and bioconcentration of endocrine disrupting chemicals in surface water and fish bile of the Pearl River Delta,South China[J].Chemosphere,2014,107:439-446.
[3]夏同伟,刘良坡,张文静,等.高效液相色谱-串联质谱法测定人尿液中5种酚类内分泌干扰物[J].分析测试学报,2013,32(2):211-217.
[4]CAPPIELLO A,FAMIGLINI G,PALMA P,et al.Determination of selected endocrine disrupting compounds in human fetal and newborn tissues by GC-MS[J].Analytical and Bioanalytical Chemistry,2014,406(12):2779-2788.
[5]MOREIRA M,AQUINO S,COUTRIM M,et al.Determination of endocrinedisrupting compounds in waters from Rio das Velhas,Brazil,by liquid chromatography/high resolution mass spectrometry(ESI-LC-IT-TOF/MS)[J].Environmental Technology,2011,32(12):1409-1417.
[6]ARDITSOGLOU A,VOUTSA D.Partitioning of endocrine disrupting compounds in inland waters and wastewaters discharged into the coastal area of Thessaloniki,Northern Greece[J].Environmental Science and Pollution Research,2010,17(3):529-538.
[7]JONKERS N,SOUSA A,GALANTE O S,et al.Occurrence and sources of selected phenolic endocrine disruptors in Ria de Aveiro,Portugal[J].Environmental Science and Pollution Research,2010,17(4):834-843.
[8]PRIETO A,VALLEJO A,ZULOAGA O,et al.Selective determination of estrogenic compounds in water by microextraction by packed sorbents and a molecularly imprinted polymer coupled with large volume injection-inport-derivatization gas chromatography-mass spectrometry[J].Analytica Chimica Acta,2011,703(1):41-51.
[9]ARDITSOGLOU A,VOUTSA D.Occurrence and partitioning of endocrinedisrupting compounds in the marine environment of Thermaikos Gulf,Northern Aegean Sea,Greece[J].Marine Pollution Bulletin,2012,64(11):2443-2452.
[10]ESTEBAN S,GORGA M,PETROVIC M,et al.Analysis and occurrence of endocrine-disrupting compounds and estrogenic activity in the surface waters of Central Spain[J].Science of the Total Environment,2014,466:939-951.
[11]WANG G D,MA P,ZHANG Q.et al.Endocrine disrupting chemicals in New Orleans surface waters and Mississippi Sound sediments[J].Journal of Environmental Monitoring,2012,14(5):1353-1364.
[12]YOON Y,RYU J,JEILL O,et al.Occurrence of endocrine disrupting compounds,pharmaceuticals,and personal care products in the Han River(Seoul,South Korea)[J].Science of the Total Environment,2010,408(3):636-643.
[13]JIANG W W,YAN Y,MA M,et al.Assessment of source water contamination by estrogenic disrupting compounds in China[J].Journal of Environmental Sciences,2012,24(2):320-328.
[14]TRAN N H,HU J Y,ONG S L.Simultaneous determination of PPCPs,EDCs,and artificial sweeteners in environmental water samples using a single-step SPE coupled with HPLC-MS/MS and isotope dilution[J].Talanta,2013,113:82-92.
[15]SELVARAJ K K,SHANMUGAM G,SAMPATH S,et al.GC-MS determination of bisphenol A and alkylphenol ethoxylates in river water from India and their ecotoxicological risk assessment[J].Ecotoxicology and environmental safety,2014,99:13-20.
[16]胡碧波,阳春,张智,等.嘉陵江典型城市江段的类固醇雌激素分布特性[J].中国给水排水,2011,27(21):54-58.
[17]ZHANG H,SHI J H,LIU X W,et al.Occurrence and removal of free estrogens,conjugated estrogens,and bisphenol A in manure treatment facilities in East China[J].Water Research,2014,58:248-257.
[18]LU G H,SONG W T,WANG C,et al.Assessment of in vivo estrogenic response and the identification of environmental estrogens in the Yangtze River(Nanjing section)[J].Chemosphere,2010,80(9):982-990.
[19]路屏.渭河西安段干支流环境内分泌干扰物调查及分析[D].西安:长安大学,2012.
[20]XU E G,LIU S,YING G G,et al.The occurrence and ecological risks of endocrine disrupting chemicals in sewage effluents from three different sewage treatment plants,and in natural seawater from a marine reserve of Hong Kong[J].Marine Pollution Bulletin,2014,85(2):352-362.
[21]JIANG W,YAN Y,MA M,et al.Assessment of source water contamination by estrogenic disrupting compounds in China[J].Journal of Environmental Sciences,2012,24(2):320-328.
[22]GONG J,RAN Y,CHEN D,et al.Association of endocrine ‐ disrupting chemicals with total organic carbon in riverine water and suspended particulate matter from the Pearl River,China[J].Environmental Toxicology and Chemistry,2012,31(11):2456-2464.
[23]聂明华.黄浦江上游水源地水体中雌激素的分布特征及其分配机制[D].上海:华东师范大学,2012.
[24]DUN Y,TANG C,ZHANG Y.Characteristics,Behavior and potential risks of phenolic endocrine-disrupting chemicals in surface water and suspended particle matter of the xiaohe river,north china plain,china[J].Fresenius Environmental Bulletin,2014,23(2 A):620-629.

