恐惧记忆的形成对大鼠内侧前额叶皮层ECoG的影响
恐惧记忆的形成对大鼠内侧前额叶皮层ECoG的影响
黄思佳,随力,任杰,彭彬彬,宋小金
上海理工大学 医疗器械与食品学院(上海,200093)
上海市教委科研创新项目(12ZZ143)
通信作者:随力,教授,E-mail:lsui@usst.edu.cn
【摘要】目的记录并分析大鼠在穿梭实验恐惧记忆形成前后内侧前额叶皮层的皮层脑电(Electrocorticogram,ECoG)的变化特征,揭示恐惧记忆的形成对内侧前额叶皮层ECoG的影响。方法通过穿梭实验诱导出大鼠对厌恶刺激的恐惧记忆,在恐惧记忆形成前后分别记录大鼠处于清醒和浅麻醉状态下内侧前额叶皮层的ECoG,分析ECoG频率谱、功率谱的变化特征。结果不论大鼠是处于清醒状态还是浅麻醉状态,恐惧记忆形成前后ECoG的总功率没有显著性差异(P>0.05)。尽管恐惧记忆的形成对于浅麻醉状态下的ECoG的频率谱没有显著性改变(P>0.05),但恐惧记忆的形成对于清醒状态下的ECoG的频率谱具有显著性的影响(P<0.05):表现为θ波比例显著减少(P<0.05),β波比例显著增加(P<0.05)。实验结果提示穿梭实验恐惧记忆的形成使清醒状态下的大鼠的内侧前额叶皮层处于兴奋状态。
【关键词】恐惧记忆;ECoG;大鼠;穿梭实验;内侧前额叶皮层
doi:10.3969/j.issn.1674-1242.2015.02.006
基金项目:国家自然科学基金(11179015, 51173108);
作者简介:黄思佳,硕士研究生,E-mail:18914499152@163.com
【中图分类号】R319
【文献标志码】A
文章编号:1674-1242(2015)02-0086-05
Abstract【】ObjectiveThe aim of this study is to investigate the effects of fear memory formation on electrocorticogram (ECoG) in rat prefrontal cortex.MethodsShuttle box test was used to induce fear memory in rats. Electrophysiological ECoG recordings of rat prefrontal cortex were monitored before and after fear memory forming in the awaked and the anesthetized condition, respectively. The total power spectra and the frequency spectra of these ECoG were analyzed and compared.ResultsFear memory formation did not significantly alter the total power of ECoG in the prefrontal cortex, whether in the awaked or in the anesthetized rats (P>0.05). Furthermore, in the awaked rats, significant differences in the frequency distribution of ECoG were found following fear memory formation relative to before memory formation, with the evidence that the ratios of θ wave is decreased and the ratios of β wave is increased(P<0.05). Whereas, in the anesthetized rats, fear memory formation failed to affect the frequency spectra of ECoG in the prefrontal cortex (P>0.05). These findings indicated that fear memory formation excited the prefrontal cortex in the awaked rats.
收稿日期:(2015-03-15)
Effects of Fear Memory Formation on ECoG in Rat Prefrontal Cortex
HUANG Sijia, SUI Li, REN Jie, PENG Binbin, SONG Xiaojin
School of Medical Instrumentation and Food Engineering,
University of Shanghai for Science and Technology (Shanghai, 200093)
【Key words】fear memory,electrocorticogram,rat,shuttle box test,prefrontal cortex
0 引言
将电极植入到大脑皮层的特定区域而记录到的脑电图,即为皮层脑电图(Electrocorticogram, ECoG)。ECoG能直接反映大脑局部的电活动,信噪比高。使用ECoG电极,对大脑的影响比较小,不会损伤脑组织。目前ECoG的研究主要在癫痫患者或者动物身上进行研究。
学习与记忆是生物体生存的必要能力。对此研究不仅需要行为方面的研究,也依赖于在记忆过程中分子事件的细致分析[1]。条件性恐惧记忆是一种较重要的记忆类型,适当的恐惧可以帮助人们趋利避害,保护自己[2]。而紊乱的恐惧记忆、焦虑症和创伤后应激障碍 (Post-Traumatic Stress Disorder,PTSD)等神经性疾病与恐惧记忆有着密切的关系。因此,研究大脑认知恐惧的神经机制具有重要的理论意义和临床意义[3]。
恐惧记忆的形成和内侧前额叶皮层、海马及杏仁核脑区的激活有关。以往研究[4]表明,记忆保持与内侧前额叶皮层的活性密切相关。但尚无恐惧记忆的形成对ECoG的影响的研究报道。所以,在本次实验研究中,将大鼠内侧前额叶皮层的ECoG进行分析比较。
1 实验对象与方法
1.1实验对象
实验采用健康成年雄性SD大鼠,购自上海斯莱克动物实验中心。体重200±10 g,常规分笼饲养,自由饮水进食,自然光照,动物房内温度 。
1.2实验仪器与试剂
脑电记录仪(上海诺诚电气有限公司);明暗穿梭箱(成都泰盟科技有限公司);脑立体定位仪;牙托粉义齿基托树脂液剂;牙托粉;颅骨钻;碘酒;30%的双氧水;戊巴比妥钠。
1.3皮层电极的植入手术
大鼠以戊巴比妥钠(20 mg/kg)腹腔麻醉,自然俯卧并固定于脑立体定位仪上,碘酒消毒皮肤,并沿着大鼠头顶正中切开头皮并进行钝性分离,用30%的双氧水去除多余的软组织,露出前、后囟及冠、矢状缝等骨性标志[5]。采用颅骨钻在内侧前额叶皮层(前囟前方2.7 mm~3.0 mm,旁开0.7 mm~1.0 mm)钻孔,再将皮层记录电极(直径为1 mm的小螺丝)植入到指定位置。参考电极植入到小脑处。电极用牙科水泥固定。最后进行消毒防止术后脑感染。术后恢复7 d,选取正常饮食、无萎靡不振的大鼠进行ECoG测量。
1.4大鼠穿梭恐惧记忆形成训练方案
将术后恢复正常的大鼠放入明暗穿梭箱的明箱中,由于大鼠喜黑特性而很快进入明暗穿梭箱的暗箱内。只要大鼠四肢全部进入暗箱中,即给予1.5 mA的足部电刺激,大鼠因足部电击的疼痛而进入明箱。仅需刺激多次,大鼠在明箱中的时间超过30 min,认为它产生了恐惧记忆。明暗穿梭实验结束,大鼠移入饲养笼内。
1.5大鼠穿梭恐惧记忆形成前后ECoG记录与分析
在恐惧记忆形成训练24 h后,再次对大鼠测试,确保大鼠形成恐惧记忆。大鼠形成恐惧记忆前后,均要测两组ECoG 数据,一组是大鼠处于浅麻醉状态,另一组是大鼠处于清醒的状态。在测脑电前,将诺诚脑电的仪器与电极相连接。运行诺诚脑电的采集软件。采样频率为128 Hz,共持续30 min。选取6只大鼠的内侧前额叶皮层电极点,并将每种状态比较稳定的100 s进行分析处理。
采集到的信号首先进行格式转化,导入MATLAB软件,运用小波工具箱的小波变换(Wavelet Transform)以进行滤波,频率谱分析范围为0~30 Hz。然后用MATLAB进行频域分析,对比大鼠在不同状态下频谱曲线差异。计算大鼠在不同状态下ECoG 的总功率和功率谱中δ、θ、α和β频段的功率百分比。ECoG各频段的频率范围是δ:1~4 Hz,θ:4~8 Hz,α:8~13 Hz,β:13~30 Hz[6]。正常情况下,在清醒、安静、闭目时,波幅呈现由小变大,再由大变小,如此反复进行,形成所谓α节律的“梭形”。当睁眼、警觉、思考问题或接受其他刺激时,α波立即消失而代之以快波,这种现象称之为“α波阻断”。一般认为,α波是大脑皮质处于清醒安静状态时电活动的主要表现。β波的出现意味着大脑比较兴奋。θ波是在困倦时,神经系统处于抑制状态时所记录的波形。δ波在睡眠、深度麻醉、缺氧或大脑有器质性病变时出现[7]。
1.6数据统计
2 结果
2.1大鼠4种不同状态下的ECoG
本实验选取了大鼠在穿梭实验恐惧记忆形成前的浅麻醉和清醒的ECoG和恐惧记忆形成后的浅麻醉和清醒的ECoG。4种不同状态下的ECoG分别为:训练前,即恐惧记忆形成前,大鼠的清醒状态下的ECoG(图1A);训练后,即恐惧记忆形成后,大鼠的清醒状态下的ECoG(图1B);训练前,即恐惧记忆形成前,大鼠的浅麻醉状态下的ECoG(图1C);训练后,即恐惧记忆形成后,大鼠的浅麻醉状态下的ECoG(图1D)。

图1大鼠在不同状态下的ECoG
Fig.1 ECoG of rats at different state
2.2大鼠不同状态下频率谱的变化
大鼠足部穿梭实验恐惧记忆形成前后处于清醒状态时,ECoG频率谱会发生明显的变化。恐惧记忆形成前,清醒状态下放电频谱能量较高部分主要集中在低频部分(1~12 Hz频段),占总功率的65.69%(图2A);而形成恐惧记忆后,清醒状态下高能量放电频率分配发生显著变化,集中分布在(4~16 Hz频段),占总功率的67.81%(图2B)。大鼠足部电刺激前后在浅麻醉状态下的频谱图非常相似(图2C、图2D)。放电频谱能量较高部分主要集中在低频和中频段,可以看到两组浅麻醉状态频谱图都有两个峰值。由于在做实验给大鼠的麻醉不是非常深,所以出现了大幅值的[8]。在大鼠形成穿梭实验恐惧记忆后清醒状态下出现了α波阻断(图3)。

图2大鼠在不同状态下ECoG频谱比较示意图
Fig.2Comparison of ECoG frequency spectrum at different State

图3恐惧记忆形成前后的α波
Fig.3α wave before and after the formation of fear memory
2.3不同状态下的功率谱特征的变化
2.3.1大鼠在各种情况下的ECoG总功率的变化

表1 大鼠在形成恐惧记忆前后清醒
从表1可以发现,恐惧记忆形成前后清醒状态下的ECoG的总功率经过等方差T检验,发现并无显著差异(P>0.05)。恐惧记忆形成前的清醒与浅麻醉状态的ECoG总功率也无显著差异(P>0.05)。同样地,形成恐惧记忆后浅麻醉状态下的ECoG总功率与形成恐惧记忆前浅麻醉状态下的ECoG的总功率也无显著差异(P>0.05)。表1的结果表明恐惧记忆形成前后各种状态的总功率均无显著性差异。
2.3.2穿梭实验恐惧记忆形成前后各状态ECoG功率谱的变化
6只大鼠恐惧记忆形成前、清醒状态下的功率谱能量百分比见表2;6只大鼠恐惧记忆形成后、清醒状态下的功率谱能量百分比见表3;6只大鼠恐惧记忆形成前、浅麻醉状态下的功率谱能量百分比见表4;6只大鼠恐惧记忆形成后、浅麻醉状态下的功率谱能量百分比见表5。图4则是直接客观的反映了表2、3、4、5的情况。恐惧记忆形成后清醒状态(Fig.4B)与恐惧记忆形成前清醒状态(Fig.4A)相比:大鼠在恐惧记忆形成后清醒状态下功率谱θ频率能量所占能量总功率比例显著降低(tStat=2.69,P<0.05),而β频率能量所占能量总功率比例显著增加(tStat=-2.31,P<0.05);穿梭恐惧记忆形成前浅麻醉状态(Fig.4C)相对于清醒状态(Fig.4A),θ频率能量占能量总功率显著降低(tStat=3.70,P<0.05),功率谱α频率能量所占能量总功率降低,但不显著(tStat=2.10,P=0.06>0.05),功率谱β频率能量所占能量总功率比例显著增加(tStat=-3.78,P<0.05);从图4中可以看出形成恐惧记忆前后浅麻醉状态(Fig.4C,Fig.4D)各波段频率能量均无太大变化。

表2 形成恐惧记忆前清醒状态功率谱变化
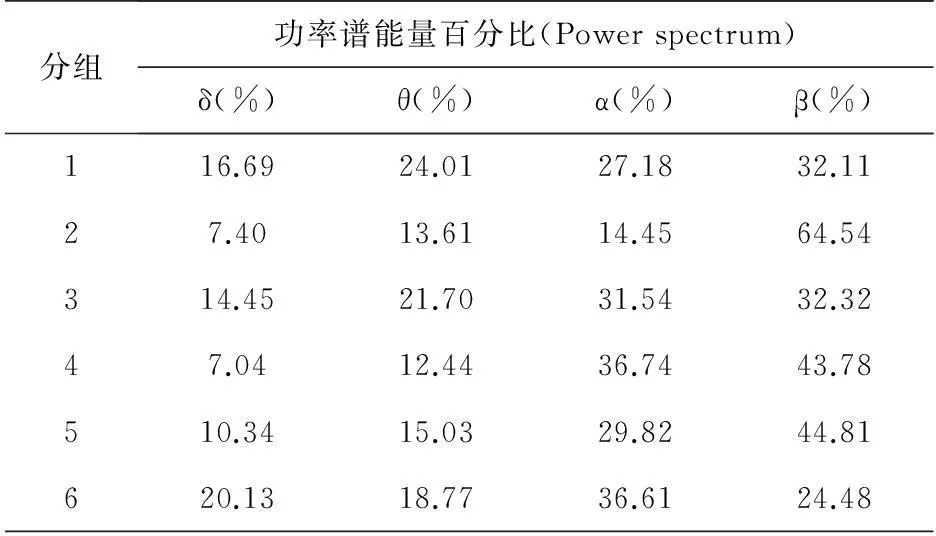
表3 形成恐惧记忆后清醒状态功率谱变化

表4 形成恐惧记忆前浅麻醉状态功率谱变化
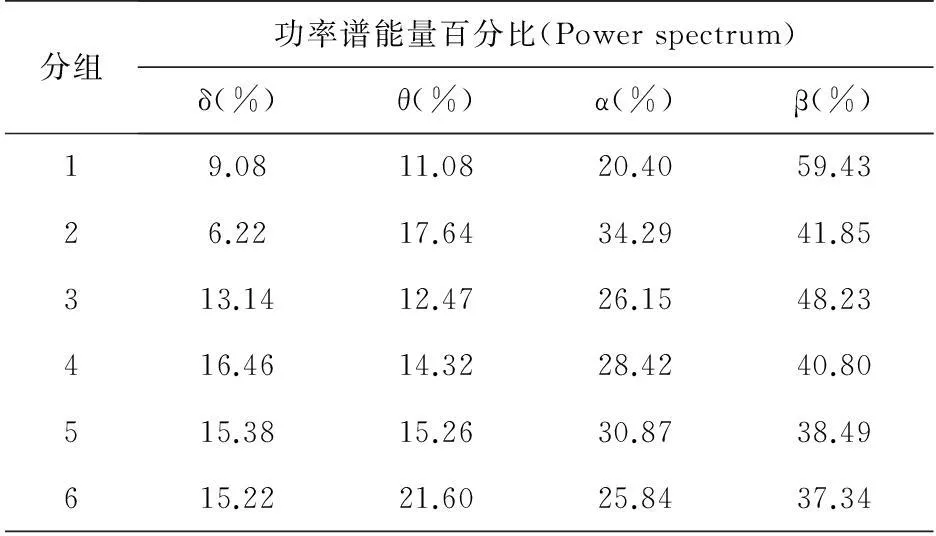
表5 形成恐惧记忆后浅麻醉状态功率谱能量百分比
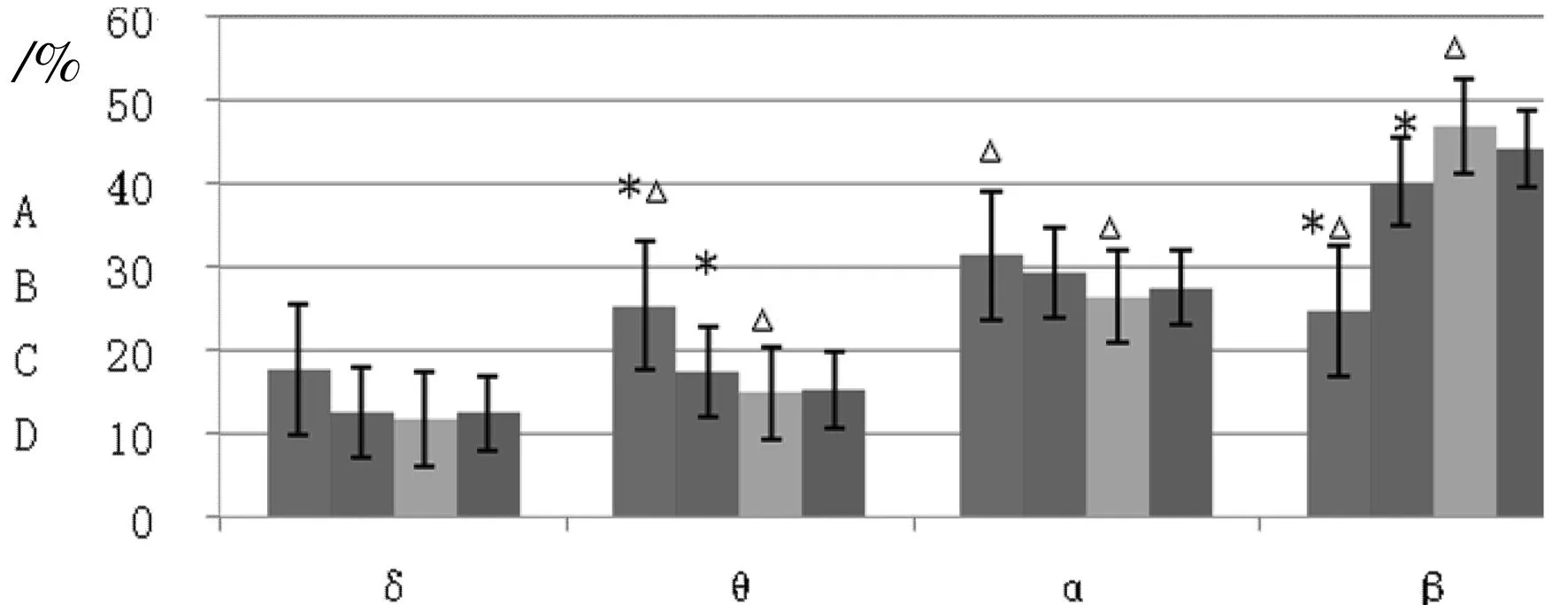
图4各状态功率谱百分比变化柱状图
Fig.4Different percentage of ECoG
frequency spectrum at different state
注:形成恐惧记忆前清醒与形成恐惧记忆后清醒相比:*P<0.05;形成恐惧记忆前清醒与形成恐惧记忆前浅麻醉相比:△P<0.05。A:恐惧记忆形成前、清醒状态;B:恐惧记忆形成后、清醒状态;C:恐惧记忆形成前、浅麻醉状态;D:恐惧记忆形成后、浅麻醉状态。
3 讨论
脑电图(EEG)是脑生理特征的客观反应,是检验和预测脑电生理变化的重要依据,目前在记忆方面也有了一定的进展[9]。但是,由于脑电图特殊的导联方式,信号记录需要在受试者头部相对静止的状态下进行。但是在本实验中大鼠受到足部电刺激后,会因为恐惧出现逃窜这种现象,所以身体的震动又不可避免的会对记录信号产生干扰。因此采用皮层脑电(ECoG)的方法,将记录电极与颅骨的位置相对固定,最大限度地减少大鼠本身的行为所造成的电极与记录单元的相对运动而产生的信号干扰,一定程度上克服了EEG记录方法的局限,以便更好地揭示恐惧记忆对ECoG的影响。
ECoG分析的主要观察指标为功率谱和频率谱,功率谱可以反映大脑在不同状态下脑电信号能量的大小及其各个频谱段上的分布情况。功率谱分析是经典的脑电分析方法之一[10]。本文实验结果:穿梭实验恐惧记忆形成前后的清醒、麻醉状态下大鼠ECoG信号总功率无明显变化,说明恐惧记忆形成前后大脑的电活动没有显著变化。大鼠进行足部穿梭实验前,相对于清醒的浅麻醉状态β节律显著上升,θ波节律显著降低,α节律降低。
一般认为,ECoG的功率谱频率分配中,α和β波所占比率的显著增加,而δ和θ频段所占比率减少,反映中枢神经系统兴奋性增强,反之则说明中枢神经系统兴奋性降低,而抑制性增强[11]。但本次实验中大鼠在浅麻醉后发现为α节律降低,θ节律显著降低,显著上升。有研究报道,由于戊巴比妥钠是无镇痛的,大脑皮层仍是信息处理的最高级中枢,是痛觉形成的最终部位。而β频段功率百分比对伤害性刺激引起的疼痛的反映具有特异性[12]。还有研究报道指出,麻醉开始后,脑电由正常的高频低幅快节律转变为低频高幅慢节奏[13]。这也可能造成大鼠浅麻醉后ECoG的β所占比例增大。大鼠的浅麻醉状态下β频段功率百分比如此之高的另一个原因可能是麻醉量比较小,导致大鼠处于半清醒状态下,使大脑没有完全麻醉。
穿梭实验恐惧记忆形成后清醒状态下,相对于穿梭实验恐惧记忆形成前清醒状态下,θ节律显著降低,β节律显著上升,反映了中枢神经系统兴奋性增强。哈特博士的研究小组发现了表示大脑对视觉威胁影响反应的θ和β波活动[14]。这与本实验结果还是比较一致的。
4 结论
大鼠经过穿梭实验训练后,形成了恐惧记忆。在浅麻醉状态下,恐惧记忆形成对ECoG没有显著性变化;在清醒状态下,虽然恐惧记忆对内侧前额叶皮层ECoG 的总功率没有显著性改变。但是功率谱θ频率能量所占能量总功率比例显著降低,而β频率能量所占能量总功率比例显著增加。实验结果提示穿梭实验恐惧记忆形成后,内侧前额叶皮层处于兴奋状态。
参考文献
[1] 张方风,郑志刚. 复杂脑网络研究:现状与挑战[J].上海理工大学学报,2012,34(2):138-153.
[2] 付娟.田绍文.胡弼,等. 前额叶与杏仁核在条件化恐惧消退中的作用[J].南华大学学报·医学版,2006,34(5):658-666.
[3] Wellman LL,Mairen EF,Mayumi M,et al .The basolateral amygdala determines the effects of fear memory on sleep in an animal model of PTSD[J]. Experiment Brain Res, 2014,232(5):2255-2265.
[4] David NF, Tanya SH, Ashleigh RT, et al. An IDEA for short term outbreak projection: nearcasting using the basic reproduction number[J].PLOS ONE, 2013,8(12):1-8
[5] 杨东升,刘晓莉,乔德才. 大鼠运动性疲劳形成和恢复过程ECoG的动态研究[J].体育科学,2012.32(4):53-59.
[6] 李颖洁. 脑电信号分析方法及其应用[M]北京:科学出版社,2009.
[7] 谭郁玲.临床脑电图学与脑电地形图学[M].北京:人民卫生出版社,1999.
[8] Karasawa H, Sakaida KI ,Noguchi S,et al. Ntracranial electroencephalographic changes in deep anesthesia[J]. Clin Neurophysiol, 112 (2001):25-30.
[9] Klimesch W. EEG alpha and theta oscillations reflect mental and memory performance: a review and analysis[J].Brain Resrew,1999,29(2-3):169-195.
[10] Muthuswamy J, Thakor NV. Spectral analysis methods for neurological signals[J].Neurosci Methods,1998,83(1):1-14.
[11] 刘曾荣,文铁桥, 姚晓东.脑与非线性动力学[M].北京:科学出版社,2006.
[13] 王玉珠,马福德,王洪斌.脑电图在动物麻醉中的应用[J].黑龙江畜牧兽医,2006,6:75-76.
[14] DelaRosa BL,Spence JS,Shakal SK, et al. Electrophysiological spatiotemporal dynamics during implicit visual threat processing[J].Brain Cogn, 2014,91:54-61.