饲粮核黄素添加水平对生长獭兔生长性能、毛皮质量、血液指标及抗氧化功能的影响
郑 琛 李春燕 隋啸一 赵 楠 刘公言 李福昌
(山东农业大学动物科技学院,泰安 271018)
核黄素不仅参与机体内碳水化合物、脂肪、蛋白质和核酸的代谢,而且间接参与免疫细胞分化、增殖和DNA、RNA及抗体合成等。因此,核黄素是机体必需营养素之一。核黄素在某种程度上可提高抗感染能力和生长性能[1]。核黄素缺乏时脂质过氧化反应增强,核黄素可以抑制该过氧化物反应过程[2-3]。核黄素在人的心血管疾病防治中发挥重要作用。有研究显示,核黄素有降血脂、抗血小板聚集、抑制脂质过氧化等作用[4-5]。目前,我国还未正式出台獭兔完整的饲养标准,獭兔核黄素需要量的研究匮乏,国外关于家兔在核黄素的研究主要集中在视觉角膜交联的治疗方面[6]。本试验以生长獭兔为研究对象,探讨饲粮添加不同水平核黄素对其生长性能、毛皮质量、血液指标和抗氧化功能的影响,寻求獭兔饲粮中核黄素适宜添加水平,为我国制定獭兔饲养标准提供科学依据。
1 材料与方法
1.1 试验饲粮
基础饲粮参照NRC(1977)家兔饲养标准配制而成,基础饲粮组成及营养水平见表1。在基础饲粮中分别添加0(对照组)、3、6和12 mg/kg核黄素,制成4种试验饲粮,加工成直径4~6 mm的颗粒饲粮,通风干燥保存。4个组饲粮核黄素实测含量分别为 2.62、4.43、8.35 和 14.94 mg/kg。
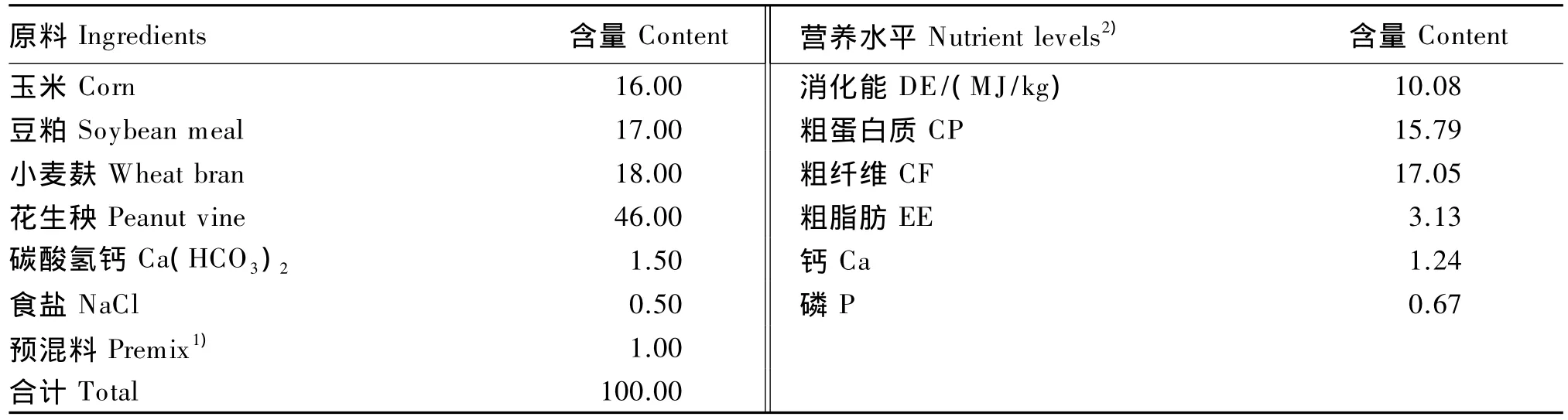
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验设计与饲养管理
试验选用健康、体重(1 882±144)g的3月龄獭兔160只,公母各占1/2,随机分成4组,每组40个重复,每个重复1只獭兔。分别饲喂以上4种试验饲粮,预试期7 d,正试期53 d。统计试验期间的采食量和体增重。试验兔单笼饲养,期间早晚各喂1次,自由饮水,采用常规饲养管理和免疫程序,自然采光、通风。
1.3 样品的采集与制备
试验结束后空腹12 h称重,每组随机抽取8只试验兔,心脏采血,37℃水浴 40 min后,3 000 r/min离心 15 min,分离所得血清分装于Eppendorf管中,置于-20℃冷冻保存;采血完成后将试验兔颈动脉放血屠宰,采集肝脏样品放于液氮罐速冻和保存,待测脂质抗氧化指标;屠宰后的试验兔剥皮,分析毛皮质量。
1.4 测定指标与方法
1.4.1 生长性能指标
试验结束后,以重复为单位称量试验兔的体重,并统计全期的喂料量,计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.4.2 血液指标
血清总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、胆固醇(CHO)、尿素氮(UN)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量均采用日本和光纯药工业株式会社提供的试剂盒,按说明书在日立7020型全自动分析仪上进行测定。
1.4.3 血清和肝脏抗氧化指标
血清和肝脏谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)活性及总抗氧化能力(T-AOC)和丙二醛(MDA)含量均在UV-2450型紫外可见分光光度计上测定,试剂盒购自南京建成生物工程研究所。
1.4.4 毛皮质量
将剥下的獭兔皮称重,测定其皮毛质量;皮毛平铺于托盘内,直尺垂直于皮毛测量被毛长度;然后测量其长度和宽度(皮长度是从颈中部量起至尾根;宽度指前肢后缘的胸围宽度;长、宽相乘即为皮的面积)[7],计算其面积;毛皮折叠,用游标卡尺测厚度,皮毛厚度为所测值的1/2。
1.5 数据处理与分析
数据以平均值和均方根误差(R-MSE)表示,采用SAS 9.1统计软件中的GLM进行数据的方差分析,若有显著差异,则采用Duncan氏法进行数据的多重比较。
2 结果
2.1 饲粮核黄素添加水平对生长獭兔生长性能的影响
由表2所示,试验兔的初始体重无显著差异(P>0.05),饲粮核黄素添加水平对平均日增重、平均日采食量和料重比均无显著影响(P>0.05)。
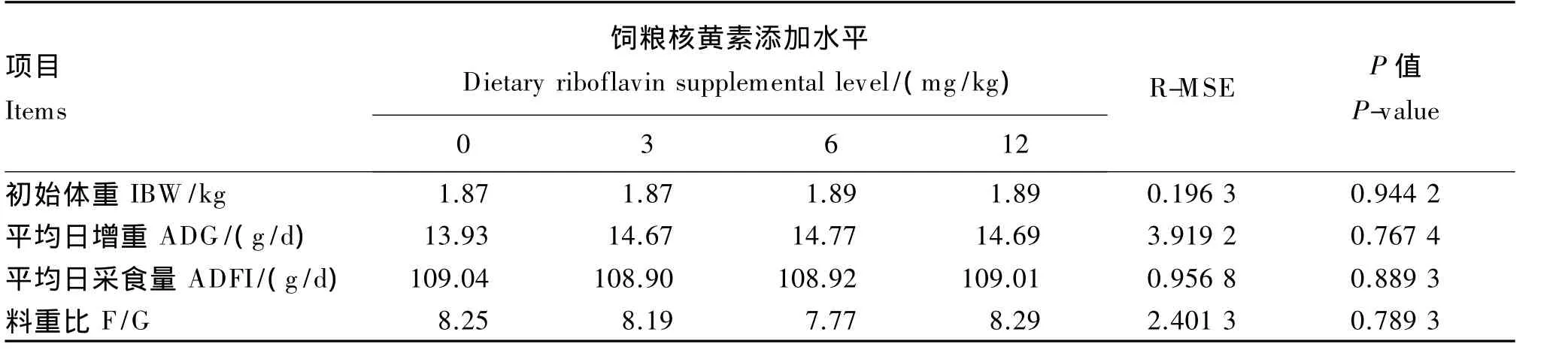
表2 饲粮核黄素添加水平对生长獭兔生长性能的影响Table 2 Effects of dietary riboflavin supplemental level on growth performance of growing Rex rabbits(n=8)
2.2 饲粮核黄素添加水平对生长獭兔毛皮质量的影响
由表3所示,饲粮核黄素添加水平对生长獭兔毛皮面积有显著影响(P<0.05),对毛皮重量有极显著影响(P<0.01),毛皮重量和毛皮面积都随核黄素添加水平增加而增加,饲粮核黄素添加水平对毛皮厚度、被毛长度均无显著影响(P>0.05)。
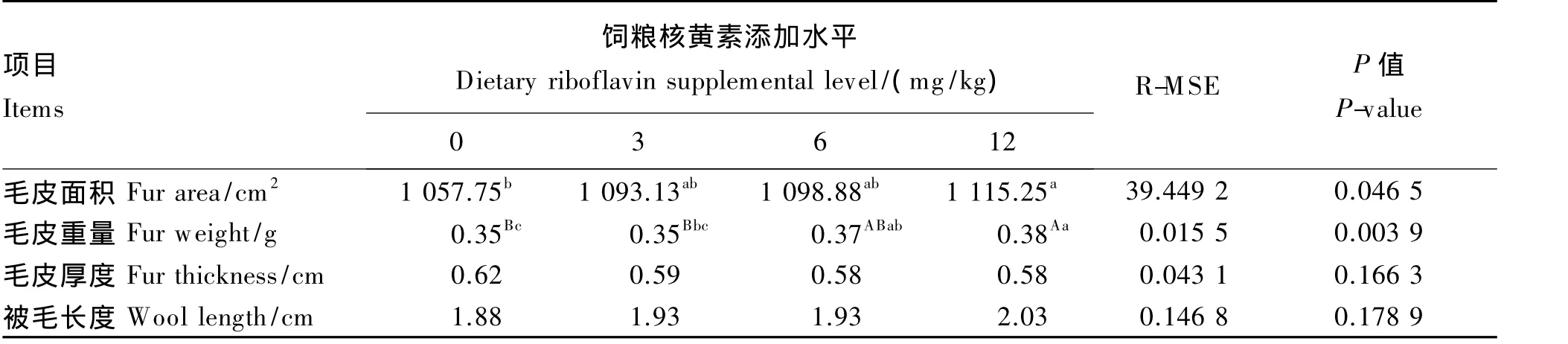
表3 饲粮核黄素添加水平对生长獭兔毛皮质量的影响Table 3 Effects of dietary riboflavin supplemental level on fur quality of growing Rex rabbits(n=8)
2.3 饲粮核黄素添加水平对生长獭兔血液指标的影响
由表4所示,6 mg/kg添加组血清CHO含量显著高于其他3组(P<0.05),饲粮核黄素添加水平对血清 TP、ALB、TG、UN、HDL-C 和 LDL-C 含量均无显著影响(P>0.05)。
2.4 饲粮核黄素添加水平对生长獭兔血清和肝脏抗氧化指标的影响
由表5所示,饲粮核黄素添加水平对血清GSH-Px活性有显著影响(P<0.05),随饲粮核黄素添加水平增加,GSH-Px活性呈先升高后降低趋势,6 mg/kg添加组显著高于对照组(P<0.05)。饲粮核黄素添加水平对血清T-SOD活性无显著影响(P>0.05),6 mg/kg添加组高于其他组。饲粮核黄素添加水平对血清MDA含量无显著影响(P>0.05),但随饲粮核黄素添加水平增加,血清MDA含量呈先降低后升高趋势。
饲粮核黄素添加水平对肝脏GSH-Px活性有极影响显著(P<0.01),6 mg/kg添加组极显著高于对照组(P<0.01)。饲粮核黄素添加水平对肝脏T-SOD 活性无显著影响(P>0.05),6 mg/kg添加组高于其他组。饲粮核黄素添加水平对肝脏T-AOC和 MDA 含量无显著影响(P>0.05),但随饲粮核黄素添加水平增加,肝脏T-AOC先升高后降低,肝脏MDA含量先降低后升高,6 mg/kg添加组肝脏T-AOC最大,MDA含量最小。
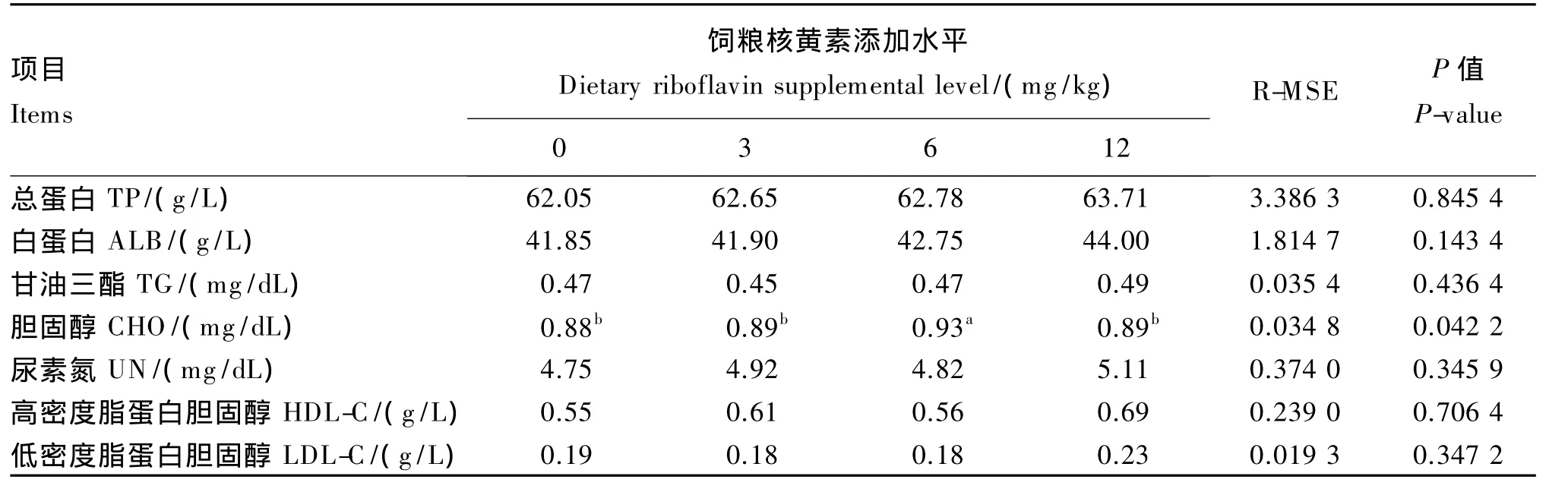
表4 饲粮核黄素添加水平对生长獭兔血液指标的影响Table 4 Effects of dietary riboflavin supplemental level on blood indices of growing Rex rabbits(n=8)
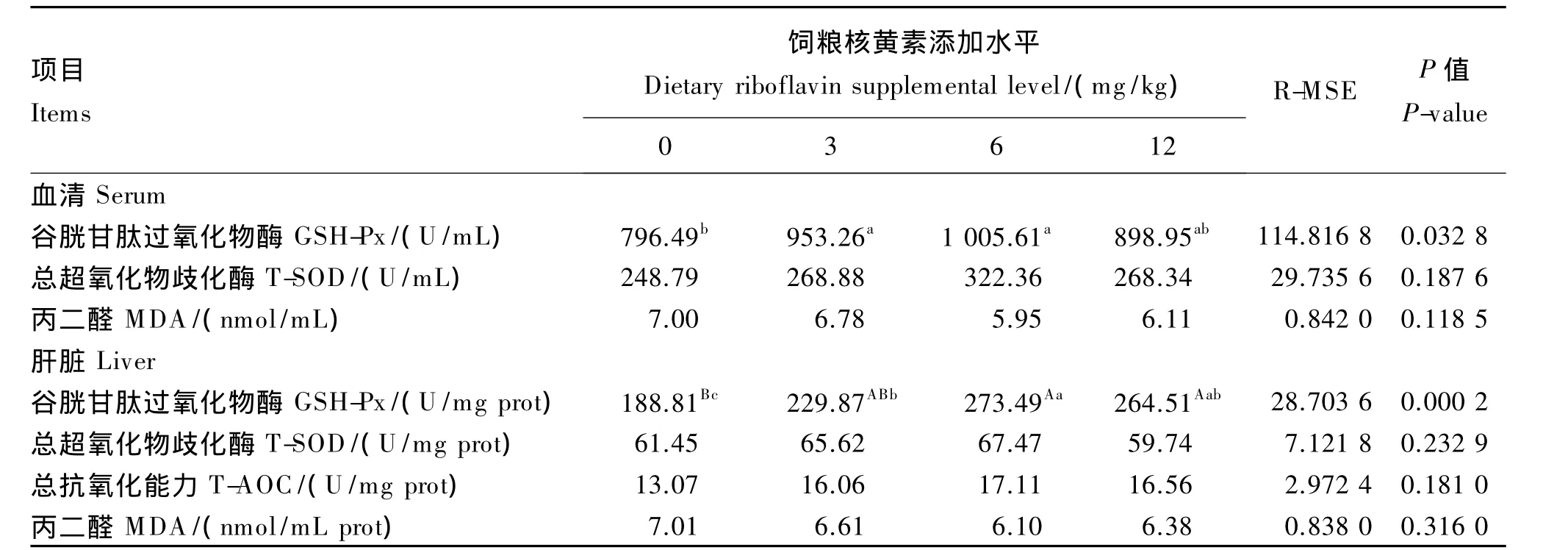
表5 饲粮核黄素添加水平对生长獭兔血清和肝脏抗氧化指标的影响Table 5 Effects of dietary riboflavin supplemental level on serum and liver antioxidant indices of growing Rex rabbits(n=8)
3 讨论
3.1 饲粮核黄素添加水平对生长獭兔生长性能的影响
核黄素通过参与构成各种黄酶的辅基,与碳水化合物、蛋白质和脂肪的代谢密切相关。
饲粮中核黄素不足会显著降低家禽的生长性能。饲粮中缺乏核黄素造成肉鸡生长受阻、饲料利用率降低[8-10]。同时,核黄素可提高育肥猪料重比[11]。在本试验中,饲粮核黄素添加水平对生长獭兔的平均日增重、平均日采食量、料重比均没有产生显著影响,但是从数据趋势的分析可以看出6 mg/kg的添加水平最为适宜。
3.2 饲粮核黄素添加水平对生长獭兔毛皮质量的影响
獭兔毛皮具有很高的经济价值,皮张面积直接关系獭兔皮的使用价值,獭兔皮的厚薄直接影响鞣制质量,被毛长度也是评判兔皮好坏的重要指标之一。研究表明,猪缺乏维生素B2表现出被毛粗糙、皮炎等症状。核黄素缺乏可导致角膜混浊、鳞屑状皮肤炎、后腿及胸腹部呈鳞屑状皮肤炎并有红斑[12]。本试验结果表明,饲粮核黄素添加水平对生长獭兔的毛皮面积和毛皮重量有显著或极显著影响,并在添加水平为12 mg/kg时达到最大值。说明饲粮中添加核黄素对毛皮有益。但饲粮核黄素添加水平对生长獭兔毛皮厚度和被毛长度无显著影响,其具体作用机理有待进一步探究。
3.3 饲粮核黄素添加水平对生长獭兔血液指标的影响
血液中的CHO主要来源于肝脏合成,血液中的CHO一部分到组织中构成细胞结构的成分,另一部分转变为重要的固醇衍生物可变为维生素D3促进钙的吸收或类固醇激素代谢,血清CHO含量是反映机体血脂的重要指标[12],霍思远等[14]研究发现,饲粮中添加适量核黄素可促进机体CHO的吸收,提高代谢效率,但核黄素添加水平过高或过低都会抑制机体代谢。本试验中添加6 mg/kg核黄素显著提高血清CHO的含量,说明添加核黄素可以促进机体对CHO的吸收,极高机体代谢。
核黄素对血清TP、ALB、UN含量均无显著影响,但可以看出其含量随饲粮核黄素添加水平的增加而增加,血清ALB含量是反映肝功能、肾功能的主要指标,血清TP含量高表明机体蛋白质代谢旺盛;动物体内蛋白质代谢和饲粮氨基酸平衡状况的重要指标之一就是血清中UN含量。其原因可能是核黄素其生理功能主要是黄素单核苷酸和黄素腺嘌呤二核苷酸的前体,二者作为中间代谢多种酶的辅酶参与机体蛋白质的代谢,但可能并不直接作用于獭兔蛋白质代谢关键酶,故不能对蛋白质和氨基酸代谢产生显著影响[15]。
LDL-C可以将肝脏合成的内源性CHO转运到肝外组织,保证组织细胞对CHO的需求,HDL-C是从肝外组织将CHO转运到肝内进行代谢[16]。TG是一种能量储备物质,是游离脂肪酸和甘油结合形成的。有研究证明,核黄素缺乏细胞中载脂蛋白B分泌减少可干扰体内脂质平衡[17]。而HDL-C通过载脂蛋白A1激活卵磷脂胆固醇脂酰转移酶,生成胆固醇脂。
3.4 饲粮核黄素添加水平对生长獭兔血清和肝脏抗氧化指标的影响
GSH-Px是一种重要的过氧化物分解酶,其活性可以反映机体清除自由基的能力。Kotegawa等[18]研究发现,核黄素缺乏导致晶状体谷胱甘肽还原酶(GR)活性显著降低,GSH-Px活性增加,脂质过氧化产物含量增加。本试验发现,随饲粮核黄素添加水平的增加,血清和肝脏中的GSH-Px活性在核黄素添加水平为6 mg/㎏时高于其他组,这可能是因为添加适宜水平的核黄素可以促进体内的氧化还原反应,清除自由基,发挥抗氧化作用。超氧化物歧化酶(SOD)是一种金属酶,是体内最为重要的自由基清除剂。经动物试验表明核黄素缺乏组大鼠红细胞含较高水平的脂质过氧化物,GSH-Px活性升高,但 SOD活性未受影响[3]。本试验中饲粮核黄素添加水平对血清和肝脏中的T-SOD活性无显著影响,这与上述研究结果相符。
T-AOC用于衡量机体抗氧化能力的综合性指标,MDA为脂质过氧化物之一,其含量可间接反映细胞损伤程度。吴晖云等[19-20]研究发现,核黄素缺乏组大鼠红细胞膜流动性下降,红细胞膜MDA含量显著高于核黄素添加组。本试验发现,随着饲粮核黄素添加水平的增加,肝脏和血清中的MDA含量呈降低的趋势,而T-AOC有升高的趋势,并在核黄素添加水平为6 mg时MDA含量最低,而T-AOC最高。由此可见,饲粮中添加适宜水平的核黄素能提高生长獭兔的抗氧化功能。
4 结论
综上所述,生长獭兔的饲粮核黄素添加水平为6 mg/kg(饲粮核黄素实测含量为8.35 mg/kg)时能显著提高毛皮质量和机体的抗氧化功能。
[1] 唐淑珍,孙国君,盛明明.高温季节饲粮核黄素水平对肉仔鸡生产性能的影响[J].饲料博览,2007(6):5-8.
[2] DUTTA P,SEIRAFI J,HALPIN D,et al.Acute ethanol exposure alters hepatic glutathione metabolism in riboflavin deficiency[J].Alcohol,1995,12(1):43-47.
[3] LEVIN G,COGAN U,LEVY Y,et al.Riboflavin deficiency and the function and fluidity of rat erythrocyte membranes[J].The Journal of Nutrition,1990,120(8):857-861.
[4] PORRINI M,SIMONETTI P,TESTOLIN G,et al.Relation between diet composition and coronary heart disease risk factors[J].Journal of Epidemiology &Community Health,1991,45(2):148-151.
[5] HENNEKENS C H.Platelet inhibitors and antioxidant vitamins in cardiovascular disease[J].The American Heart Journal,1994,128(2):1333-1336.
[6] SALOMÃO M Q,CHAURASIA S S,ABHIJIT S R,et al.Corneal wound healing after ultraviolet-A/riboflavin collagen cross-linking:a rabbit study[J].Journal of Refractive Surgery,2011,27(6):401-407.
[7] 李福昌.兔生产学[M].北京:中国农业出版社,2009:234,1-2.
[8] 张建海,原广华,庞全海,等.不同核黄素水平对肉仔鸡外周血细胞、免疫器官及生产性能的影响[J].山东家禽,2003,24(2):9-11.
[9] 蒋守群,周桂莲,林映才,等.饲粮维生素B2水平对1~21日龄黄羽肉鸡生长性能、免疫机能和抗氧化能力的影响[C]//第十四届全国家禽科学学术讨论会论文集.哈尔滨:第十四届全国家禽科学学术讨论会,2009:1015-1021.
[10] DEYHIM F,BELAY T,TEETER R G.An evaluation of dietary riboflavin supplementation on growth rate,feed efficiency,ration metabolizable energy content,and glutathione reductase activity of broilers[J].Nutrition Research,1992,12(9):1123-1130.
[11] 陈明华.超量维生素支持瘦肉生长[J].畜禽业,2001(12):39.
[12] 吴灵英.影响宠物狗皮毛健康的营养因素[J].饲料广角,2003(17):32.
[13] RENEMA R A,ROBINSON F E,PROUDMAN J A,et al.Effects of body weight and feed allocation during sexual maturation in broiler breeder hens.2.Ovarian morphology and plasma hormone profiles[J].Poultry Science,1999,78:629-639.
[14] 霍思远.核黄素对5~11周龄生长蛋鸭生产性能及生化指标的影响[D].硕士学位论文.哈尔滨:东北农业大学,2012.
[15] MOOKERJEA S,HAWKINS W W.Some anabolic aspects of protein metabolism in riboflavin deficiency in the rat[J].British Journal of Nutrition,1960,14:231-238.
[16] 胡兰.动物生物化学[M].北京:中国农业大学出版社,2007:164-192.
[17] MANTHEY K C,CHEW Y C,ZEMPLENI J.Riboflavin deficiency impairs oxidative folding and secretion of apolipoprotein B-100 in HepG2 cells,triggering stress response systems[J].The Journal of Nutrition,2005,135(5):978-928.
[18] KOTEGAWA H,SUGIYAMA M,HARAMAKI N.Protective effects of riboflavin and its derivatives against ischemic reperfused damage of rat heart[J].Biochemistry and Molecular Biology International,1994,34(4):685-691.
[19] 吴晖云,林利平,李珏声,等.核黄素缺乏大鼠红细胞膜流动性与脂质过氧化关系的研究[J].营养学报,1993,15(4):407-410.
[20] 吴晖云,林利平,李珏声.核黄素缺乏大鼠红细胞维生素E水平的变化及脂质过氧化关系的研究[J].卫生研究,1994,23(1):43-44

