自主运动对小鼠神经干细胞增殖及相关基因表达的影响
陆 乐徐 波张宪亮
(1.上海师范大学体育学院, 上海 200234;2.华东师范大学体育与健康学院,上海 200241)
自主运动对小鼠神经干细胞增殖及相关基因表达的影响
陆 乐117徐 波2张宪亮2
(1.上海师范大学体育学院, 上海 200234;2.华东师范大学体育与健康学院,上海 200241)
实验选用24只5周龄的C57BL/6雄性小鼠,随机分为运动组12只(R组)和对照组12只(C组),其中R组进行8周自主跑轮运动。第5周开始,随机从两组小鼠中各抽取6只,共12只进行连续1周的BrdU注射。8周运动结束后,对12只未注射BrdU的小鼠进行断颈,取双侧海马,放入-80℃超低温冰箱保存,待检测生化指标。对注射BrdU的12只小鼠进行免疫组化染色预处理,随后进行BrdU单标免疫荧光染色,从形态学角度观察神经干细胞增殖情况并计数。对未注射小鼠进行RT-PCR检测其NGF、Jagged-1、PS1、Hes1、Hes5、Hes6的 mRNA水平;结果:8周自主运动后小鼠海马神经干细胞数量显著增加(p<0.01),Notch信号通路中配体Jagged-1、靶基因Hes1的mRNA表达水平显著升高(p<0.01)。神经生长因子NGF的mRNA表达量显著升高(p<0.01)。NGF与配体Jagged-1、靶基因Hes1呈高度相关性(p<0.01)。结论:8周自主跑轮运动促进小鼠海马神经干细胞增殖,可能和Notch信号通路的激活有关。此外,8周运动促使NGF的表达量升高,提示NGF与Notch信号通路可能存在交互作用,可以共同调节Notch信号通路下游靶基因的变化,从而影响神经干细胞的增殖分化。
神经干细胞增殖;Notch信号通路;自主跑轮运动;NGF
生物界和医学界长期以来认为,包括大脑在内的人类发育早期的中枢神经系统的神经回路一旦形成,就不会再产生新的功能性神经元。伴随着年龄增长,功能性的神经元数量逐步减少、功能逐渐退化,伴随产生的类似阿尔兹海默病、帕金森病等神经系统退行性病变都是不可逆现象。20世纪60年代,有研究者发现并正式确认了成年鼠脑内存在新生的功能性神经元,并且在特定环境下能够改变自身的结构和功能,增殖、迁移整合到原本损伤或退化的功能区域,由此将此类现象命名为“神经发生”[1]。运动作为一类有效的外部刺激手段,能够调节不同的信号通路和相关因子的表达,影响神经干细胞的增殖分化,对大脑进行可塑性的调控,延缓中枢神经系统神经元数量和质量的双重退化。研究显示,Wnt[2]、Notch等信号通路以及BDNF、NGF等神经营养因子均在神经干细胞增殖分化过程中起到一定的调控作用。Notch信号通路是一条高度保守的信号通路,具体功能表现为对细胞命运的决定并影响细胞谱系的发展,在胚胎发育早期和成年期,从细胞内外信号分子传到的各个层面影响干细胞的增殖和分化[3]。具体来说,Notch信号通路主要通过“旁侧抑制”作用首先确保新生细胞的增殖数量,并保证增殖的同质细胞顺利分化为不同的功能化细胞。而神经生长因子(nerve growth factor, NGF)对神经干细胞增殖分化有重要的调控作用,并且最新的研究发现NGF可能与Notch信号通路产生交互作用[4],共同调节神经发生过程。因此本研究选用自主跑轮运动作为运动干预模式,探究8周自主运动对小鼠神经干细胞增殖情况及Notch信号通路相关因子,并结合NGF的表达变化,探究自主跑轮运动对神经干细胞增殖情况的影响和相关机制。
1 研究对象与方法
1.1 实验对象与分组
5 周龄的C57BL/6雄性小鼠24只(由上海斯莱克公司提供),体重:(18.18±0.50)克。所有小鼠分笼饲养,每笼1只,自由饮食饮水。饲养温度:22±1℃;饲养湿度:40%-60%;自然昼夜节律变化光照。随机分为运动组(R组)和对照组(C组),每组12只。
1.2 运动方案
R组小鼠置于装有自主跑轮的笼中进行8周自主跑轮运动,C组小鼠置于空笼中安静饲养8周。每天记录运动量数据。
1.3 BrdU注射
第5周开始,随机从两组小鼠中各抽取6只,共计12只。进行连续1周的BrdU腹腔注射,注射量:50mg/kg,注射时间:每日下午体重称量完成后。
1.4 组织取材
8 周运动结束后,对12只未注射BrdU的小鼠进行断颈,取出双侧海马,放入-80℃超低温冰箱保存,待检测生化指标。对注射BrdU的12只小鼠进行免疫组化染色预处理,预处理步骤参照刘瑾彦[5]等的实验方法。
1.5 RT-PCR:检测Jagged-1、PS-1、Hes-1、Hes5、Hes-6、NGF的mRNA表达水平
用Trizol法提取小鼠双侧海马内总的RNA,通过逆转录得到相对稳定的cDNA,实时荧光定量PCR检测小鼠海马Jagged-1、PS-1、Hes-1、Hes5、Hes-6、NGF的mRNA表达水平。引物序列见表1。

表1 引物序列
1.6 免疫组织化学荧光染色法:检测神经干细胞增殖
取出注射过BrdU小鼠双侧海马组织,用OCT包埋。在恒温冰冻切片机中进行冰冻、切片。厚度:20μm,室温静置12h干燥后放置于-80℃冰箱保存。按照免疫荧光染色步骤进行组织染色,最后用荧光显微镜观察切片,避光拍片。
1.7 数据处理
运用SPSS17.0、GraphPad Prism5图像处理软件进行统计学计算与分析,所有数据均用平均数±标准差来表示。其中,P <0.05表示具有显著性差异,P <0.01表示具有极显著性差异。
2 结果与分析
2.1 对小鼠海马神经干细胞增殖情况的影响
如图1,运动组小鼠海马新生神经干细胞数量(281.25±55.31)明显多于对照组小鼠(67.25±12.39),具有极显著性差异(p<0.01)。
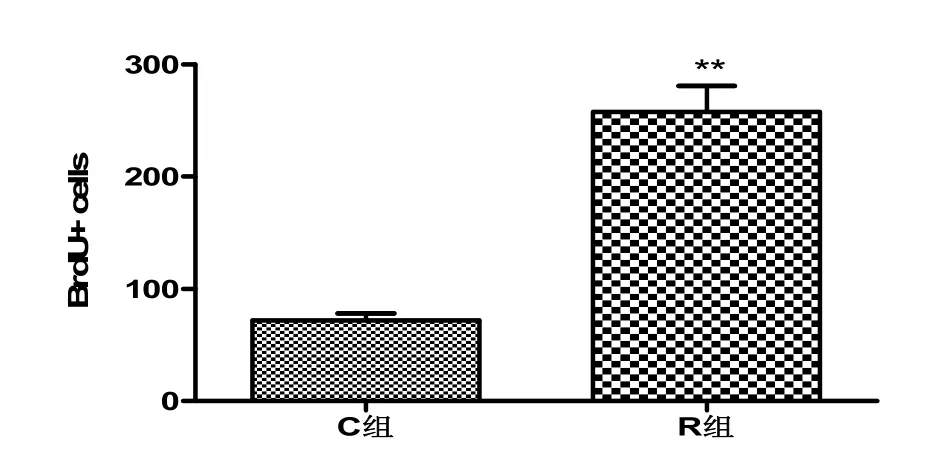
图1 两组小鼠海马神经干细胞增殖数量的比较
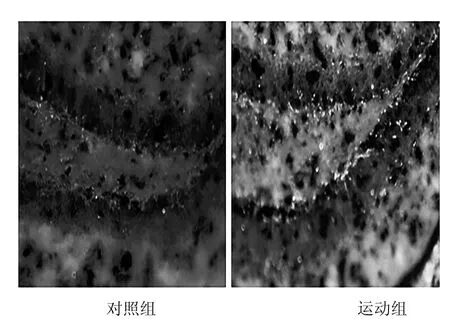
图2 小鼠海马神经干细胞增殖情况
2.2 对小鼠神经干细胞增殖相关基因Jagged-1、PS-1、Hes-1、Hes5、Hes-6、NGF的mRNA表达水平的影响
如表2所示,8周自主跑轮运动后,运动组小鼠的Jagged-1、Hes-1和NGF表达量明显上升,与对照组比较具有极显著性差异(p<0.01)。此外,PS1和Hes5的表达也有上升趋势,但无显著性差异。

表2 神经干细胞增殖相关基因表达
2.3 NGF、Jagged-1、Hes1的相关性分析
如表3所示,NGF与Jagged-1的相关系数为0.75,具有极显著性差异(p<0.01),为高度相关。NGF与Hes1的相关系数为0.78,具有极显著性差异(p<0.01),为高度相关。
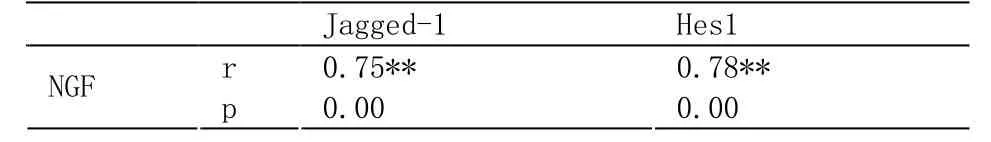
表3 NGF、Jagged-1、Hes1的相关性
3 讨论
自1965年Altman等人发现在成年小鼠脑内存在新生的神经干细胞,并能够通过增殖、分化、迁移并发挥功能性作用以来,不断有研究分别从形态学、基因水平和蛋白水平等多角度证实了侧脑室的室管膜下层(sub ventricular zone, SVZ)和海马齿状回的颗粒细胞下层(sub granular zone, SGZ)为“神经发生”的典型区域[6]。许多研究通过设置穿梭隧道、迷宫、跑轮等设施创造丰富环境[7],观察到在丰富环境下,小鼠的神经干细胞增殖明显,成年神经发生现象明显增强,通Morris水迷宫测试发现小鼠的学习记忆能力有所提高。“丰富环境”是一个较为复杂的概念,包括各类主被动运动、动物社交环境以及群体效应等。为了区分不同施加因素对小鼠神经干细胞的影响,出现了各类单独干预因素的研究。结果发现,作为积极的刺激手段—运动尤其是自主运动,与丰富环境组比较,运动组小鼠的神经干细胞增殖数量更多,树突密度增加,神经回路更加紧密,学习记忆能力提高显著[8]。
为避免被动运动带来的干扰,本实验采用自主跑轮运动此类出于自愿的运动模式为外部干预手段。采用BrdU单标记免疫组织化学法,从第5周开始注射BrdU,观察8周自主跑轮运动后小鼠海马神经干细胞增殖情况。8周运动结束后发现,自主运动组小鼠海马区的神经干细胞数量较对照组有极显著性差异(p<0.01),约为对照组的4倍。这与已有的研究结果保持一致,说明海马是一个极具可塑性的脑区,合理的运动能够促进该脑区的神经干细胞增殖,为学习记忆等认知功能的改善创造条件。
自上世纪60年代,研究者发现成年的中枢神经系统依然具备产生新的功能性神经元后,关于其潜在的调控机制的研究不断出现。其中,作为高度保守的信号通路,Notch信号通路在神经干细胞增殖分化过程中起到关键作用,具体功能表现为对细胞命运的决定并影响细胞谱系的发展,在胚胎发育早期和成年期,从细胞内外信号分子传到的各个层面影响干细胞的增殖和分化[3]。具体来说,Notch信号通路主要通过“旁侧抑制”作用首先确保新生细胞的增殖数量,并保证增殖的同质细胞顺利分化为不同的功能化细胞。Notch信号通路由三部分组成,包括(Notch1-4)受体、配体(Jagged家族的Jagged-1、Jagged-2和Delta-like家族的DLL1、DLL3和DLL4)、下游信号分子组成。Notch受体是一个约300kDa的单次跨膜受体蛋白, 配体为Ⅰ型单次跨膜糖蛋白,通常认为Notch信号通路的激活是通过“三步酶切”实现的[9]。该信号通路的各个环节都是影响神经干细胞生长发育的重要环节。PS是γ-分泌酶复合物的主要成分,有研究发现,抑制PS1的活性能够影响胞内信号分子Hes5的表达[10]。同时敲出PS1和PS2后,小鼠在发育早期就表现出更严重的神经系统发育缺陷[11]。Notch信号通路下游的主要调控因子为碱性螺旋环螺旋因子(bHLH)家族,可分为抑制性bHLH和促进型bHLH两类[12],前者包括Hes1、Hes3、Hes5等,Hes1和Hes5是维持神经干细胞保持增殖状态的必须因子,用以保证放射状胶质细胞维持增殖状态。后者包括Mash1、Math、Ngn等,主要功能为保证神经细胞的有效分化和功能发挥。此外,近年来表达量并不高的Hes6也引起了人们的关注,Hes6在分化以及未分化的细胞中都表所达,并对Hes1有一定的抑制作用。在Notch信号通路的所有配体中,Jagged-1能与多个受体结合,而Notch信号通路激活的第一步就是受体与配体的结合,因此可以认为Jagged-1的表达是影响该信号通路激活与否的重要因素。本实验发现,8周自主运动后小鼠海马内的Jagged-1mRNA的表达量显著上升,说明运动能够促使该信号通路更多的受体与配体结合。此外,实验发现,运动后Notch信号通路下游最重要的靶基因Hes1的基因表达量也显著提高,而Hes1是启动细胞增殖的关键因子。但运动组与对照组小鼠比较,Hes5和Hes6的mRNA水平没有显著性差异,分析原因可能与该基因在海马内的表达量较低有关,也可推测运动对Hes1的作用更为明显,表达量较低的Hes6所起到的抑制作用不能体现。
神经生长因子(neuron growth factor)NGF是一种分子质量为140 kD的跨膜型糖蛋白,作为中枢神经系统重要的神经营养因子,对神经元的生长发育、分化存活以及功能的维持起着至关重要的作用,主要分布在海马、嗅球、大脑皮层及纹状体中间神经元的胆碱能神经元内[13]。其中海马内NGF的蛋白表达水平最高。本实验结果显示,运动能够促使NGF的表达升高,与对照组比较具有极显著性差异(p<0.01)。NGF 可以与其高亲和力受体TrkA结合后,激活PI3K/Akt信号通路,活化的Akt可以使得凋亡基因失活,维持神经元存活,使得新生的神经细胞能够整合到现有的神经网络回路中,发挥功能性作用。Patricia 等[4]运用海马神经元培养技术研究发现:Notch信号通路与NGF可能存在交互作用,NGF可以通过与其低亲和力受体P75结合,通过NF-kB介导引起Notch信号通路下游靶基因Hes1/5表达水平的变化。
基于此,本研究对NGF与Notch信号通路中的关键因子Jagged-1和Hes1作了相关性分析,发现NGF与Jagged-1的相关性系数为0.75,与Hes1的相关性系数为0.78,均表现为高度相关,并且运动组小鼠的NGF和Hes1的表达量均显著升高。由此推测8周自主运动可能通过调控NGF,并直接作用于Notch下游靶基因Hes1,启动神经干细胞增殖。此外,本实验结果显示,8周运动后PS1的mRNA表达水平没有显著性变化,进一步可以推测,8周自主运动后促使NGF 对Notch信号通路的激活作用更显著,说明NGF对自主运动的敏感性更强。但PS1在此过程中究竟发挥什么样的功能还需要进一步的探究。
[1] Altman J. Are new neurons formed in the brains of adult mammals [J].Science, 1962, (135):1127-1128.
[2] Dieter-Chichung Lie. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(27): 1370-1375.
[3]Shigeru Chiba.Concise Review:Notch Signaling in Stem Cell Systems[J].Stem Cells, 2006,24:2437–2447.
[4] Patricia Salama-Cohen, Maria-Angeles Arevalo,Jochen Meier,etal. NGF Controls Dendrite Development in Hippocampal Neurons by Binding to p75NTRand Modulating the Cellular Targets of Notch [J]. Molecular Biology of the Cell: 2005, 16:339-347.
[5]刘瑾彦,娄淑杰,陈佩杰.跑台运动对幼龄大鼠海马齿状回区神经再生的影响[J].中国运动医学杂志.2006,25(2):171-175
[6] Johansson CB ,Momma S ,Clarke DL ,et al. Identification of a neural stem cell in the adult mammalian central nervous system[J]. Cell, 1999, 96:25-34.
[7] Henriette Van Praag, Brian R Christie,et al. Running Enhances Neurogenesis,Learning, and Long-term Protestation in Mice[J].Neurobiology,1999,96 (9):13427-13431.
[8] Eadie,B.D., Redila, V.A, Christie,B.R et al. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density [J]. Comp. Neurol., 2005, 486: 39–47.
[9] Kopan R, Ilagan MX.The canonical Notch signaling pathway: unfolding the activation mechanism[J].Cell , 2009,137:216–233.
[10] Handler M, Yang X, Shen J.Presenilin-1 regulates neuronal differentiation during neurogenesis[J]. Development 2000,127:2593-2606.
[11] Donoviel DB, Hadjantonakis A, Ikeda M et al.Mice lacking both presenilin genes exhibit early embryonic patterning defects[J].Gene &Dev 1999,13:2801-2810.
[12] Kageyama.R, Ohtsuka.T, J. Hatakeyama.J, et al,Roles of bHLH genes in neural stem cell Differentiation[J].Experimental Cell Research, 2005,306(2):343-348.
[13] 李家鑫,曾丽.神经生长因子研究与周围神经损伤的治疗进展[J]. Guangxi Medical Journal 2007, 29 (1): 60–62.
Effects of Voluntary Exercise on Neural Stem Cell Proliferation and Related Genes of Mice
LU Le,etal.
(PE School of Shanghai Normal University, Shanghai 200234, China)
[Objective and Methods] 24 male mice borned 5 weeks (C57BL/6) are randomly divided into running group (n=12) and control group (n=12), while the running group do voluntary wheel running for 8 weeks. Since the 5th week, 12 mice( each 6 from the two groups) were datelabelled with BrdU for one week, at the. The 12 mice without BrdU datelabelled were killed on the last day after 8 weeks exercise, bilateral hippocampal of them were taken out to be kept in - 80 ℃ cryogenic refrigerator, the mRNA levels of NGF, Jagged-1 mRNA, PS1, Hes1, Hes-5, Hes6 of them were tesetd by RT-PCR method. The 12 mice with BrdU datelabelled were pretreated by immunohistochemical method, then were stained with the method of BrdU single standard immunofluorescence. From the perspective of morphological, neural stem cells proliferation of them were observed and counted. [Results] After 8 weeks of autonomous movement, number of hippocampal neural stem cells increased significantly (p < 0.01) , the ligand Jagged-1 in Notch signaling pathway, mRNA expression level of Hes1 target gene were significantly increased (p < 0.01). the amount of mRNA expression of nerve growth factor NGF significantly increased (p < 0.01).There is highly correlation among model NGF, ligand Jaged-1 and target genes Hes1 (p < 0.01).[Conclusion] 8 weeks voluntary exercise can obviously increase BrdU+labeled neural stem cells in hippocampal region; Voluntary exercise significantly increased Jagged-1 and Hes1gene expression, illustrating that voluntary exercise activate the Notch signaling pathway, which impact the hippocampal neural stem cell proliferation; NGF could directly regulate Notch downstream target genes expressions, which participate in the regulation of neural stem cell proliferation, and affect the ability of learning and memory.
neural stem cell proliferation; Notch signal pathway; voluntary wheel exercise; NGF
陆乐(1987-),上海人,助理实验师,研究方向:体育运动与身心健康。

