棘腹蛙Japonicin-pb抗菌肽的分离及表达谱分析
姜玉松 陈德碧 邹 勇 周继萍 樊汶樵 徐敬明
(1.重庆文理学院林学与生命科学学院,重庆402160;2.重庆珍稀濒危水产资源保护与开发研究中心,重庆402168)
抗菌肽不仅具有广谱的抗细菌能力,还有抗真菌、抗寄生虫、抗病毒等功能,是先天性免疫系统的重要成员之一。目前,已从植物、微生物、软体动物、昆虫、鱼类、两栖动物、鸟类、哺乳动物等多种生物体内分离得到超过2 000种抗菌肽[1],其中大多数抗菌肽具有α-螺旋或者β-折叠结构,有些同时包含这2种结构[2]。Japonicin是一类多功能抗菌肽,最先从日本林蛙的皮肤中分离[3],根据氨基酸序列的组成及结构特征,Japonicin抗菌肽可以分为Japonicin-1和Japonicin-2两大类。其中,Japonicin-1含2个半胱氨酸构成的7个残基的环,而Japonicin-2含2个半胱氨酸组成的8个残基的环。在抑菌活性方面,Japonicin-1对大肠杆菌和金黄色葡萄球菌都有抑制活性,最小抑菌浓度分别为12和20μmol/L,而 Japonicin-2只对大肠杆菌有活性,最小抑菌浓度为 20 μmol/L[4]。此外,Lu等[5]发现云南倭蛙来源的 Japonicin-1npb除对对金色葡萄球菌有显著的抑制效果外,还能有效清除因紫外线照射、环境污染、氧化应激等产生的自由基。
Japonicin抗菌肽对细菌、肿瘤等靶向细胞具有较高的选择性和稳定性,且特定种类的两栖动物分泌的Japonicin又具有种属间的特异性[6],这在一定程度上丰富了抗菌肽资源库。棘腹蛙(Paa boulengeri)属两栖纲无尾目蛙科[7],是我国特有的大型蛙类。棘腹蛙喜欢生活在潮湿的环境,环境中微生物的种类和数量都非常丰富,为了保护免遭外源病原微生物的侵害,棘腹蛙已经进化出了多种机制来对抗这些有害因素,如背部遍布能够分泌活性物质的窄长疣等。但是目前关于棘腹蛙皮肤抗菌肽,尤其是Japonicin抗菌肽的研究尚未见报道。本研究基于棘腹蛙皮肤转录组数据,从皮肤组织中扩增了棘腹蛙来源的3种Japonicin-pb前体序列,通过信号肽预测和结构域分析确定了Japonicin-pb的成熟肽,并研究了其在不同生长环境、组织中的表达谱,旨在为棘腹蛙养殖过程中的疾病防控以及棘腹蛙来源Japonicin-pb抗菌肽的开发应用奠定基础。
1 材料与方法
1.1 动物材料
棘腹蛙(酉阳)生长在本实验室的流水养殖系统中,挑选健康的2龄成蛙,分别转移至15、18、21、24、27和30℃的恒温箱中(n=10),适应生长30 d后采用双毁髓法处死并取其各组织,液氮保存。
1.2 总RNA提取
参照Trizol试剂盒(Invitrogen,美国)说明书进行。分别取50 mg液氮冷冻的棘腹蛙血液、肌肉、肝脏和皮肤组织,于预冷的研钵中迅速研磨至粉末,转移至1.5 mL离心管。加入1 mL Trizol试剂,室温静置5 min,加入200μL氯仿,涡旋混匀,室温放置3~5 min,待其分层,4℃,12 000 ×g离心15 min,收集水相。加入等体积预冷的异丙醇,室温放置15 min,4 ℃,12 000×g离心10 min,收集沉淀。75%的乙醇洗涤,室温晾干,加入30~50μL ddH2O溶解RNA。RNA的完整性通过1%琼脂糖凝胶电泳检测,RNA浓度用紫外分光光度计(Amersham,美国)测定。
1.3 第1链cDNA的合成
cDNA合成根据Roche第1链cDNA合成试剂盒(Transcriptor First Strand cDNA Synthesis Kit,Roche,德国)说明书进行。在0.5 mL RNase free EP管中加入 3μL total RNA,1μL Oligo(dT)Primer(50 μmol/L),9 μL RNase free ddH2O。将混合物65℃ 10 min,冰上冷却2 min,离心,加入4 μL 5 × First-strand Buffer,0.5 μL RNase Inhibitor(40 U/μL), 2 μL Deoxynucleotide Mix(10 mmol/L),0.5 μL Transcriptor Reverse Transcriptase(20 U/μL)。混合物颠倒混匀,25 ℃10 min,50℃ 60 min。85℃ 5 min,终止反应。所得第1链cDNA产物可稀释后或直接用于PCR反应。
1.4 Japonicin-pb的克隆
从 GenBank 数据库(http://www.ncbi.nlm.nih.gov/genbank)中下载已公布的其他物种来源Japonicin氨基酸序列,利用DNASTAR软件分析寻找其保守区域,以保守区域搜索本实验室构建的棘腹蛙转录组本地Blast数据库,从而找出编码棘腹蛙Japonicin-pb的转录本,根据搜索到的转录本设计特异性引物进行PCR扩增。PCR扩增采用25μL体系。在0.2 mL的EP管中按下列组分配成 PCR 反应体系:2.5 μL 10 × PCR Buffer,1.5 μL 镁离子(Mg2+)(25 mmol/L),2.5 μL dNTP mixture(2 mmol/L),0.5 μL PrimerF(10 μmol/L),0.5 μL PrimerR(10 μmol/L),0.5 μL KODPlus-Neo(1 U/μL)(KOD-Plus-Neo,TOYOBO,日本),1μL反转录产物,16μL ddH2O,混匀后瞬离。PCR反应条件为:94℃预变性2 min;98℃10 s,56 ℃ 30 s,68 ℃ 1 min,32 个循环;68 ℃ 后延伸1 min。PCR产物经1.5%琼脂糖凝胶电泳检测后用DNA凝胶回收试剂盒(AXYGEN,美国)进行回收。
PCR产物回收后连接T载体PMD-19(TARAKA,日本)转化DH5α菌株,过夜培养后挑选单克隆送交测序公司(GENEWIZ,北京)进行序列测定。
1.5 3种Japonicin-pb在不同生长温度下的差异表达
根据3种Japonicin-pb的核苷酸序列差异,设计分别扩增 Japonicin-1apb、Japonicin-1bpb和 Japonicin-3pb 的特异性引物。以 15、18、21、24、27和30℃环境下适应生长30 d的棘腹蛙皮肤组织cDNA为模版,利用 Real-time PCR(LightCycler Nano System,Roche,德国)分别扩增 Japonicin-1apb、Japonicin-1bpb及 Japonicin-3pb的 ORF序列。根据荧光定量试剂盒(Faststar essential DNA Green Master,Roche,德国)说明书配制 20 μL 的反应体系。PCR反应条件为:95℃预变性10 min;95 ℃ 10 s,52 ℃ 10 s,72 ℃ 30 s,40 个循环。扩增 Japonicin-1apb、Japonicin-1bpb和 Japonicin-3pb和内参基因β-肌动蛋白(β-actin)的引物(表1)。

表1 试验所用引物Table 1 Primers used for the experiments
1.6 3种Japonicin-pb在不同组织的差异表达
以在21℃环境下适应生长30 d的棘腹蛙组织(血液、肌肉、肝脏和皮肤)cDNA为模版,利用Real-time PCR检测Japonicin-1apb、Japonicin-1bpb及Japonicin-3pb在各组织中的表达量。
1.7 生物信息学分析
用 DNASTAR软件进行ORF分析;在 Gen-Bank中下载其他物种来源的Japonicin的氨基酸序列,经DNASTAR软件比对确定其保守区域。用MEGA 5.0软件绘制系统进化树。
2 结果
2.1 棘腹蛙Japonicin-pb的克隆
从GenBank数据库中下载已公布的其他物种来源的Japonicin序列,利用DNASTAR软件分析并找出其保守区域,然后以保守区域MFTLKKSL和LLFFLGMISLSLCK来搜索棘腹蛙转录组本地Blast数据库(e值设为0.01),成功搜索到3条编码Japonicin的 Contig转录本,分别为 Contig_59031、Contig_41711和 Contig_54325。这 3条Contig转录本含有相同的135 bp的3’-UTR、完整的 ORF序列及分别为146、446和236 bp的5’-UTR。这3条 Contig转录本所编码的 ORF长度不同,分别为231、219及195 bp。
为了进一步验证这3条Contig转录本试验所编码的ORF确实存在于棘腹蛙皮肤组织中,分别设计了特异性引物(表1)进行PCR克隆及测序,测序结果表明这3条ORF均存在与棘腹蛙皮肤组织中,长度分别为231、219和195 bp(图1),分别编码76、73和65个氨基酸残基,与转录组组装结果一致。比对三者的氨基酸序列,表明N端前50个氨基酸残基高度一致,C端序列高度异质(图2),因此确定为棘腹蛙来源的3种不同Japonicin。Contig_59031、Contig_41711的成熟肽中含有2个半胱氨酸,因此二者属于Japonicin-1类抗菌肽,分别 命 名 为 Japonicin-1apb和 Japonicin-1bpb。Contig_54325成熟肽中不存在半胱氨酸,明显区别与Japonicin-1和Japonicin-2,可能是一种未见报道的新型抗菌肽,命名为Japonicin-3pb。
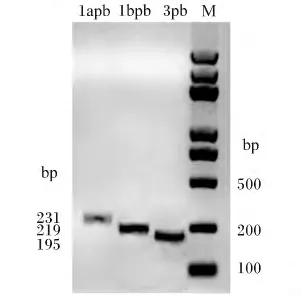
图1 Japonicin-pb基因的PCR扩增Fig.1 PCR amplification of Japonicin-pb gene
2.2 3种Japonicin-pb的差异表达
为了解 Japonicin-1apb、Japonicin-1bpb及 Japonicin-3pb抗菌肽对不同生长温度的响应规律,利用相对定量PCR进行分析,结果显示温度的变化对Japonicin-1apb的表达影响较大,其表达量与生长温度呈现相关性,而温度的变化对Japonicin-1bpb和Japonicin-3pb的表达影响较小(图3)。从15到30℃时,在 mRNA水平上,Japonicin-1bpb的表达量增加了4.32倍(P <0.05),Japonicin-3pb的表达量仅增加了1.73倍(P <0.05),Japonicin-1bpb的表达量一直维持在一个较低的水平,基本没有变化(P >0.05)。

图2 Japonicin-1apb、Japonicin-1bpb和Japonicin-3pb氨基酸序列Fig.2 Amino acid sequence alignment among Japonicin-1apb,Japonicin-1bpb and Japonicin-3pb
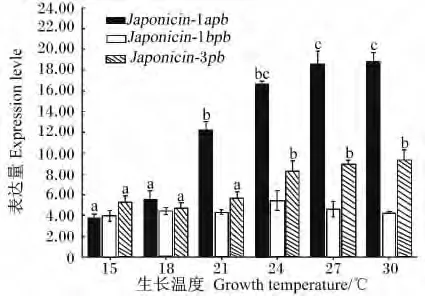
图3 不同生长温度下Japonicin-pb的差异表达Fig.3 Differential expression of Japonicin-pb in different growth temperatures
了解 Japonicin-1apb、Japonicin-1bpb及 Japonicin-3pb抗菌肽在不同组织的分布规律,能够为棘腹蛙免疫功能和免疫机制的研究提供基础。利用相对定量PCR的方法分别检测了Japonicin-1apb、Japonicin-1bpb及 Japonicin-3pb在血液、肌肉、肝脏、皮肤组织中的表达量,结果显示Japonicin-1apb主要在皮肤组织表达,Japonicin-3pb在肝脏中的表达较高,而Japonicin-1bp在各组织中的表达差异变化不大(图4)。
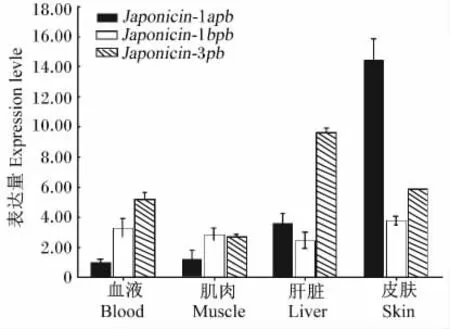
图4 不同组织中3种Japonicin-pb的差异表达Fig.4 Differential expression of Japonicin-pb among different tissues
2.3 Japonicin-pb 的进化
利用 MEGA 5.0软件的邻接法(neighbor-Joining method,NJ)构建了棘腹蛙源3种 Japonicin-pb与其他物种的Japonicins氨基酸序列之间的进化关系(图5)。从图5中可以看到,棘腹蛙源的3种Japonicins聚成一簇而与其他物种的进化关系较远。在 3种 Japonicin-pb中,相比 Japonicin-1apb、Japonicin-3pb和 Japonicin-1bpb具有更相似 的序列。
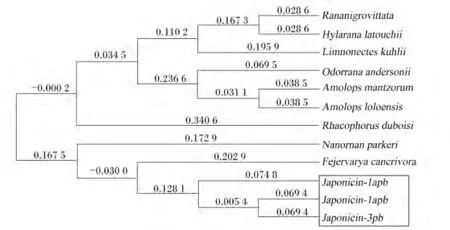
图5 Japonicin-pb氨基酸序列的系统进化树分析Fig.5 Phylogenetic tree analysis of Japonicin-pb amino acid sequence
3 讨论
作为抵御病原微生物入侵的第1道屏障,虽然从哺乳动物到低等的微生物中今均分离到了抗菌肽,但从种类和数量上来说,源于两栖动物的抗菌肽远多于其他物种[8-9]。目前,已经从600余种两栖动物皮肤中分离到了968种抗菌肽,例如蛙肽、瓜蛙肽等。根据氨基酸组成及结构的相似性,可以将两栖动物抗菌肽分成brevinins-1、brevinins-2、ranatuerins-1、ranatuerins-2、esculentins-2、Japonicin-1、Japonicin-2、nigrocin-2、esculenins-1、palustrin、rnanlexin、gaegurins、rugosins和 temporins等家族[6,10]。虽然不同抗菌肽家族的氨基酸序列差异较大,但是其结构上却存在显著的共性,例如序列中碱性氨基酸的含量比较高,带正电荷[11-12],以前体的形式分泌[3]等,使得在不同物种中分离抗菌肽甚至鉴定新型抗菌肽成为了可能。
日本林蛙来源的Japonicin是具有α-螺旋结构的阳离子型抗菌肽,其氨基酸序列为FGLPMLSILPKALCILLKRKC,共21个氨基酸残基,属于Japonicin-1家族。Japonicin-1抗菌肽成熟肽一般含2个半胱氨酸,能够形成含7个氨基酸残基的环形结构[3]。本研究中克隆到的3种棘腹蛙来源的Japonicin-pb前体序列,其结构均符合抗菌肽结构的一般特征,经过序列比对表明,三者都属于Japonicin家族。其中 Japonicin-1apb和 Japonicin-1bpb的成熟抗菌肽序列相似性较高,且含有2个形成7肽环的半胱氨酸残基(Cys68,74,Cys65,71),这与 Isaacson 等[3]分离的 Japonicin-1 的结构特征一致,隶属于Japonicin-1类。虽然Japonicin-3pb前体的信号肽和中间连接区域与Japonicin-1apb和Japonicin-1bpb有较高的相似性,但是成熟肽序列明显有别。为了防止Japonicin-3pb序列是因克隆测序错误而致,我们比对了这3种抗菌肽的3’UTR区域,结果显示 Japonicin-1apb和Japonicin-1bpb的3’UTR 完全一致,Japonicin-3pb的3’UTR序列和前两者几乎没有同源性。Japonicin抗菌肽家族除了 Japonicin-1外,Michael等[13]从昭觉林蛙(Rana chaochiaoensis)皮肤组织上分离到序列为FVLPLLGILPKELCIVLKKNC的Japonicin-2抗菌肽,含能形成8肽环的2个半胱氨酸残基,但是与本研究中的Japonicin-3pb也没相似性,因此Japonicin-3pb也不属于Japonicin-2家族。这些结果说明Japonicin-3pb不同于Japonicin-1和 Japonicin-2。
Japonicin-1bpb抗菌肽的表达在血液、肌肉、肝脏、皮肤组织中没有显著差异,且对温度变化的响应也不敏感,推测在棘腹蛙中Japonicin-1bpb可能是组成型表达,其稳定的表达是维持其正常免疫活动的基础。研究表明,抗菌肽除组成型表达外,还可以通过外界刺激或是病原微生物感染而诱导产生[14-16]。结合在棘腹蛙养殖过程中,当温度逐渐升高时,棘腹蛙皮肤组织Japonicin-1apb的表达也随之增加,表明Japonicin-1apb的表达可能受温度调控。因棘腹蛙长期生活在潮湿、富含有机质的环境中,当生长温度逐渐提高时,环境中微生物的数量也必然会随之增加,Japonicin-1apb的表达也可能会受微生物的诱导调控。虽然同一种抗菌肽分子在同一动物体中的不同组织中发现,但其表达量却有显著的差异。例如大多研究中分离到的抗菌肽在皮肤中的表达量明显高于其他组织[17-18]。由于两栖动物的皮肤中存在丰富的腺体,包括黏液腺和颗粒腺等,这些腺体是是分泌抵御病原体入侵活性物质的主要部位[19],这是生物体、环境长期的进化的结果。Japonicin-3pb主要在肝脏组织中检出,且当温度超过最适生长温度(21℃)后表达量逐渐增加,对温度的响应低于Japonicin-1apb。由于肝脏所处的微环境较皮肤稳定,且接触到的病原种类及数量明显少于皮肤 ,因此在长期的进化过程中形成了Japonicin-1apb的抗菌响应特征。鉴于两栖类复杂的生存环境,Japonicin-1apb在宿主复杂的免疫机制中不仅作为抗微生物感染作用的第1道防线,而且还可能发挥了其他重要功能,如抗氧化以保护两栖类裸露的皮肤等[20-22],但是具体作用机制还需进一步阐明。
4 结论
①本研究克隆到了棘腹蛙来源的Japonicin-1apb、Japonicin-1bpb和 Japonicin-3pb抗菌肽前体核苷酸序列,并确定了三者的成熟肽序列。
②Japonicin-1apb主要在皮肤组织中表达,且其表达量在一定温度范围内随着温度的升高而增加,Japonicin-3pb主要分布在肝脏中,其表达量在不同的生长温度下基本维持稳定,而Japonicin-1bpb在血液、肌肉、肝脏及皮肤组织中都有相似的表达水平,且不随生长温度的变化而变化。
[1] PEI J,ZHAO G,WANG B Z,et al.Three novel antimicrobial peptides from the skin of Rana shuchinae[J].Gene,2013,521(2):234 -237.
[2] DIAMOND G,LEGARDA D,RYAN L K.The innate immune response of the respiratory epithelium[J].Immunological Reviews,2000,173(1):27 -38.
[3] ISAACSON T,SOTO A,IWAMURO S,et al.Antimicrobial peptides with atypical structural features from the skin of the Japanese brown frog Rana japonica[J].Peptides,2002,23(3):419 - 425.
[4] KIM S S,SHIM M S,CHUNG J,et al.Purification and characterization of antimicrobial peptides from the skin secretion of Rana dybowskii[J].Peptides,2007,28(8):1532-1539.
[5] LU Z K,ZHAI L,WANG H,et al.Novel families of antimicrobial peptides with multiple functions from skin of Xizang plateau frog,Nanorana parkeri[J].Biochimie,2010,92(5):475 -481.
[6] 金莉莉,王秋雨.蛙科两栖动物皮肤抗菌肽的分子多样性及功能[J].遗传,2008,30(10):1241 -1248.
[7] 李益得,廖常乐,毛寿林,等.我国珍稀两栖动物——棘腹蛙[J].经济动物学报,2012,16(2):119-122.
[8] LI J X,WU H B,HONG J,et al.Odorranalectin is a small peptide lectin with potential for drug delivery and targeting[J].PLoS One,2008,3(6):e2381.
[9] 刘炯宇,江建平,谢锋,等.两栖动物皮肤结构及皮肤抗菌肽[J].动物学杂志,2004,39(1):112 -116.
[10] MA Y F,LIU C B,LIU X H,et al.Peptidomics and genomics analysis of novel antimicrobial peptides from the frog,Rana nigrovittata[J].Genomics,2010,95(1):66-71.
[11] 董世雷,刘伟,谢秀芝,等.抗菌肽及其应用前景概述[J].浙江农业学报,2011,23(6):1274 -1281.
[12] YOU D W,HONG J,RONG M Q,et al.The first geneencoded amphibian neurotoxin[J].The Journal of Biological Chemistry,2009,284(33):22079 -22086.
[13] CONLON J M,LEPRINCE J,VAUDRY H,et al.A family of antimicrobial peptides related to japonicin-2 isolated from the skin of the chaochiao brown frog Rana chaochiaoensis[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2006,144(1):101 -105.
[14] ZANETTI M.Cathelicidins,multifunctional peptides of the innate immunity[J].Journal of Leukocyte Biology,2004,75(1):39 -48.
[15] SHIKE H,LAUTH X,WESTERMAN M E,et al.Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge[J].European Journal of Biochemistry,2002,269(8):2232 -2237.
[16] CHEN SL,XU M Y,JIX S,et al.Cloning,characterization,and expression analysis of hepcidin gene from red sea bream(Chrysophrys major)[J].Antimicrobial Agents and Chemotherapy,2005,49(4):1608 -1612.
[17] WANG Y P,LU Z K,FENG F F,et al.Molecular cloning and characterization of novel cathelicidin-derived myeloid antimicrobial peptide from Phasianus colchicus[J].Developmental and Comparative Immunology,2011,35(3):314 -322.
[18] COWLAND J B,JOHNSEN A H,BORREGAARD N.hCAP-18,a cathelin/pro-bactenecin-like protein of human neutrophil specific granules[J].Febs Letters,1995,368(1):173 -176.
[19] NASCIMENTO A C,FONTES W,SEBBEN A,et al.Antimicrobial peptides from anurans skin secretions[J].Protein and Peptide Letters,2003,10(3):227 -238.
[20] LIU C B,JING H,YANG H L,et al.Frog skins keep redox homeostasis by antioxidant peptides with rapid radical scavenging ability[J].Free Radical Biology and Medicine,2010,48(9):1173 -1181.
[21] BRIGANTI S,PICARDO M.Antioxidant activity,lipid peroxidation and skin diseases.What’s new[J].Journal of the European Academy of Dermatology and Venereology,2003,17(6):663 -669.
[22] YANG H L,WANG X,LIU X H,et al.Antioxidant peptidomics reveals novel skin antioxidant system[J].Molecular & Cellular Proteomics,2009,8(3):571-583.

