牛樟芝联合化疗对恶性肿瘤患者免疫功能的影响
单丽珠,宋 腾,王华庆,2
牛樟芝联合化疗对恶性肿瘤患者免疫功能的影响
单丽珠1,3,宋腾1,王华庆1,2
目的:观察牛樟芝联合化疗对恶性肿瘤患者免疫功能及化疗毒副作用的影响。方法:将60例恶性肿瘤患者随机分为治疗组和对照组,治疗组(30例)采用牛樟芝联合化疗,对照组(30例)单纯化疗,两组同一病种化疗方案相同;观察两组化疗前后T细胞亚群及NK细胞活性的变化及生活质量和化疗毒副反应变化。结果:治疗组化疗后细胞免疫能力:CD4+(46.92±8.41)、CD4+/CD8+(1.50±0.39)及CD56+(20.55±4.43)明显高于化疗前(P<0.05);对照组CD4+(33.71±7.14)、CD4+/CD8+(0.80±0.13)及CD56+(13.44±4.42)均下降(P<0.05),化疗后治疗组CD4+、CD4+/CD8+及CD56+均明显高于对照组,而CD8+明显降低(P<0.05);治疗组血常规在化疗前后无明显变化,对照组血常规化疗后较化疗前降低(P<0.05),两组化疗后血常规变化具有统计学差异(P<0.05);治疗组不良反应发生率较对照组低(P<0.05)。结论:牛樟芝能提高机体免疫功能,稳定血常规,促进骨髓造血功能的恢复,减少化疗毒副反应的发生,改善患者生活质量,可作为恶性肿瘤化疗的辅助用药。
牛樟芝;化疗;恶性肿瘤;免疫功能
化疗作为恶性肿瘤重要治疗手段之一,在杀伤肿瘤细胞的同时,也会抑制机体正常的免疫系统。许多中成药在提高机体免疫力方面具有独特作用,且不良反应少,现已成为常用的化疗辅助药物。牛樟芝又名牛樟菇,是台湾特有的真菌,其主要活性成分为多糖体(β-D-葡聚糖)、三萜类化合物、超氧歧化酶、马来酸及琥珀酸衍生物等,具有强大的增强免疫之功效[1]。我科于2014年8月—2015年4月,对60例行化疗的恶性肿瘤患者随机分为加用牛樟芝的治疗组和不加牛樟芝的对照组,观察牛樟芝在提高免疫力、改善患者生活质量、减轻化疗毒副反应等方面的作用。现报道如下。
1 资料与方法
1.1研究对象本研究共60例,均为经病理或细胞学确诊的各种恶性肿瘤;无白血病和骨髓受累;年龄18~75岁;体质评分Karnorfsy>60分;估计生存期超过3个月;血红蛋白(Hb)90~150 g/L;白细胞(WBC)3.5×109/L~10.0×109/L;中性粒细胞绝对值(ANC)≥1.5×109/L;血小板(PLT)≥80×109/L;肝肾功能大致正常。其中恶性淋巴瘤为初治弥漫大B细胞淋巴瘤或滤泡淋巴瘤,分期为IIA期;非小细胞肺癌为IIIB期,不宜手术的初治患者;乳腺癌为术后病理学检查IIB-IIIA期患者;消化系肿瘤(结直肠癌、胃癌及食管癌)均为术后辅助化疗,且无肝脏受累的患者。两组一般资料:治疗组30例,其中男性18例,女性12例;恶性淋巴瘤12例,非小细胞肺癌7例,乳腺癌5例,结直肠癌2例,胃癌2例,食管癌2例;年龄28岁~70岁,中位年龄53岁;Karnorfsy评分70~100分。对照组30例,其中男性19例,女性11例;恶性淋巴瘤11例,非小细胞肺癌8例,乳腺癌4例,结直肠癌2例,胃癌3例,食管癌2例;年龄27~71岁,中位年龄51岁;Karnorfsy评分70~100分。两组一般资料比较差异无统计学意义。
排除标准:对治疗药物过敏及严重过敏体质者;肝癌患者;有化疗禁忌症者;因自身免疫疾病或其他原因,长期服用激素或免疫抑制剂者;难以控制的感染者;化疗前72 h内接受抗生素治疗者;既往使用过免疫增强剂者;有严重心肾肝等重要器官慢性疾病者;有严重精神或神经系统疾病,影响知情同意和/或不良反应表述的患者。所有研究对象在知情同意情况下,进行本项研究。
1.2治疗方法治疗组和对照组同一病种的化疗方案相同,化疗药物的给药剂量、先后顺序、时间和方法完全一致。均行2周期化疗,每周期化疗28天。化疗前30 min常规给予托烷司琼5 mg止吐治疗及其他支持治疗。治疗组化疗后3 d均给予宝芝莱牛樟芝(宝芝莱生物科技有限公司)6 g,2次/d,温开水冲服,连用21 d,共两个周期。化疗期间禁止使用其他抗肿瘤药、免疫增强剂(如干扰素、IL-2等)及其他中药等。
1.3外周血淋巴细胞亚群分析化疗前及化疗2周期后分别采集静脉血,流式细胞仪检测CD4+、CD8+、CD4+/CD8+及CD56+。抽取空腹静脉血2 mL,置于EDTA抗凝试管;取细胞悬液100 μL,加入20 μL相应荧光标记的单克隆抗体组合(CD4+-FITC、CD8+-PE、CD56+-PE,均为美国BD公司生产);振荡混匀,室温避光孵育20 min,加入溶血素FACS 450 μL摇匀。用500 μL磷酸盐缓冲液(PBS)洗涤2次,采用FACS Calibur流式细胞仪(美国BD公司生产)检测,并用CellQuest分软件分析,记录阳性细胞百分率。
1.4生活质量采用KPS评分,为便于比较,采用量化指标。KPS评分增加≥10分定义为有效,减少≥10分定义为无效,增加或减少<10分定义为稳定。
1.5化疗毒副反应 (1)血常规,每周期化疗前后均常规检测外周血细胞。(2)其他不良反应如皮疹、乏力、食欲减退、恶心呕吐、腹泻等。
1.6统计学方法应用SPSS 17.0软件进行统计学分析。计量资料采用均数±标准差(±s)表示,组间比较采用两样本均数t检验;计数资料用率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1T细胞亚群及NK细胞化疗前,两组T细胞亚群及NK细胞比较,差异无统计学意义(P>0.05)。与化疗前数据相比,治疗组化疗后CD4+、CD4+/CD8+、CD56+均显著升高(P<0.05),CD8+较化疗前有降低趋势。对照组CD4+、CD4+/CD8+、CD56+较化疗前均下降,CD8+较化疗前升高(P<0.05)。治疗组与对照组化疗后相比,CD4+、CD4+/CD8+、CD56+升高,CD8+下降(P<0.05)。见表1。
表1 两组化疗前后T淋巴细胞亚群及NK细胞参数比较(±s)

表1 两组化疗前后T淋巴细胞亚群及NK细胞参数比较(±s)
注:化疗前后比较,aP<0.05;化疗后与对照组比较,bP<0.05
n组别治疗组30对照组30时间化疗前化疗后化疗前化疗后CD4+ 39.41±6.99 46.92±8.41a、b 40.03±6.63 33.71±7.14 CD8+ 32.09±7.60 30.30±7.46a、b 31.64±4.56 34.23±6.11 CD4+/CD8+ 1.05±0.29 1.50±0.39a、b 1.06±0.22 0.80±0.13 CD56+ 16.43±3.74 20.55±4.43a、b 17.69±5.46 13.44±4.42
2.3生活质量治疗组14例生活质量得到改善,对照组有6例(P<0.05)。见表2。
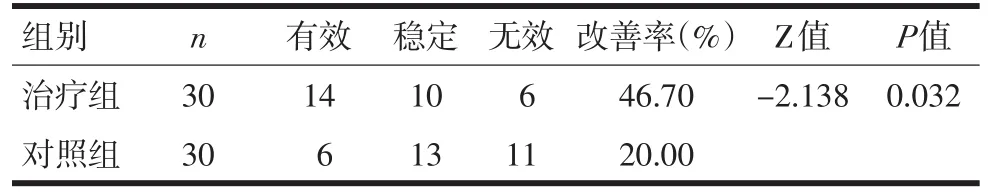
表2 两组KPS评分疗效比较(秩和检验)
2.4血常规变化两组化疗前血常规RBC、Hb、WBC、PLT差异无统计学意义(P>0.05)。与化疗前相比,治疗组化疗后血常规RBC、Hb、WBC、PLT差异无统计学意义(P>0.05);对照组化疗后血常规RBC、Hb、WBC、PLT与化疗前相比均明显下降(P<0.05)。两组化疗后血常规RBC、Hb、WBC、PLT相比差异有统计学意义(P<0.05)。对照组8例因白细胞低于3.0×109/L而使用促进白细胞增加的药物,治疗组1例。见表3。
表3 两组化疗前后血常规参数比较(±s)

表3 两组化疗前后血常规参数比较(±s)
注:化疗后与对照组比较,aP<0.05;化疗前后比较,bP<0.05
组别治疗组30 n RBC (×1012/L) WBC (×109/L) PLT (×109/L)对照组30时间化疗前化疗后化疗前化疗后4.46±0.47 4.33±0.44a4.39±0.48 3.84±0.45bHB(g/L) 127±18 123±12a128±17 108±17b5.59±1.35 5.56±0.91a5.65±0.74 3.94±0.58b222±50 207±35a227±48 187±45b
2.5不良反应治疗组5例出现皮疹,发生率为16.7%,明显高于对照组;乏力、食欲减退、腹泻、恶心呕吐的发生率明显低于对照组(P<0.05)。见表4。

表4 两组不良反应发生情况比较(n,%)
3 讨论
T淋巴细胞亚群是机体细胞免疫中最主要的细胞群[2]。按CD表型可分成CD3+、CD4+、CD8+三类,各亚群间的动态平衡维持着机体正常的免疫应答。CD3+细胞是全T细胞标志,CD4+T细胞是诱导/辅助性T细胞(Th)前体,可分化为Th1、Th2和Th17三类细胞,通过调节免疫反应,辅助B细胞产生抗体,发挥杀伤肿瘤细胞的作用。CD8+T细胞是细胞毒性/抑制性T细胞(Tc)前体,通过细胞介导的细胞毒作用特异性攻击靶细胞,抑制免疫反应[3]。而CD56+细胞为NK细胞,可直接杀伤某些肿瘤细胞和病毒感染的细胞,具有免疫监视作用,是抗击肿瘤发生的第一道防线。活化NK细胞可分泌IFN-γ和TNF-α等细胞因子,参与免疫调节。
研究表明,细胞免疫在抗肿瘤免疫中发挥着极其重要的作用。肿瘤患者普遍存在免疫功能低下,不仅表现为免疫细胞数目减少[4],还存在CD4+/CD8+比例失调[5]。恶性肿瘤的发生可能与机体免疫力异常有关,当T细胞亚群比例失调,如CD4+细胞减少而CD8+增多导致的CD4+/CD8+比率下降时,肿瘤细胞可逃脱宿主的免疫监控,生长失去控制,有利于它的转移甚至复发[6]。大量研究表明,化疗也有一定的免疫抑制作用。化疗后机体CD3+、CD4+较前下降,CD4+/CD8+比例进一步失调。说明化疗在杀伤肿瘤细胞及缓解由肿瘤细胞导致的免疫抑制的同时[7],对免疫系统也进行非特异性攻击[8]。因此,如何降低化疗对机体的损害,保护和调节机体免疫力,提高患者生存质量成为恶性肿瘤化疗中的重要课题之一。
中西医结合疗法目前已成为治疗肿瘤的常规手段,诸如香菇多糖、康艾注射液、华蟾素、斑蝥胶囊等中药可与化疗、放疗、手术相结合,在益气扶正、保护骨髓、提高机体免疫力、改善生活质量等方面疗效确切,成为近年研究的热点。牛樟芝素有“药芝之王”、“台湾森林中的红宝石”之美称,仅生长于台湾山区特有树种牛樟木上,数量稀少,生长缓慢,极其珍贵。近年来,研究人员发现[9],牛樟芝的主要活性成分为多糖体、三萜类、超氧歧化酶、核酸类等,具有解毒保肝、强化免疫、抗肿瘤等功能[10]。牛樟芝中的多糖体主要为β-D-葡聚糖,其最主要功能为增强机体免疫活性。Liu等人发现,牛樟芝中的多糖成分可诱导IL-2、IL-6、TNF-α生成,提高辅助性T淋巴细胞及NK细胞的比例,增强免疫功能,进而达到抗肿瘤效果[11]。其次,研究发现,多糖体也可通过抑制活性氧系产物的生成而调节中性粒细胞的数量,起到刺激骨髓造血的作用[12]。三萜类化合物是樟芝中最重要的化学成分,主要具有修复肝脏、抑制肿瘤细胞、双向调节免疫等作用。2004年,Nakamura等[13]人从樟芝中分离出2种新的马来酸和琥珀酸衍生物,其对刘易斯肺癌细胞有明显的细胞毒作用。最近,研究人员从樟芝菌丝体中分离到1种泛醌衍生物,命名为Antroquinonol,并发现Antroquinonol对人类乳癌细胞株、肝癌细胞株及前列腺癌细胞株均有杀伤作用,这为开发新型抗肿瘤药物提供了依据[14]。此外,牛樟芝对于肿瘤晚期患者常见的乏力、剧烈疼痛、食欲不振等症状,也有一定的改善作用[1]。
本研究使用牛樟芝联合化疗与单纯化疗对比,重点观察了患者免疫功能、生活质量、血常规及化疗不良反应的变化。结果表明,与化疗前相比,治疗组化疗后CD4+、CD4+/CD8+、CD56+均显著升高,差异有统计学意义(P<0.05),而CD8+无明显变化(P>0.05)。对照组化疗后CD4+、CD4+/CD8+、CD56+明显降低,CD8+明显升高,差异有统计学意义(P<0.05)。这说明牛樟芝确有提高肿瘤患者细胞免疫,维持免疫系统稳定作用。单纯化疗组化疗后CD4+/CD8+比值及NK细胞较化疗前降低,也说明化疗对免疫系统有一定抑制作用,与一些研究相符[15]。其次,与化疗前相比,治疗组化疗后血常规(红细胞、血红蛋白、白细胞、血小板)未见明显下降(P>0.05),而对照组化疗后血常规明显下降(P<0.05)。两组化疗后血常规相比,对照组血常规较治疗组明显降低(P<0.05)。由此推断,牛樟芝亦具一定稳定血常规,保护骨髓造血的作用。此外,在化疗毒副反应方面,牛樟芝也可减少乏力、厌食、恶心呕吐及腹泻的发生,使患者更好的耐受化疗。牛樟芝能纠正化疗对机体免疫系统的抑制作用,提高细胞免疫功能,保护骨髓,降低化疗毒副反应,从而改善患者生活质量。
[1]Yue PY,Wong YY,Chan TY,et al.Review of biological and phar⁃ macological activities of the endemic Taiwanese bitter medicinal mushroom,Antrodia camphorata(M.Zang et C.H.Su)Sh.H.Wu et al.(higher Basidiomycetes)[J].Int J Med Mushrooms,2012,14 (3):241-256.
[2]Salsman VS,Chow KK,Shaffer DR,et al.Crosstalk between me⁃dulloblastoma cells and endothelium triggers a strong chemotactic signal recruiting T lymphocytes to the tumor microenvironment[J]. PLoS One,2011,6(5):e20267.
[3]Bantug GR,Cekinovic D,Bradford R,et al.CD8+T lymphocytes control murine cytomegalovirus replication in the central nervous system of newborn animals[J].J Immunol,2008,181(3):2111-2123.
[4]亢澜涛,张桂荣.411例恶性肿瘤患者T细胞亚群的检测分析[J].实用肿瘤学杂志,2007,21(4):362-365.
[5]齐红,石虹,刘玉侠,等.253例恶性肿瘤患者外周血T细胞亚群的检测及其临床意义分析 [J].中国实验诊断学,2009,13(11): 1589-1590.
[6]Des Guetz G,Uzzan B,Nicolas P,et al.Microvessel density and VEGF expression are prognostic factors in colorectal cancer.Me⁃ta-analysisoftheliterature[J].BrJCancer,2006,94(12): 1823-1832.
[7]Caserta S,Alessi P,Guarnerio J,et al.Synthetic CD4+T cell-tar⁃geted antigen-presenting cells elicit protective antitumor responses [J].Cancer Res,2008,68(8):3010-3018.
[8]Bonertz A,Weitz J,Pietsch DH,et al.Antigen-specific Tregs con⁃trol T cell responses against a limited repertoire of tumor antigens in patients with colorectal carcinoma[J].J Clin Invest,2009,119 (11):3311-3321.
[9]Huang Y,Lin X,Qiao X,et al.Antcamphins A-L,ergostanoids from Antrodia camphorata[J].J Nat Prod,2014,77(1):118-124.
[10]Wang SC,Lee TH,Hsu CH,et al.Antroquinonol D,isolated from Antrodia camphorata,with DNA demethylation and anticancer po⁃tential[J].J Agric Food Chem,2014,62(24):5625-5635.
[11]Liu JJ,Huang TS,Hsu ML,et al.Antitumor effects of the partially purified polysaccharides from Antrodia camphorata and the mecha⁃nism of its action[J].Toxicol Appl Pharmacol,2004,201(2): 186-193.
[12]Kuo MC,Chang CY,Cheng TL,et al.Immunomodulatory effect of Antrodia camphorata mycelia and culture filtrate[J].J Ethnophar⁃macol,2008,120(2):196-203.
[13]Nakamura N,Hirakawa A,Gao JJ,et al.Five new maleic and suc⁃cinic acid derivatives from the mycelium of Antrodia camphorata and their cytotoxic effects on LLC tumor cell line[J].J Nat Prod, 2004,67(1):46-48.
[14]Ho CL,Wang JL,Lee CC,et al.Antroquinonol blocks Ras and Rho signaling via the inhibition of protein isoprenyltransferase ac⁃tivityincancercells[J].BiomedPharmacother,2014,68(8): 1007-1014.
[15]夏俊贤,朱美琴,陈敬华,等.化疗联合乌苯美司对恶性肿瘤患者免疫功能的影响[J].肿瘤,2013,33(4):382-384.
(收稿:2015-06-18修回:2015-08-18)
(责任编辑王 丰屈振亮)
Effect of Antrodia Camphorata combined with Chemotherapy on ImmunologicFunction in Patients with Malignant Tumors
SHAN Li-zhu,SONG Teng,WANG Hua-qing.Department of Lymphoma,Tianjin Medical University Cancer Institute and Hospital,Tianjin(300060),China
ObjectiveTo evaluate the effect and side effect of Antrodia Camphorata combined with chemo⁃therapy on immunologic function in patients with malignant tumors.MethodsSixty cases of cancer patients were randomly divided into treatment group(n=30)and control group(n=30).The cases in treatment group were treated with Antrodia Camphorata combined with chemotherapy,while control group cant difference was found in the blood cell count after chemotherapy(P>0.05).In control group,however,the patients'blood cell count decreased after chemotherapy(P<0.05).The rate of side effects was lower in the treat⁃ment group(P<0.05).ConclusionAntrodia Camphorata can improve patients’quality of life and immu⁃nity function and reduce the adverse reactions of chemotherapy when used as adjuvant chemotherapy of cancer patients.
chemotherapy only. The activity of T cells and NK cells were examined in both groups after treatment,the toxic effects and patients’ quality of life were also observed.ResultsCom⁃pared with control group,the level of CD4 and CD56 and the CD4/CD8 ratio were all improved in treat⁃ment group after chemotherapy(33.71±7.14 vs 46.92± 8.41,13.44±4.42 vs 20.55±4.43,and 0.80±0.13 vs 1.50±0.39,P<0.05).In treatment group,no signifi⁃
Antrodia Camphorata;chemotherapy;malignant tumors;immune function
R730.52
A
1007-6948(2015)06-0552-04
10.3969/j.issn.1007-6948.2015.06.002
1.天津医科大学肿瘤医院淋巴瘤内科,中美淋巴血液肿瘤诊治中心,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津 300060)
2.天津市人民医院肿瘤中心(天津 300121)
3.天津市南开医院肿瘤内科(天津 300100)
王华庆,E-mail:Huaqingw@163.com

