月月桂AACT基因的cDNA全长克隆及生物信息学分析
郑玉娟,周文化,张党权,陈丽莉,陈 容,龚建平
(1.中南林业科技大学 林业生物技术湖南省重点实验室,湖南 长沙 41004;2.稻谷及副产物深加工国家工程实验室,湖南 长沙 410004;3.湖南澧县树大园林有限公司,湖南 澧县 415513)
月月桂AACT基因的cDNA全长克隆及生物信息学分析
郑玉娟1,2,周文化2,张党权1,陈丽莉1,陈 容1,龚建平3
(1.中南林业科技大学 林业生物技术湖南省重点实验室,湖南 长沙 41004;2.稻谷及副产物深加工国家工程实验室,湖南 长沙 410004;3.湖南澧县树大园林有限公司,湖南 澧县 415513)
为了克隆分离月月桂AACT(乙酰辅酶A 酰基转移酶)全长基因,并研究其基因特征和蛋白结构,以月月桂花瓣RNA为模板,通过反转录PCR及RACCE技术分离克隆AACT全长。再利用NCBI网站及生物信息学软件对其碱基分布、氨基酸组成、亲疏水性、二级结构、保守区及三级结构进行预测和分析,并对10个物种的AACT氨基酸进行多重比对,对基因进行进化分析。分离克隆出AACT基因的cDNA序列长为1580bp,编码405个氨基酸,该蛋白质相对分子质量为41347.89D,等电点为5.66,其中Ala含量最高为14.53%,平均疏水值为0.215,属Cond-enzymes超家族。氨基酸序列比对中,胡黄连、假马齿苋氨基酸序列同源性最高。OsAACT基因稳定,编码的蛋白为疏水性蛋白,其在进化过程中相对保守。试验获得的基因信息为萜类物质合成途径进一步研究奠定基础。
月月桂;乙酰辅酶A 酰基转移酶;全长cDNA克隆;生物信息学分析
月月桂,子房发育正常的四季桂Osmanthus.fragranscv. Semperf l orens Hort,木犀科木犀属,主产于我国江苏、河南、湖南、广西等省份[1-2],是优良的绿化观赏植物。月月桂花期长,花淡黄色,微芳香[2-4]。月月桂花香具有宁心静心,缓解疲劳、头痛的功效,且能抗菌消炎、止咳平喘,对治疗支气管炎有益。
萜类物质是主要的香气成分[5-7],其合成途径主要包括甲羟戊酸(MVA)途径和2-甲基赤藓糖醇-4-磷酸(MEP)途径[8]。乙酰辅酶A酰基转移酶(acetyl-CoA C-acetyltransferase, AACT),是细胞质MVA途径中合成IPP和DMAPP的关键调控酶,催化MVA途径的第一个酶促反应[9]。AACT又称乙酰乙酰辅酶A硫解酶(Thiolase Ⅱ),属于酰基辅酶A代谢酶超家族中的硫解酶(thiolase)家族[10-12]。AACT主要催化2个乙酰辅酶A浓缩形成多个代谢生物合成的起始分子-乙酰乙酰辅酶A。反应机制是:一个乙酰辅酶A释放CoASH与第二个乙酰辅酶A分子结合,形成酰基酶复合物;乙酰硫脂键断裂,乙酰乙酰辅酶A形成[12-13]。AACT主要位于胞质和线粒体中。目前,已从拟南芥、萝卜、向日葵、橡胶、假马齿苋、苜蓿、油茶、鼠尾草等物种中寻找到AACT的同源基因[10]。Sando等发现在酵母异源性系统中,橡胶AACT(HbAACT)的表达能促进酵母生长[14];Soto等提出在高盐环境下,AACT能够促进鲨烯的合成[15];AACT的过表达还能提高假马齿苋的抗逆性[10]。因此,AACT在不同物种之间展示出功能多样性。本研究拟通过RACE技术克隆月月桂AACT(OsAACT)的全长cDNA,并进行生物信息学分析,为揭示桂花花香成分合成规律提供理论基础。
1 材料与方法
1.1 材料
2013年9月中旬,在中南林业科技大学校园内采集月月桂花瓣。采集的样品清洗后,于-80 ℃超低温冰箱中保存备用。
1.2 引物设计
分析NCBI中已知其他物种AACT基因序列的特点,依据保守DNA序列,设计RT-PCR同源克隆引物;基于同源克隆片段测序结果,设计相应的 3’-RACE 与 5’-RACE 引物。
1.3 实验方法
(1)月月桂花瓣总RNA提取。采用改良的CTAB法/植物RNA试剂盒(Omega)结合法提取和纯化总RNA。
(2)OsAACT基因保守片段的RT-PCR克隆。
使用Invitrogen ThermoScript Kit合成cDNA第一链。以此为模板,使用引物AACT-F/ AACT-R及Takara Pyrobest酶进行PCR扩增。程序为:预变性(94 ℃,5 min);变性(94℃,30 s)、退火(58 ℃,45 s),延伸(72 ℃,1 min),30个循环;总延伸(72 ℃,10 min)。纯化回收目的片段,连接至pMD18-T载体,转化大肠杆菌DH5α菌株,挑选阳性克隆进行双向DNA测序。

表1 月月桂OsAACT基因克隆引物Table 1 Primers used for gene cloning of Osmanthus OsAACT
(3)3’-RACE扩增。使用SuperScriptTM II逆转录酶和包含oligo(dT)的Adapter Primer(AP)锚定引物合成cDNA第一链,再使用AACT3’gsp2/AACT3’gsp3引物分别与通用引物AUAP进行巢式PCR扩增,获得目的基因cDNA 3’端序列。PCR扩增程序:预变性(94 ℃,5 min);变性(94 ℃,30 s)、退火(56 ℃,45 s),延伸(72 ℃,1 min),35个循环;总延伸(72 ℃,10 min)。
(4)5’-RACE扩增。OligdT反转录后,按照Invitrogen RACE KIT说明书操作步骤,使用AACT5’gsp1和AAP引物合成cDNA第一链,再使用AACT5’gsp2/AACT5’gsp3引物分别与通用引物AUAP进行巢式PCR扩增,获得目的基因5’端序列。PCR扩增程序:预变性(94 ℃,5 min);变性(94 ℃,30 s)、退火(54 ℃,45 s),延伸(72 ℃,1 min),35个循环;总延伸(72 ℃,10 min)。
(5)生物信息学分析。使用ContigExpress对DNA测序结果进行拼接获得完整序列,再通过 BLAST(http://www.ncbi.nlm.nih.gov)进 行 序列比对。利用ExPASy ProtParam (http://cn.Expasy.org)程序与ScanProsite程序对月月桂AACT氨基酸残基数目、氨基酸残基组成比例、基因编码蛋白质的分子量、理论等电点及亲疏水性等性质进行预测和分析;利用SOPMA和GOR4程序预测月月桂AACT蛋白质的二级结构;利用Swissmodel(http://swissmodel.expasy.org/)程序,根据基因氨基酸序列,在PBD(Protein data bank, http://www.rcsb.org/pdb/home.do)数据库搜索相似序列,采用alignment mode进行同源建模,预测OsAACT蛋白的三级结构;采用Clustal 2.0进行多序列匹配,使用Mega 5.0软件的neighbor-joining(Kimura2-parameter)方法构建AACT基因系统发育树。
2 结果与分析
2.1 月月桂AACT基因全长cDNA的扩增
以月月桂花瓣的cDNA为模板,AACT-F和AACT-R为引物,扩增出一条749 bp的特异性片段,将此片段胶回收、转化、测序,进行NCBI Blast比对分析,确定为月月桂AACT基因的保守片段;在此基础上,利用特异性引物分别进行3’-RACE和5’-RACE,获得月月桂AACT基因的3’端和5’端cDNA特异性片段(图1)。将其回收、转化、测序,经NCBI Blast比对分析确定为月月桂AACT的cDNA条带。将上述3条月月桂AACT基因特异片段序列进行拼接,获得了1条1580 bp的月月桂AACT全长cDNA序列。
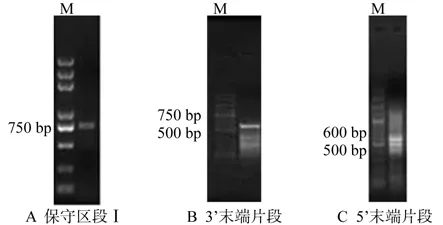
图1 OsAACT基因RT-PCR扩增的琼脂糖凝胶电泳Fig.1 Agrose gel electrophoresis of RT-PCR amplif i cation of OsAACT
2.2 月月桂AACT的序列分析
通过BioEdit软件分析发现,月月桂AACT的cDNA序列长为1 580 bp,开放阅读框(open reading frame,ORF)在80~1 297 bp之间(图2)。月月桂AACT的cDNA共编码405个氨基酸;A+T含量较高,为55.76%;G+C含量较少为44.24%。

图2 月月桂AACT全长cDNA及推导的氨基酸序列Fig.2 Full-length sequence of OsAACT cDNA and the deduced amino acid sequences
OsAACT氨基酸序列与假马齿苋Bacopa monnieri(ACU875602)、 碧 桃Prunus persica(XP-007215468.1)、 烟 草Nicotiana tabacum(AAU95618.1)、 油 茶Camellia oleifera(ADD10719.1)、 长 春 花Catharanthus roseus(AEC13714.1)、浙江红山茶Camellia chekiangoleosa(AGH32909.1)、 可 可Theobromacacao(XP-007049378.1)、 胡 黄 连Picrorohiza(ABC74567.1)、 橡 胶Hevea brasiliensis(BAF98276.1)、 罗 汉 果Siraitia grosvenorii(AEM42969.1)的AACT氨基酸序列相似性分别为 91%、87%、87%、89%、87%、89%、88%、90%、86%、86%。由图3可知,AACT基因相对保守性,OsAACT与BmAACT/PhAACT 同源性较高,保守区集中在尾部和中上游。N端的变异性比较大,在中部也存在差异较大的区段,这些区段可能为基因进化提供一些参考依据。
由图4进化树分析可知,月月桂与胡黄连、假马齿苋的亲缘性最近,其次是长春花与烟草,与罗汉果的亲缘性最远。

图3 月月桂AACT氨基酸序列的多重比对Fig.3 Multiple alignment of full length amino acid sequences of OsAACT

图4 月月桂AACT同源基因系统进化树分析Fig.4 Phylogenetic analysis of AACT homologous genes
2.3 月月桂AACT的蛋白质结构分析
月月桂AACT基因编码的蛋白质中共有20种氨基酸,共计405个氨基酸,相对分子质量为41 347.89 D,等电点为5.66;蛋白质不稳定系数为29.70,属于稳定蛋白,可靠性为3级。氨基酸含量最高的为Ala,为14.53 %;Gly、Leu、Val也较多,分别为12.07 %、9.85 %、9.61 %;含量最低的是Trp,为0.49 %。N端第一个氨基酸为Met。此蛋白的脂溶系数为100.27,疏水性平均值为0.215。采用Expasy Protscale程序详细分析此编码蛋白的疏水/亲水性,蛋白质残基中分别A374疏水性最强(2.989),A186亲水性最强(-2.467),亲水氨基酸的数量远远少于疏水氨基酸,因此推断OsAACT蛋白为疏水性蛋白(见图5)。
利用SOPMA和GOR4程序预测OsAACT二级结构(图6):该蛋白由46.91 %的α-螺旋、16.79 %的延伸链、14.07 %的b-转角及22.22 %的无规则卷曲组成。α-螺旋是OsAACT中最多的结构元件,属于混合型结构的蛋白质。CCD分析保守结构域可知(见图7),OsAACT基因编码的蛋白为多结构域蛋白,属于Cond-enzymes超家族。
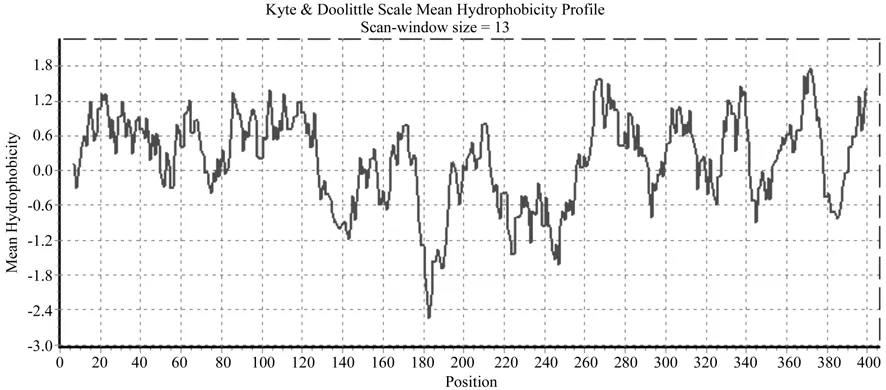
图5 月月桂AACT蛋白的亲水/疏水性预测Fig.5 Predictions of hydrophobicity and rophilicity of OsAACT proteins

图6 月月桂AACT蛋白二级结构预测Fig.6 Prediction of secondary structure of the deduced OsAACT protein

图7 月月桂AACT蛋白的保守结构域预测Fig.7 Prediction of conserved domains of the deduced OsAACT protein
以人线粒体乙酰CoA硫解酶 (2f2s.1.A)为模板,利用Swiss-Model对AACT蛋白同源建模(见图8),推导的蛋白模型QMEAN4得分为0.76,与模板蛋白序列的相似性为52.47%
3 讨 论
本研究通过RT-PCR同源克隆、3’-RACE、5’-RACE技术获得月月桂AACT的全长cDNA序列,生物信息学分析结果表明,月月桂AACT开放阅读框在80~1 297 bp之间,共编码405个氨基酸,相对分子质量为41 347.89 D,等电点为5.66,为疏水性稳定蛋白,属Cond-enzymes超家族。氨基酸序列比对和进化树分析都可以发现,AACT的保守性高。

图8 月月桂AACT推导的蛋白三级结构Fig.8 Prediction of tertiary structure of the deduced OsAACT protein
AACT为动物、植物、酵母和真菌中膜甾醇的生物合成提供中间物。在真菌中合成聚3-羟丁酸化合物等碳化合物和能源储存化合物。而且乙酰辅酶A酰基转移妹能够催化动物肝脏中酮体的生物合成,参与肝外组织酮体的降解。目前,关于AACT的研究主要倾向于二级代谢积累和非生物抗逆性,但其在植物中类异戊二烯生物合成的作用不是很清楚。拟南芥、鼠尾草、苜蓿属等物种类异戊二烯合成途径的报道表明,AACT具有重要的生物学功能,且呈现出多样性。因此,AACT的基因研究具有很大的科学价值。本研究结果为下一步开展AACT基因在桂花萜类合成途径中的调控规律研究提供基础。
[1] 刘玉莲. 桂花品种分类及木犀属种质资源的利用[J]. 植物资源与环境, 1993, 2(2): 44-48.
[2] 汤庚国. 中国桂花资源及其利用与开发( 下) [J]. 资源节约和综合利用, 1994, 9(4): 22-26.
[3] 陈志远, 陈红林, 周必成. 常用绿化树种苗木繁育技术[M].金盾出版社, 2010, 1(1):144-157.
[4] 刘玉莲. 南京地区桂花栽培品种调查研究[J]. 南京林学院学报, 1985, 1(1): 30-37.
[5] 孙宝军, 李 黎, 韩远记, 等. 上海桂林公园桂花芳香成分的HS-SPME-GC-MS分析[J]. 福建林学院学报,2012,32(1):39-42.
[6] 陈虹霞, 王成章, 孙 燕. 不同品种桂花挥发油成分的GC-MS分析[J]. 生物质化学工程, 2012, 46(4): 37-41.
[7] 林富平, 马 楠, 周 帅,等. 4个桂花品种鲜花挥发物成分TDS-GC-MS分析[J]. 内蒙古农业大学学报, 2012,33(2):47-51.
[8] 占爱瑶, 由香玲, 詹亚光. 植物萜类化合物的生物合成及应用[J]. 生物技术通, 2010, 21(1): 131-134.
[9] 崔光红, 王学勇, 冯 华, 等. 丹参乙酰CoA酰基转移酶基因全长克隆和SNP分析[J]. 药学学报, 2010, 45(6): 785-790.
[10] Rishi K. Vishwakarma,et al. Molecular Cloning, Biochemical Characterization, and Differential Expression of an Acetyl-CoA C-Acetyltransferase Gene(AACT) of Brahmi (Bacopa monniera)[J]. Plant Molecular Biology Reporter, 2013, 31(3): 547-557.
[11] StimHerndon KP,et al.Characterization of an acetyl-CoA C-acetyltransferase (thiolase) gene from Clostridium acetobutylicum ATCC824[J]. Gene, 1995, 154(1): 81-85.
[12] Lange BM,et al. Isoprenoid biosynthesis: The evolution of two ancient and distinct pathways across genomes[J]. Proc Natl Acad Sci U S A, 2000, 97(24): 13172-13177.
[13] Peoples, OP,et al. Biosynthetic thiolase from Zoogloea ramigera.III. Isolation and characterization of the structural gen[J]. The Journal of Biological Chemistry, 1987, 262(1): 97-102.
[14] Sando T,et al.Cloning and characterization of mevalonate pathway genes in a natural rubber producing plant, Hevea brasiliensis[J]. Bioscience, Biotechnology and Biochemistry,2008, 72(8): 2049-2060.
[15] Gabriela Soto,et al.Acetoacetyl-CoA thiolase regulates the mevalonate pathway during abiotic stress adaptation[J]. Journal of Experimental Botany, 2011, 62(15): 5699-5711.
[16] 张 琳, 谭晓风, 胡 姣, 等. 油茶乙酰CoA酰基转移酶基因cDNA克隆及序列特征分析[J]. 中南林业科技大学学报,2011, 31(8): 108-112.
[17] 谷振军, 章怀云, 张党权, 等. 赤桉CCoAOMT亚家族的基因克隆及可变剪切分析[J]. 林业科学, 2014, 50(5): 62-69.
[18] 刘攀峰, 吴 敏, 等. 杜仲IPI基因全长cDNA克隆与生物信息学分析[J]. 经济林研究, 2014, 32(1): 27-33.
[19] Hiremath Shiv T, Balasubramanian Sujata, Zheng Junet al. Symbiosis-regulated expression of an acetyl-CoA acetyltransferase gene in the ectomycorrhizal fungus Laccaria bicolor[J]. Canadian Journal of Botany, 2006, 84(9): 1405-1416.
Full length cloning and bioinformatics analysis of Acetyl-CoA C-acetyltransferase gene inOsmanthus fragrans
ZHENG Yu-juan1,2, ZHOU Wen-hua2, ZHANG Dang-quan1, CHEN Li-li1, CHEN Rong1, GONG Jian-ping3
(1. Human Provincial Key Lab. of Forestry Biotechnology, Central South University of Forestry and Technology, Changsha 410004,Hunan, China; 2. National Engineering Lab. for Rice and Byproducts Processing, Changsha 410004, Hunan, China; 3.Hunan Lixian Shuda Garden Co. Ltd., Lixian 415513, Hunan, China)
In order to clone and separate the gene of AACT inOsmanthus frangtans, and to study its genetic characteristics and protein structure, by taking RNA inO. frangransfl ower as template, AACT gene was isolated from fl owers ofO. frangransby the method of reverse transcription polymerase chain reaction (RT-PCR) and the rapid amplification of cDNA ends(RACE) technique. NCBI website and bio-informatics software were used to predict and analyze base distribution, amino acids composition, hydrophilicity or hydrophobicity, hyper-conservative region, secondary structure, and three-level structure. The results were used to compare with AACT amino acid sequences of other ten species and the related evolution analysis was conducted. The single chain of AACT gene was 1580 bp, code was made up of proteins containing amino acid of 405, and relative molecular mass of protein was 41 347.89 with Aar of 14.53.The isoelectric point was 5.66, and grand average of hydropathicity was 0.215. It belonged to the cond-enzymes superfamily. After many comparisons with other ten species, the amino acid sequences ofPicrorohizaandBacopa monnieriwere the highest. The gene of OsAACT was stable and coded albume was hydrophobic protein which was quite conservative in evolution. The information of gene gained in the test paved the way for the further study on synthetic of the terpenoid substances.
Osmanthus frangtans; Acetyl-CoA C-acetyltransferase; full length cDNA cloning; bioinformatics analysis
S759.95;Q781
A
1673-923X(2015)06-0087-06
10.14067/j.cnki.1673-923x.2015.06.016
2014-09-22
国家林业公益性行业科研专项(201204610);湖南省科技计划重点项目(2014FJ2004);湖南省教育厅一般项目(13C1168)
郑玉娟,硕士研究生 通讯作者:张党权,教授,博士生导师;E-mail:zhangdangquan@163.com
郑玉娟,周文化,张党权,等. 月月桂AACT基因的cDNA全长克隆及生物信息学分析[J].中南林业科技大学学报, 2015,35(6): 87-92.
[本文编校:吴 彬]

