丙泊酚对神经元缺血再灌注损伤的保护与磷酸化蛋白激酶信号通路的关系
周国强,巩晓洁,傅 蕊,周晓东
丙泊酚对神经元缺血再灌注损伤的保护与磷酸化蛋白激酶信号通路的关系
周国强,巩晓洁,傅蕊,周晓东
目的:探讨丙泊酚在脑缺血/再灌注损伤(CI/RI)中的作用及可能机制。方法:采用氧糖剥夺再灌注(OGD/RP)法体外构建缺血/再灌注细胞模型,将细胞分为对照组、OGD/RP组和丙泊酚+OGD/RP联合组。采用MTT法检测皮质神经元存活率,Annexin V-PI检测细胞凋亡情况,RT-PCR方法检测碱性成纤维细胞生长因子(bFGF)的mRNA表达,Western blot检测丙泊酚对皮质神经元内bFGF、磷酸化蛋白激酶B(pPKB)和磷酸化细胞外信号调节激酶1/2(pERK1/2)表达。采用小干扰RNA构建bFGF沉默的细胞。结果:丙泊酚能够显著促进CI/RI后神经元的存活,抑制其凋亡,OGD/RP处理组神经元凋亡率为43.2%,以10 mg/L的丙泊酚预处理后细胞的凋亡率即降为19.5%(P<0.05)。与对照组(1.02±0.03)相比较,OGD处理后细胞中bFGF的含量(0.78±0.06)显著下调(P<0.05),丙泊酚处理的皮质神经元中bFGF含量(1.43±0.04)显著高于OGD处理组(P<0.05)。沉默的bFGF或者施加蛋白激酶B(PI3K-pPKB)以及pERK1/2信号通路抑制剂都会导致细胞存活率显著下降(P<0.05),抑制PI3K-pPKB以及ERK1/2的激活。结论:丙泊酚可以通过上调bFGF的表达,激活PI3K-pPKB和ERK1/2的信号通路,减轻体外培养神经元凋亡/再灌注损伤,从而增加皮质神经元的存活。
丙泊酚;脑缺血/再灌注损伤;碱性成纤维细胞生长因子;磷酸肌醇3激酶-蛋白激酶B;磷酸化细胞外信号调节激酶1/2
脑缺血/再灌注损伤(cerebral ischemia/reperfusion injury,CI/RI)会诱导神经元凋亡,抑制神经元凋亡的分子和药物有可能发挥神经保护作用[1]。碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)能够促进神经元的存活,抑制神经元凋亡[2]。在CI/RI模型中激活磷酸肌醇3激酶-蛋白激酶B (phosphotylinosital 3 kinase-protein kinase B,PI3K-pPKB)信号通路和细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)信号通路[3-4]减少神经元的凋亡和损伤与bFGF有关。有研究报道,丙泊酚在神经系统再灌注损伤中都能够发挥较强的保护作用[3,5],但具体机制还不是很清楚。本文采用体外缺血/再灌注模型,旨在探讨丙泊酚对皮质神经元存活和凋亡的影响及其发挥作用的具体机制。
1 材料与方法
1.1主要试剂丙泊酚购于西安力邦制药有限公司;胎牛血清、DMEM/F12、甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethylsulfoxide,DMSO)和胰蛋白酶购于Sigma(美国);bFGF抗体,Akt抗体,p-Akt(Ser473)抗体,ERK1/2抗体,pERK1/2(Thr202/Tyr204)抗体,β-肌动蛋白(β-actin)抗体,辣根过氧化物酶标记的免疫球蛋白G(HRP-IgG)购于Santa Cruz:Biotechnology(美国);RIPA细胞蛋白裂解液购于上海科致生物科技有限公司;BCA总蛋白定量试剂盒购于Thermo Scientific(美国);Annexin V-FITC凋亡检测试剂盒购于Invitrogen(美国)。
1.2实验动物雄性SD大鼠购于新疆医科大学实验动物中心,体质量210~240 g。饲养过程中昼夜周期12 h,自由饮水及摄食。对SD大鼠的各种处理完全符合动物伦理学标准,并获得动物伦理学会批准。
1.3原代皮质神经元分离培养参照文献的方法分离培养大鼠皮质神经元[6]。新生SD大鼠(1~3 d),采用氟烷麻醉,以颈椎脱臼法处死,分离皮质,D-Hank's液清洗,剪成1 mm3的小块,加入0.125%的胰蛋白酶于37℃下消化30 min。细胞悬液于3 000×g离心10 min(离心半径20 cm),弃上清液,细胞沉淀重悬于含20%胎牛血清,置于100 mg/L链霉素和100 kU/L青霉素的DMEM/F12培养基中。显微镜观察,计数板计数,调整细胞密度至1×106/mL,接种于预先涂有10 mg/L多聚-l-赖氨酸的96孔板,置CO2培养箱中培养。72 h后向细胞培养液中加入5 mg/L阿糖胞苷抑制非神经元的生长。24 h后,将培养液更换为普通培养基,并且每2~3 d更换1次。
1.4氧糖剥夺再灌注(OGD/RP)模型构建依据文献的方法进行OGD/RP模型制备[6-7]。取原代培养的皮层神经元进行氧糖剥夺损伤,PBS冲洗细胞2次,加入无糖Earle′s液116.4 mmol/L NaCl、5.4 mmol/L KCl、1.8 mmol/L CaCl2、0.8 mmol/L MgSO4、2.6 mmol/ LNaH2PO4、26.2mmol/LNaHCO3、20.1mmol/L HEPES(pH 7.4),置于CO2培养箱(37℃、5%CO2、95%N2)内孵育2 h。细胞中加入含有5.6 mmol/L葡萄糖的Earl's液,置于CO2培养箱(5%CO2、95%O2)培养12 h终止氧糖剥夺损伤。
1.5药物处理与分组根据不同的刺激处理,将皮质神经元分为(1)对照组;(2)氧糖剥夺再灌注(OGD/RP)组,采用OGD处理细胞,制备体外缺血/再灌注模型;(3)丙泊酚+OGD/RP组,采用不同浓度的丙泊酚(5、10、20 mg/L)预处理皮质神经元1 h,然后进行OGD/RP处理。
1.6MTT法测定细胞的存活率细胞按每孔1× 105/mL个接种于96孔培养板,培养24 h。每孔加入20μL MTT(5 g/L),37℃孵育4 h,吸弃培养基,加入150μL DMSO,摇床震荡10 min以溶解蓝紫色结晶甲瓒。酶标仪测定490 nm处吸光度值。
1.7Annexin V检测细胞凋亡细胞凋亡采用Annexin V-FITC凋亡检测试剂盒进行检测,具体过程依据操作说明进行。
1.8即时聚合酶链锁反应采用bFGF siRNA(sib-FGF)沉默bFGF在细胞中的表达。bFGF的siRNA序列由上海吉凯基因化学技术有限公司合成。bFGF-siRNA序列如下,上游引物:5′-CGAACTGGGCAGTATAAACTT-3′,下游引物:5′-GTTTATACTGCCCAGTT-CGTT-3′。采用LipofectamineTM 2000将bFGF-siRNA和非特异的对照组siRNA转染入皮质神经元,以未转染的细胞作为对照组。转染24 h后,PBS冲洗细胞3次,加入丙泊酚处理细胞。
1.9Western blot检测蛋白的表达收集皮质神经元,RIPA细胞蛋白裂解液提取细胞总蛋白,BCA法测定蛋白浓度。蛋白样品首先经12%SDS-PAGE(40μg/行)电泳,电转移至PVDF膜。5%脱脂奶粉4℃封闭过夜,一抗孵育2 h,TBST洗涤3次,加入HRP-IgG室温孵育2 h,TBST洗涤,ECL显色,暗室曝光。
1.10siRNA沉默bFGF的表达采用bFGF siRNA(sibFGF)沉默bFGF在细胞中的表达。bFGF的siRNA序列由上海吉凯基因化学技术有限公司合成。bFGF-siRNA序列如下,上游引物:5′-CGAACTGGGCAGTATAAACTT-3′,下游引物:5′-GTTTATACTGCCCAGTT-CGTT-3′。采用LipofectamineTM 2000将bFGF-siRNA和非特异的对照组siRNA转染入皮质神经元,以未转染的细胞作为对照组。转染24 h后,PBS冲洗细胞3次,加入丙泊酚处理细胞。
1.11统计学分析采用SPSS 16.0分析软件进行统计学分析,实验数据以平均值±标准差(±s)表示,组间采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1丙泊酚对皮质神经元增殖的影响与对照组比较,OGD/RP组细胞的存活率显著下降(P<0.05)。而不同浓度的丙泊酚+OGD/RP组(丙泊酚浓度5、10、20 mg/L)处理组与OGD/RP处理组相比较,细胞的存活率都显著增加(P<0.05),其中10 mg/L丙泊酚能够最大程度的上调细胞的存活率,见图1。
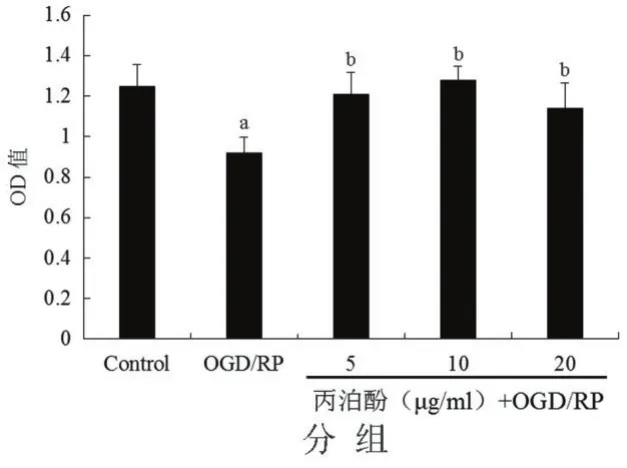
图1 各组细胞活性测定
2.2丙泊酚对皮质神经元凋亡的影响Annexin V-FITC测定细胞凋亡率显示,OGD/RP处理组中大约有43.2%的神经细胞发生凋亡,而在对照组中仅检测到6.1%的凋亡细胞,10 mg/L的丙泊酚预处理后,细胞的凋亡率为19.5%,与OGD/RP组比较明显下降(P<0.05),见图2。
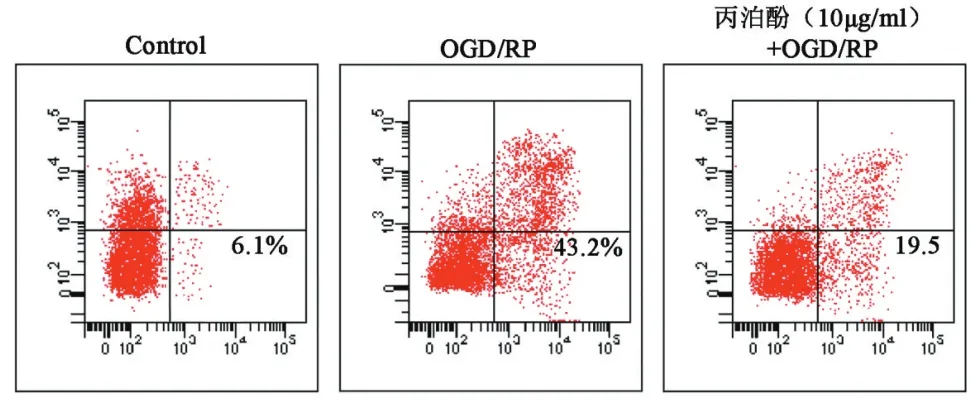
图2 Annexin V检测细胞凋亡
2.3丙泊酚上调bFGF的表达RT-PCR和Western blot检测bFGF mRNA和蛋白的表达情况,与对照组比较,OGD/RP组bFGF mRNA和蛋白含量都显著下降(P<0.05),10 mg/L的丙泊酚预处理后,bFGF mRNA和蛋白含量都有所上调,与OGD/RP组比较差异有统计学意义(P<0.05),见图3。
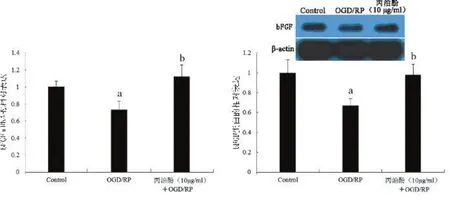
图3 各组皮质神经元中bFGF的表达的影响
2.4沉默bFGF抑制丙泊酚对神经细胞的作用采用siRNA构建bFGF缺失的皮质神经元,RT-PCR检测siRNA干扰后,bFGF在细胞中的表达情况(图4),bFGF的表达显著下降(P<0.05)。bFGF沉默以后,丙泊酚预处理对皮质神经元I/RI的影响,如图5所示,bFGF沉默以后,10 mg/L的丙泊酚对神经元的存活率的影响显著下降(P<0.05)。
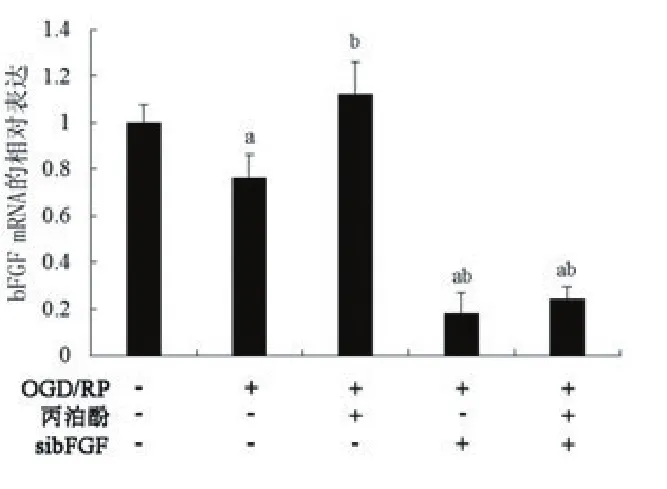
图4各组bFGF的mRNA的表达
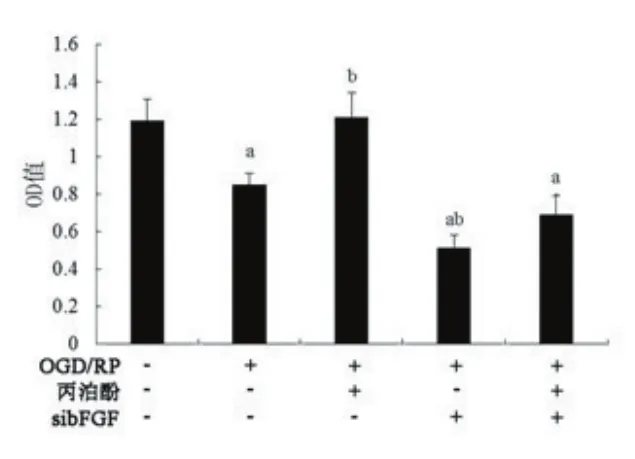
图5 各组细胞活性的测定
2.5pAKT和pERK1/2的表达采用Western blot检测丙泊酚对PI3K-AKT和ERK1/2信号通路的作用(见图6)。丙泊酚能够激活PI3K-AKT和ERK1/2信号通路,上调pAKT和pERK1/2的表达,当bFGF沉默以后,这种作用受到显著抑制(P<0.05)。并且,采用PI3K-AKT或ERK1/2通路的抑制剂LY294002或U0126能够显著抑制p-AKT和pERK1/2的表达(图6)。检测皮质神经元的增殖能力,加入PI3K-AKT或ERK1/2通路的抑制剂以后,能够削弱丙泊酚诱导的神经细胞的存活能力(P<0.05),见图7。
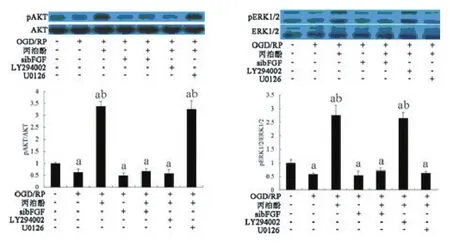
图6 加入两种信号通路阻断剂后pAPK和pERK1/2的表达情况
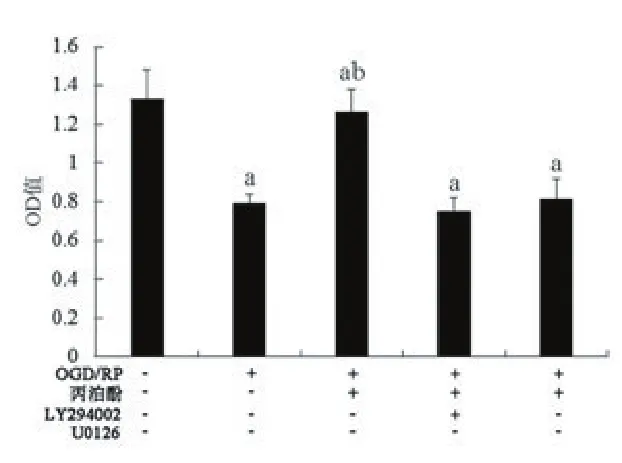
图7 加入两种信号通路阻断剂后各组细胞活性
3 讨论
缺血性脑血管疾病是神经系统常见病、多发病,也是目前致死、致残的一种主要原因[8]。脑部缺血会导致脑组织/细胞受损,而缺血后的血流恢复,有时会导致受损脑组织损伤加重,这种现象就是脑I/ RI。在脑I/RI中,神经元会发生凋亡和坏死,提高神经元的存活能力,控制其凋亡,是减弱脑I/RI的有效手段[9]。丙泊酚是临床上普遍使用的一种静脉麻醉药,目前有文献报道,在脑缺血/再灌注模型中,丙泊酚能够提高神经元的存活能力[10-11],但其具体的机制尚不明确。
本文采用OGD/RP处理原代培养的皮质神经元构建体外缺血/再灌注模型,证明丙泊酚能够促进I/ RI后神经元的存活能力,抑制细胞凋亡。研究提示,高表达bFGF能够促进神经元的存活和增殖,抑制神经元凋亡,从而削弱脑缺血性损伤[2]。进一步探讨丙泊酚发挥作用的具体机制,结果显示丙泊酚能够促进bFGF表达,促进神经元增殖,抑制神经元凋亡。为了证实丙泊酚通过上调bFGF表达抑制脑I/IR,我们采用siRNA构建bFGF缺失的神经元,结果显示bFGF沉默能够很大程度的削弱丙泊酚对皮质神经元的保护作用。这些结果提示,丙泊酚在I/ RI中具有神经元保护作用,并且这种保护作用与丙泊酚对bFGF表达上调密切相关。
PI3K-AKT信号通路在细胞生长、增殖和存活过程中发挥非常重要作用,有研究证实该通路的激活与药物治疗脑I/RI密切相关[12-13]。研究提示,ERK1/2通路的活化与多种麻醉药在缺血性脑组织中所诱导的神经保护作用相关[14]。Wang等[15]的研究显示,丙泊酚能够激活PI3K-pPKB以及ERK1/2信号通路抑制缺血后氧化损伤所引起的内质网应激。因此,我们采用western blot检测这两个信号通路在丙泊酚预处理的细胞中的激活状况,结果显示与正常对照组比较,在缺血/再灌注模型中,PI3K-pPKB以及ERK1/2信号通路的激活受到抑制,而采用丙泊酚处理以后,能显著上调pPKB以及pERK1/2的表达,表明这两个信号通路被激活。当采用sibFGF沉默bFGF在皮质神经元中的表达以后,PI3K-pPKB以及ERK1/2信号通路的激活受到抑制,与单独丙泊酚处理组比较差异有统计学意义。并且,采用PI3K-pPKB或ERK1/2通路的抑制剂LY294002或U0126处理细胞,显著抑制p-PKB和p-ERK1/2的表达,我们检测了这两种抑制剂对细胞存活能力的影响,结果证实,当PI3K-pPKB或ERK1/2通路激活受到抑制以后,丙泊酚对细胞增殖的影响明显减弱。
本研究结果显示,丙泊酚可以上调bFGF的表达,进而激活PI3K-pPKB和ERK1/2信号通路,促进神经元的存活,抑制细胞凋亡,削弱脑I/RI。
[1]Nitatori T,Sato N,Waguri S,et al.Delayed neuronal death in the CA1 pyramidal cell layer of the gerbil hippocampus following tran⁃sient ischemia is apoptosis[J].J Neurosci,1995,15(2):1001-1011.
[2]Watanabe T,Okuda Y,Nonoguchi N,et al.Postischemic intraven⁃tricular administration of FGF-2 expressing adenoviral vectors im⁃proves neurologic outcome and reduces infarct volume after tran⁃sient focal cerebral ischemia in rats[J].J Cereb Blood Flow Metab,2004,24(11):1205-1213.
[3]Wang HY,Wang GL,Yu YH,et al.The role of phosphoino-sit⁃ide-3-kinase/Akt pathway in propofol-induced postconditioning against focal cerebral ischemia-reperfusion injury in rats[J].Brain Research,2009,1297(10):177-184.
[4]赵其宏,张颖,陈兰仁,等.磷脂酰肌醇-3-激酶/丝氨酸苏氨酸蛋白激酶/内皮型一氧化氮合酶信号通路在二氮嗪后处理缺血/再灌注大鼠心肌中的作用 [J].国际麻醉学与复苏杂志,2013,34 (7):581-583.
[5]Wang H,Luo M,Li C,et al.Propofol post-conditioning induced long-term neuroprotection and reduced internalization of AMPAR GluR2 subunit in a rat model of focal cerebral ischemia/reperfusion [J].J Neurochem,2011,119(1):210-219.
[6]Gong QH,Wang Q,Shi JS,et al.Inhibition of caspases and intra⁃cellular free Ca2+concentrations are involved in resveratrol protec⁃tion against apoptosis in rat primary neuron cultures[J].Acta Phar⁃macol Sin,2007,28(11):1724-1730.
[7]Wang Y,Jiang YF,Huang QF,et al.Neuroprotective effects of sal⁃vianolic acid B against oxygen-glucose deprivation/reperfusion damage in primary rat cortical neurons[J].Chin Med J(Engl), 2010,23(24):3612-3619.
[8]Sharma T,Airao V,Panara N,et al.Solasodine protects rat brain against ischemia/reperfusion injury through its antioxidant activity [J].Eur J Pharmacol,2014,725:40-46.
[9]Hafeez A,Elmadhoun O,Peng C,et al.Reduced Apoptosis by Eth⁃anol and Its Association with PKC-δ and Akt Signaling in Isch⁃emic Stroke[J].Aging Dis,2014,5(6):366-372.
[10]Hutt A,Longtin A.Effects of the anesthetic agent propofol on neu⁃ral populations[J].Cogn Neurodyn,2010,4(1):37-59.
[11]Adembri C,Venturi L,Tani A,et al.Neuroprotective effects of pro⁃pofol in models of cerebral ischemia:inhibition of mitochondrial swelling as a possible mechanism[J].Anesthesiology,2006,104(1): 80-89.
[12]Cantley LC.The phosphoinositide 3-kinase pathway[J].Science, 2002,296(5573):1655-1657.
[13]Zhou Y,Lekic T,Fathali N,et al.Isoflurane posttreatment reduc⁃es neonatal hypoxic–ischemic brain injury in rats by the sphingo⁃sine-1-phosphate/phosphatidylinositol-3-kinase/Aktpathway[J]. Stroke,2010,41(7):1521-1527.
[14]Gray JJ,Bickler PE,Fahlman CS,et al.Isoflurane neuroprotection in hypoxic hippocampal slice cultures involves increases in intra⁃cellular Ca2+and mitogen-activated protein kinases[J].Anesthesi⁃ology,2005,102(3):606-615.
[15]Wang Z,Zhang H,Xu X,et al.bFGF inhibits ER stress induced by ischemic oxidative injury via activation of the PI3K/Akt and ERK1/2 pathways[J].Toxicol Lett,2012,212(2):137-146.
(收稿:2015-02-22修回:2015-04-16)
(责任编辑李文硕屈振亮)
Relationship between Influence of Propofol on Neurons IRI and Two Signal Paths PI3K pPKB and ERK1/2
ZHOU Guo-qiang,GONG Xiao-jie,FU Rui,et al.The Second People's Hospital of Tianjin,Tianjin (300192),China
ObjectiveTo study the effect of propofol on cerebral ischemia/reperfusion injury(CI/RI)and the relative mechanism.MethodsThe cerebral ischemia/reperfusion model was produced by oxygen glucose deprivation and reperfusion in vitro.Cells were grouped into control group,OGD/RP group and propofol+OGD/ RPgroup.Methyl thiazolyl tetrazolium(MTT)assay was used to detect the proliferative effect of propofol.Apoptot⁃ic cells were detected with Annexin V staining.The expression level of basic fibroblast growth factor(bFGF) mRNA was measured by RT-PCR.The expression levels of bFGF,phosphorylated protein kinase B(pPKB)and phosphorylated extracellular signal-regulated kinase 1/2(pERK1/2)protein expression were detected byWestern blotting,silence of bFGF in cortical neurons by small interfering RNA.ResultsPropofol could signif⁃icantly promote the viability of neurons and inhibit cell apoptosis after ischemia reperfusion injury.The apopto⁃sis rate of neurons in oxygen-glucose deprivation/reperfusion(OGD/RP)group was 43.2%.After treated with 10 mg/L propofol,the apoptosis rate of neurons was reduced to 19.5%.The expression levels of bFGF protein in OGD treated group were significantly lower than those in the control group(P<0.05),and the bFGF level was markedly upregulated in propofol treated group(P<0.05).Propofol could upregulate the expression of pPKB and pERK1/2,and activate the two signaling pathways.Silence the expression of bFGF or treatment with the in⁃hibitor of phosphotylinosital 3 kinase-protein kinase B(PI3K-pPKB)and pERK1/2 signal pathway both resulted in the decrease of neurons viability(P<0.05),and the inhibition of PI3K-pPKB and pERK1/2 activation. ConclusionPropofol can activate PI3K-pPKB and pERK1/2 signal pathway via upregulating the expression of bFGF,and promote the survival of cortical neurons.
Propofol;cerebral ischemia/reperfusion injury;basic fibroblast growth factor;phosphotylinosital 3 kinase-protein kinase B;phosphorylated extracellular signal-regulated kinase 1/2
R971+.1
A
1007-6948(2015)03-0274-05
10.3969/j.issn.1007-6948.2015.03.019
天津市第二人民医院麻醉科(天津 300192)
周晓东,E-mail:dapanjin@sina.com

